七氟醚后处理对缺血缺氧性脑损伤新生大鼠行为学及海马中BDNF表达的影响
牛佳媛,吴子怡,薛杭,李星樾,李畅,赵平
(中国医科大学附属盛京医院麻醉科,沈阳 110004)
新生儿缺氧缺血性脑病(hypoxic-ischemic encephalopathy,HIE)是指围产期由于各种因素引起的新生儿缺血缺氧性脑损伤(hypoxic-ischemic brain injury,HIBI)综合征,是造成新生儿中枢神经系统异常及早期死亡的重要原因之一[1]。目前临床应用最广泛的治疗方法是亚低温结合其他对症治疗,然而疗效并不显著[2]。七氟醚作为一种新型的吸入麻醉药,具有诱导速度快,刺激性小,血流动力学稳定等优点,广泛应用于婴幼儿全身麻醉诱导及术中维持。研究[3]表明,七氟醚后处理能减少神经元损伤,发挥对新生大鼠HIBI的保护作用,但是对于大鼠运动活动度、情绪等远期行为学的相关研究甚少。本研究通过旷场实验、Morris水迷宫实验,评估七氟醚后处理对HIBI新生大鼠的运动度、情绪及空间学习记忆能力的影响,并通过检测海马记忆相关蛋白——脑源性神经营养因子(brain derived neurotrophic factor,BDNF)的表达水平,进一步探讨七氟醚后处理对HIBI新生大鼠远期行为学影响的分子机制。
1 材料与方法
1.1 实验动物与分组
清洁级新生7日龄SD大鼠,体质量12~16 g,由中国医科大学附属盛京医院本溪医药研究教育发展基地提供,采用随机数字表法将大鼠分为3组:假手术组(Sham组)、缺血缺氧模型组(HI组)、七氟醚后处理组(HIS组),每组10只。本实验严格按照国际伦理准则以及国家卫生研究院实验室动物护理与使用指南进行,并经中国医科大学附属盛京医院医学伦理委员会审查批准(2017PS020K)。
1.2 模型制备及干预
参照ZHAO等[4]的方法制备HIBI模型:面罩吸入七氟醚维持麻醉,显微镜下用7-0丝线2次永久结扎左侧颈总动脉,缝合伤口且清醒后返回母鼠身边继续喂哺2 h,自制缺氧箱置于水浴箱中,水浴温度为37 ℃,持续输入8%O2+92%N2的湿化混合气体(2 L/min)2 h。Sham组仅暴露左颈总动脉但不结扎,不进行低氧处理,其余2组均进行缺血缺氧处理。HIS组新生大鼠HIBI后即刻吸入由30%O2+70%N2湿化混合气体输送的2%七氟醚30 min,Sham组、HI组吸入不含七氟醚的30%O2+70%N2湿化混合气体30 min。
1.3 旷场实验
制模后28 d行旷场实验。旷场实验设备主要由1个50 cm×50 cm×40 cm 的黑色箱组成,底部被划分为16 个虚拟正方格,沿侧壁格为外周格(周边区),其余为中央格(中央区),正上方有录像检测系统并与计算机分析软件系统连接。将小鼠放在正中央区,系统开始同步自动记录大鼠10 min穿越周边区与中央区的时间、路程。每只大鼠实验结束后清除箱内粪便,75%乙醇喷洒箱底并用洁净纱布擦干,避免留有气味影响其他大鼠结果。实验结束后应用SMART系统对数据进行分析。
1.4 Morris水迷宫实验
大鼠旷场实验结束后行Morris水迷宫实验,包括定位航行实验和空间探索实验[5-6]。水迷宫为黑色壁圆形游泳池(直径160 cm,深度60 cm),平均分为四个象限,第四象限内距池壁边缘 30 cm 处隐藏逃生平台(直径12 cm),位于水面下约1.5 cm处,水温控制在(20±1)℃,水池上方安装有自动监视系统,同步记录大鼠在水池里的运动情况。实验前1 d分别将各组大鼠放入水池(不含平台)中自由游泳90 s,使其熟悉水池环境。每天8:00行定位航行试验,共5 d。大鼠面向池壁,按随机顺序分别从4个象限的入水点将其放入水中,强迫其寻找水下平台。图像监视系统自动追踪记录其从入水到爬上平台的总路程及爬上平台所需的时间,即逃离潜伏期,如果大鼠在 90 s 内自行找到平台则让其在平台上停留 20 s,再进行下一只大鼠实验;如果入水90 s 内不能找到平台,则将大鼠引导上平台并使其停留 20 s,此时认定其逃逸潜伏期为 90 s。每天测定 4 次,每次间隔时间至少 30 min,计算4 次逃离潜伏期时间的平均值。每次试验结束后将大鼠擦干后放回笼中,注意保暖,自由饮食水;每个训练日结束后清理水迷宫更换新水以消除嗅觉与环境因素的干扰。定位航行实验结束后1 d,将平台从迷宫中移除,行空间探索实验:将大鼠放置于第二象限入水点,大鼠90 s内游过平台区域的次数为穿越平台次数。
1.5 蛋白免疫印记检测
大鼠完成行为学实验后,每组取5只大鼠,提取总蛋白,采用BCA法进行蛋白定量。恒定电流电泳分离,然后以200 mV恒定电压湿转至PVDF 膜,5%脱脂奶粉室温封闭2 h 后,TBST 洗膜,加入兔抗鼠BDNF多克隆抗体(1∶1 000,美国Abcam公司),4 ℃过夜孵育,TBST洗膜3 次,每次10 min,山羊抗兔二抗(1∶2 000,中国中杉新桥公司)室温孵育2 h,TBST洗膜3 次,每次10 min,ECL 发光,GADPH(1∶2 000,美国Proteintech公司)作为内参照。
1.6 免疫组织化学检测
每组取3只大鼠,4%多聚甲醛灌流,石蜡包埋,连续切片。行免疫组化染色[BDNF(1∶500,美国Abcam公司)]。每只大鼠选取2张海马冠状面切片,在高倍显微镜(×400)下随机选取CA1及CA3区3个不重叠的视野(50 μm×50 μm)进行观察,BDNF阳性细胞胞质呈棕黄色,计算BDNF阳性细胞数目,取3个视野的平均值作为BDNF的表达水平。
1.7 统计学分析
实验数据采用SPSS 21.0 统计软件进行分析。计量资料以表示,组间比较采用单因素方差分析,均数间两两比较采用LSD检验;P<0.05为差异有统计学意义。
2 结果
2.1 旷场实验结果
结果显示,各组大鼠中央区停留时间、运动总路程、粪便数量比较,差异均无统计学意义(P>0.05)。见表1。
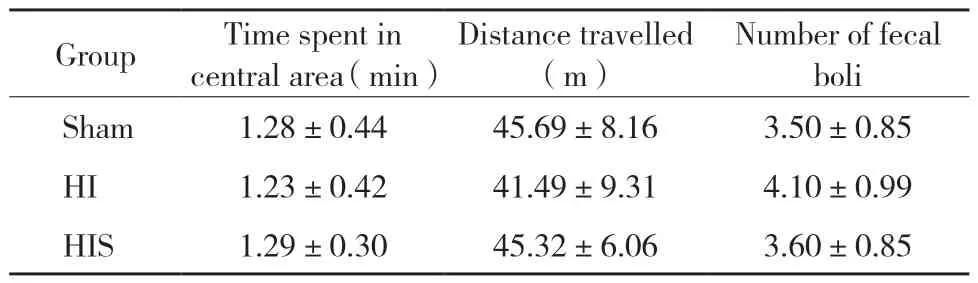
表1 各组大鼠中央区停留时间、运动总路程、粪便数量比较Tab.1 Comparison of the time spent in the central area,distance travelled,and number of fecal boli of rats from each group
2.2 Morris水迷宫实验结果
结果显示,与Sham组比较,HI组、HIS组大鼠潜伏期明显延长(P<0.05);与HI组比较,HIS组潜伏期缩短(P<0.05)。空间探索能力测试结果显示,与Sham组比较,HI组、HIS组大鼠平台穿越次数均减少(P<0.01);与HI组比较,HIS组穿越次数增加(P<0.05)。见表2。

表2 3组水迷宫实验结果比较Tab.2 Results of the Morris water maze test among the three groups
2.3 3组大鼠海马中BDNF表达比较
蛋白免疫印记结果显示,Sham组、HI组、HIS组BDNF表达分别为1.00±0.55,0.21±0.18,0.83±0.23。与Sham组比较,HI组大鼠BDNF蛋白表达水平显著降低(P<0.01);与HI组比较,HIS组BDNF蛋白表达水平显著升高(P<0.01)。免疫组化结果显示,神经元胞质染色为棕黄色表示BDNF阳性。Sham组、HI组、HIS组阳性神经元数分别为:CA1区,9.06±0.98,3.78±1.31,6.33±0.60;CA3区,9.72±0.83,3.56±0.66,6.50±0.62。与Sham组比较,HI组大鼠左侧海马CA1及CA3区阳性神经元数目明显减少(P<0.01);与HI组比较,HIS组左侧海马CA1及CA3区阳性神经元数目增加(P<0.01),与蛋白免疫印记检测结果一致。见图1。
3 讨论
HIBI研究成功的关键是建立合适的缺氧缺血模型。本研究参照课题组前期实验中改进后的经典Rice法[7],将新生7 d大鼠行左侧颈总动脉结扎并进行缺氧处理,从而构建了新生大鼠HIBI模型。
本课题组前期研究[4,8]表明,新生大鼠HIBI可导致远期学习记忆功能障碍。本研究通过Morris水迷宫检测证实,与Sham组比较,HI组逃逸潜伏期显著延长,穿越平台次数显著减少,学习记忆能力明显下降。而旷场实验结果显示了各组大鼠运动活动度与焦虑情绪的变化,各组大鼠运动总路程、中央区停留时间、粪便数量均无统计学差异(均P>0.05),表明HIBI并未导致大鼠成年后出现运动活性降低及额外的焦虑情绪,也可以排除运动活性及焦虑情绪对大鼠学习记忆的影响。
近年来,大量研究[4,9]表明异氟醚后处理能够减轻HIBI新生大鼠脑损伤程度,并且具有长期保护作用。而同属于吸入麻醉药的七氟醚,目前更常用于小儿麻醉的诱导与维持,最新研究[3]表明七氟醚后处理同样对HIBI新生大鼠脑损伤具有神经保护作用,本研究通过Morris水迷宫实验证实七氟醚后处理可以明显改善HIBI新生大鼠远期空间学习记忆能力,与LAI等[10]实验结果一致。
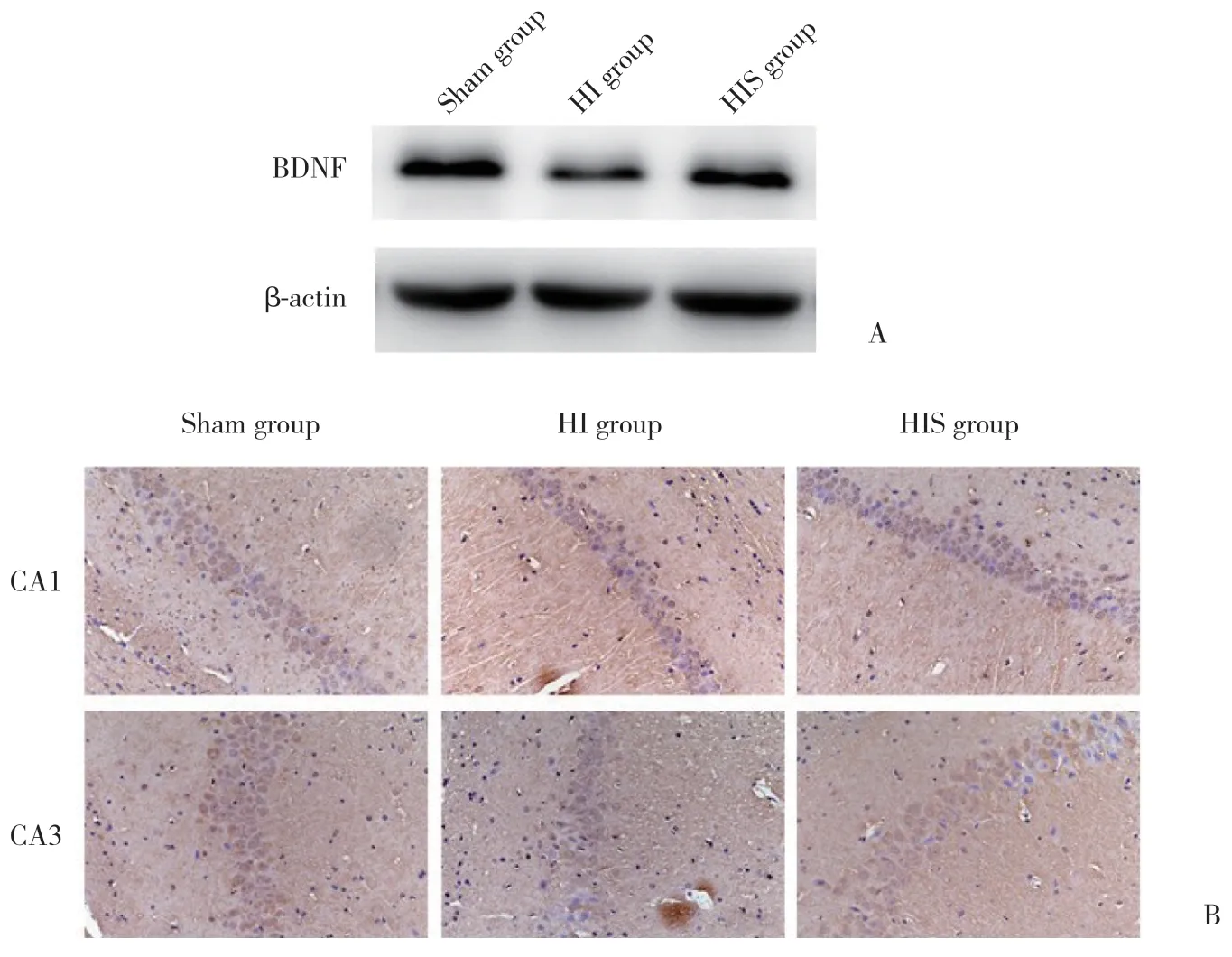
图1 各组大鼠海马BDNF表达水平Fig.1 The expression of BDNF in the hippocampus of rats from each group
BDNF作为神经营养因子家族成员,广泛分布于中枢和周围神经系统中,对中枢系统神经元生长、分化及损伤修复至关重要[11]。研究表明,BDNF可诱导神经元生存及成熟,增强突触信息传递,从而有利于信息存储,提高记忆及认知功能[12-13];空间学习记忆形成时BDNF表达水平增加,反之BDNF基因敲除则导致认知功能减退[14-15]。本实验结果显示与Sham组比较,HI组大鼠海马组织中BDNF表达水平明显降低,而七氟醚后处理可以提高BDNF表达水平,可见BDNF的表达与学习记忆能力程度相关,由此推论BDNF可能在七氟醚后处理改善HIBI新生大鼠远期空间学习记忆能力过程中发挥一定的作用。
综上所述,七氟醚后处理能促进HIBI模型大鼠海马组织中BDNF蛋白表达,从而改善HIBI新生大鼠的远期学习记忆能力。本研究结果为七氟醚后处理对HIBI的保护作用及其分子机制奠定了研究基础。

