胃内微生态与胃部疾病关系的研究进展
刘 芳,梁 田,李岩松,白 骕,康龙丽
刘芳,梁田,李岩松,康龙丽,西藏民族大学医学院,西藏高原相关疾病分子遗传机制研究与干预重点实验室,西藏民族大学环境与疾病相关基因研究高校重点实验室 陕西省咸阳市 712082
白骕,西藏民族大学附属医院消化内科 陕西省咸阳市 712082
核心提要:胃内微生态特别是幽门螺杆菌(Helicobacter pylori,H.pylori)与胃部疾病密切相关,探究H.pylori与胃内其他微生物的相互作用,及其在胃部疾病中的特征和机制,有助于对胃部疾病的诊治提供新的策略.
0 引言
由于胃内高酸环境及不断蠕动等特点,过去一度认为胃是无菌的环境,直到1982年幽门螺杆菌(Helicobacter pylori,H.pylori)的发现改变了这一观点,同时也发现这一细菌引起了多种胃部疾病[1].随着研究手段的发展,从依赖细菌培养的传统检测方法,到宏基因组学高通量测序技术的应用,这些现代技术帮助我们对微生物认识的深入,发现胃内除了H.pylori,还有其他的细菌共同构成了胃内微生态,也揭示胃微生物群和胃部疾病之间关系.在不同疾病状态下,胃内的微生物群落各有特点,各类群落间又相互作用.因此,越来越多的证据表明,H.pylori尽管是多种疾病微生物方面最相关的病因,但其它细菌的存在可能协同或者拮抗它的作用,导致胃部疾病的发生.本文综述了H.pylori及胃内其他微生物的最新发现及其在胃病进展中的作用,旨在为基于微生态的胃部疾病诊治策略提供新的思路.
1 胃内微生态环境
之前的研究认为,胃内粘液层、胃酸构成了生理屏障,并提出了“胃是无菌器官”的概念[2],而后H.pylori的发现,推翻了这一说法.随着检测技术的进一步发展,宏基因组学高通量测序技术的应用,人们发现胃内存在独特和复杂的菌群结构.微生物种属和数量虽然没有下消化道多,但是胃在消化道中独特的酸性环境,构成了独特的微生物群.胃环境中细菌的多样性与口腔和食道中的细菌多样性有显著差异,说明人类胃部可能是一个独特的微生物群落.随着检测技术的进步,还发现一些过路菌如乳酸菌、梭菌等.虽然它们在胃内停留时间较短,但是这些暂时性的细菌联合穿过粘液层的能力引起了人们的关注.Delgado等[3]采用了古典培养和独立培养技术相结合的方法,发现丰富较高的细菌主要是链球菌、乳酸菌和丙酸杆菌.Bik等[4]通过使用小亚基16S rRNA基因克隆文库方法,分析胃活检样本并鉴定出128个种系型,主要分为五种不同的细菌门类:变形菌门(相对丰度51.9%)、厚壁菌门(25.3%),拟杆菌门(10.5%),放线菌门(9.0%)和梭杆菌门(3.1%).此外,作者对健康个体胃黏膜中的优势菌种进行了汇总(表1)[3-6].发现不同的研究显示出不一致的结果,这可能是由于胃内微生态受到了饮食、环境、年龄、益生菌和抗生素使用的影响,以及不同检测方法导致结果的差异[7].随着基因组测序、荧光原位杂交、代谢组学和细菌转录分析等现代技术的发展,科学家们可以深入地了解胃生态系统及其在健康和疾病中的分子机制,鉴定细菌的功能特征和理解微生物与宿主之间复杂的相互关系.
2 胃部微生物及相互影响
2.1H.pyloriH.pylori是现代公认的慢性胃炎和胃溃疡的重要诱因,也是导致胃癌(gastric cancer,GC)和胃淋巴瘤的危险因素之一,是一级致癌物[8],它是一种革兰氏阴性杆菌,螺旋形、微需氧、有鞭毛,主要分布在胃黏膜组织中.H.pylori能产生尿素酶,创造碱性环境,这是H.pylori在胃黏膜屏障下生存的关键.它还表达粘附素,促进细菌附着在胃上皮,如血型抗原粘附素(blood group antigen binding adhesion,BabA)或炎症蛋白粘附素(outer inflammatory protein A,OipA)[8].这些功能都有助于细菌在这种不利的酸性环境中定殖和存活,继而产生复杂的炎症反应,损伤胃黏膜并引起相关消化系统疾病.H.pylori的毒力通过各种致病性标志物表达,如细胞毒素相关基因A(cytotoxin-associated gene A,CagA),BabA粘附素和空泡细胞毒素(vacuolating cytotoxin A,VacA)[9],也是目前胃病发展研究的新焦点.研究表明,VacA和CagA可以相互调节,CagA可以拮抗VacA诱导的细胞凋亡,并激活MAPK/ERK通路和抗凋亡因子MCL1介导的细胞存活途径,从而影响宿主反应[10].CagA还可激活VacA所拮抗的NFAT和EGFR通路[10,11].此外,VacA通过多种癌症相关途径参与GC的发生,如Wnt/b-catenin、PI3K/Akt信号通路[12-14]和VEGF通路[15].CagA、VacA+的H.pylori可诱导上皮-间质转化,从而参与肿瘤进展[16].有研究表明,虽然几乎所有H.pylori菌株都含有VacA基因,可编码空泡细胞毒素,但大约半数的菌株都不表达该毒素,因此不同基因型的菌株会对宿主产生不同的临床表现.
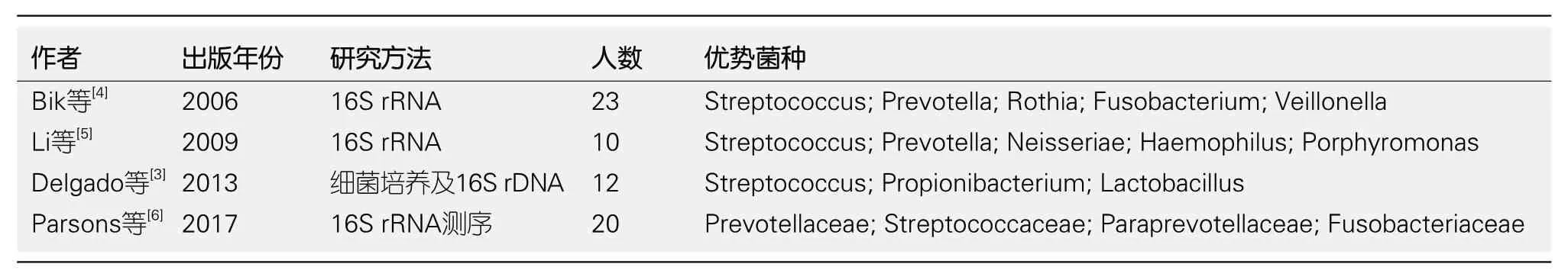
表1 胃内优势菌种分析研究汇总
2.2H.pylori与胃内其它菌群的关系H.pylori与其他胃内菌群间的相互作用似乎比原先想象的要复杂得多.H.pylori首先改变自己的微环境,分解尿素生产氨和碳酸氢盐的产物,可作为其他微生物群落的底物.此外,它还使胃酸分泌减少,从而提高了胃的pH值,为其他微生物的定植创造了有利的生态环境.另一方面,H.pylori能诱导细胞因子和抗菌肽的产生,从而导致慢性胃炎症,抑制其他局部微生物[17].有研究表明,成人和儿童感染H.pylori时,它在所有胃微生物群落中的相对丰度最高[4,18].Khosravi等[19]研究发现,131例H.pylori阳性者与84例H.pylori阴性个体胃微生物组成无显着性差异,H.pylori的存在对胃微生物群的多样性无明显影响.但是H.pylori感染后胃黏膜中细菌生物多样性的研究尚存在争议.这些研究结果的差异可能是由于不同菌株的H.pylori对胃内其它细菌的影响及检测方法敏感度的不同,对结构的分析造成困难所致.
有研究表明胃内H.pylori感染可以影响胃和十二指肠中微生物的种类和数量,抑制乳酸杆菌的增殖,而肠球菌、葡萄球菌等几乎不受影响[20].Osaki等[21]还描述了长期H.pylori感染可以改变啮齿动物胃中微生物的组成.Okamoto等[22]研究发现H.pylori与人呼吸道的一种共同存在的耐酸金氏菌混合后,H.pylori在酸性条件下的存活率比单独培养的H.pylori明显增加,两者的结合似乎保护了细菌体,使H.pylori在酸性条件下存活.其他报道也表明,某些种类的乳酸菌具有很强的拮抗作用,并能抑制H.pylori的生长[23].同样,链球菌是胃环境中的一种常见细菌,它很可能抑制H.pylori细胞的生长并促使H.pylori的形状由螺旋形变为球形[24].这些发现都证明了H.pylori与胃微生物群落之间存在着密切的联系.
由于胃生态系统的结构受多种因素影响,因此需要进一步的实验来确定H.pylori与其他胃微生物的确切关系,从而更好地了解H.pylori及其他细菌在健康和疾病中的作用.
3 胃内微生物与胃部疾病的关系
3.1 慢性萎缩性胃炎 慢性萎缩性胃炎(chronic atrophic gastritis,CAG)是常见的消化道慢性疾病,其特征是胃黏膜内固有腺体减少,伴或不伴有肠上皮化生.有研究表明萎缩性胃炎是一种癌前疾病,特别是伴有腺体不典型增生时癌变率更高,因此,早期诊断可以显著降低死亡率[25].该病的主要原因是持续的H.pylori感染,可能导致癌症发展[26].
H.pylori诱导的免疫反应是导致胃黏膜损伤的重要因素.在H.pylori感染过程中,脂多糖和表面蛋白释放并刺激促进细胞和巨噬细胞产生促炎因子,如白细胞介素(interleukin,IL) -1、IL-8和活性氧[27].此外,H.pylori本身可以与上皮细胞相互作用产生IL-8、金属蛋白酶-10[28,29].这些炎症介质的释放可诱导白细胞中CD11b/CD18和内皮细胞中细胞粘附分子-1的表达,促进白细胞迁移至炎症部位并最终导致CAG[30].
在CAG患者中观察到,胃酸屏障的减少使胃内有更多的微生物定植,这在健康胃内较少发生.总体而言,亚洲患者血清胃蛋白酶原Ⅰ/胃蛋白酶原Ⅱ比值与微生物丰度呈正相关[31].此外,与正常胃相比,H.pylori诱导的CAG患者胃中的坦纳菌,密螺旋体和雷沃氏菌的比例显著低于正常胃[32].
3.2 自身免疫性胃炎 自身免疫性胃炎(autoimmune gastritis,AIG)是一种自身免疫功能失调所致疾病,其特征是胃黏膜的慢性进行性炎症,最终演变为萎缩性胃炎.与CAG不同,AIG并非由H.pylori感染所致,而胃内微生态表现也有所不同.研究表明[7],AIG患者胃内细菌丰度及多样性高于CAG患者及健康人群,以链球菌为主.这可能是由于淋巴细胞、浆细胞浸润胃黏膜,破坏壁细胞及主细胞,最终导致胃酸分泌减少所致;其次,AIG胃内免疫背景的不同,可能也是胃内细菌丰度及多样性较高的原因[30].现有对AIG胃内微生态特征性研究还较少,还有待进一步研究加深认识.
3.3 消化性溃疡病 消化性溃疡病(peptic ulcer disease,PUD)是胃及十二指肠黏膜屏障功能减退及胃酸和胃蛋白酶的消化作用增强,导致黏膜损伤、断裂至黏膜下层.H.pylori感染是PUD的微生物方面的重要病因,然而,细菌毒力与宿主的相互作用决定病变程度.有研究表明,CagA及其他细菌毒力因子与宿主组织有很强的相互作用,并与胃黏膜炎症细胞浸润和胃上皮损伤有关[23,24,33].
在一项基于细菌培养的研究中发现,胃溃疡组与非溃疡性消化不良组相比,非H.pylori类细菌的定植率较低[34].此外,另一项研究采用16 SrRNA进行了测序发现,链球菌与PUD之间存在显着相关性[19].这项研究虽然可能受地域等因素的影响,但是也提出了PUD除了H.pylori以外的其他微生物病因的可能,提示H.pylori以外的细菌也许通过复杂的机制和相互作用,促进胃十二指肠疾病的发生.
3.4 GC GC是世界上第四大常见癌症,是癌症相关性死亡的第二大原因,发展中国家高发[35],在中国,许多被诊断患有GC的患者通常处于晚期阶段[36].H.pylori感染是GC的最大危险因素,是全世界近75%GC的罪魁祸首[37].如前所述,H.pylori感染引发胃黏膜炎症,导致黏膜萎缩,并可能随后导致癌症发展.此外,H.pylori菌株变异、宿主反应和环境因素也是GC发展的关键因素[38].虽然H.pylori是GC发生最相关的微生物危险因素,但胃内其他菌种无疑与GC的发生有关.细菌在胃黏膜中的过度生长已经在各种癌前疾病中被发现,甚至还发现病毒或真菌在胃黏膜的定居[39].其原因可能是由于H.pylori感染导致胃酸产生过少,也可能是由于癌性黏膜有利于细菌增殖.而有些细菌如韦荣球菌、梭菌、嗜血杆菌和葡萄球菌可增加亚硝酸盐的产生,长期积累又促进GC的发展.GC患者胃黏膜富集的细菌是乳酸菌、链球菌、普雷沃式菌、韦荣球菌[40].有研究通过比较CAG与GC患者胃黏膜微生物群落的生物多样性、结构和组成,发现GC患者的微生物结构更为多样.GC患者黏膜中以变形杆菌、厚壁菌、拟杆菌、梭杆菌和放线菌为主,这一特征可能与GC的发生发展有关[36],该研究还发现β-变形菌纲和γ-变形菌纲在GC患者胃黏膜中富集,这些发现揭示了非H.pylori变形菌可能与GC密切相关.微生物的多样性、结构和胃微生物群的组成可以影响GC的发展[41].Eun等[42]显示GC、肠化生和慢性胃炎患者的胃微生物群落存在差异,并表明胃共生菌群可能在H.pylori的致癌性中发挥了一定作用.然而,另一种可能的解释是,由于H.pylori诱导的组织学变化而导致的胃酸改变使得胃上皮更容易受到其他微生物影响.慢性胃炎、肠化生和GC患者胃微生物的多样性和丰富性显示,与其他组相比,GC中的杆菌种类有所增加[2],然而,最近的一项研究显示,GC患者的微生物群落的特征是微生物多样性降低,螺杆菌丰度降低[43].
微生物可以通过几种机制来驱动和导致癌症的发生发展,包括刺激炎症、诱导细胞增殖、破坏干细胞生理调节以及产生不利健康的代谢物[44].因此,了解H.pylori与胃肠微生物组之间的关系,对更好地理解GC的发生具有重要意义.
4 结论
从依赖培养研究的先驱时代转移到宏基因组学时代,随着对上消化道微生物群研究的深入,我们发现,胃微生物群在胃部疾病的发展和进展中起着至关重要的作用.H.pylori是消化性疾病重要的危险因素,并且根除这种细菌可以提供良好的疾病预后[45,46].然而,也有证据表明幽门螺旋杆菌感染对炎性肠病的潜在保护作用[47,48].H.pylori可能是人类的“土著微生物菌群”[33],它的丧失可能导致过敏和代谢疾病的增加,正如“消失的微生物群”假说[49]所描述的那样.
H.pylori只是胃内微生物群中的一小部分,胃内微生态与胃部疾病和健康状态关系密切,微生物群和胃黏膜之间相互作用的详细机制仍需要进一步阐明.最近的科学发现认为肠道微生物群可能作为炎症和肿瘤性胃肠疾病的未来诊断和治疗目标.我们应该积极探索胃内菌群相互之间的作用、谨慎地干预微生物组的结构,从全局出发,为临床消化性疾病的预防和治疗提供指导.

