乙酰辅酶A酰基转移酶1基因研究进展
王延莉,曹 阳,梁祎凡,肖 成,金花子,金海国*
(1.延边大学农学院,吉林延吉 133000;2.吉林省农业科学院畜牧分院,吉林公主岭 136100)
乙酰辅酶A 酰基转移酶1(Acetyl-CoA Acyltrans Ferase 1,ACAA1)又称过氧化物酶体3-羰基辅酶A硫解酶(Peroxisomal 3-Oxoacyl-CoenzymeA Thiolase,PTHIO),属于酰基辅酶 A 代谢酶超家族中的硫解酶家族[1-3]。ACAA1位于人类第3 号染色体的长臂 22 区2 亚区上(图1),编码区为1 275 bp,编码424 个氨基酸,包含12 个外显子,主要在肝脏、肾脏、十二指肠等组织中广泛表达。ACAA1 为酰基转移酶,分布在过氧化物酶体,通过催化β-氧化途径的最后一步参与脂肪酸的延伸和降解[4];是过氧化物酶体中脂肪酸β-氧化的关键调控酶,该基因在脂肪酸代谢中发挥着重要作用[5]。ACAA1 在人类肿瘤、癌症等疾病研究中可作为肿瘤标记物或生物治疗靶点,同时也可能是影响动物肉质性状的主要候选基因。本文综述了ACAA1基因的结构、表达、分子机制及其所参与的相关代谢反应。
图1 ACAA1 基因在基因组中的位置
1 ACAA1 基因的概述
乙酰辅酶A 酰基转移酶(Acetyl-Coenzyme AAcyltransferase,ACAA)属于酰基辅酶 A 代谢酶超家族中的硫解酶家族[1-3]包括乙酰辅酶A 酰基转移酶1(ACAA1)和乙酰辅酶A 酰基转移酶2(ACAA2)。ACAA1 分布在过氧化物酶体中[6],主要参与极长链脂肪酸(Very Long Chain Fatty Acids,VLCFAs)、长链脂肪酸(Long Chain Fatty Acids,LCFAs)支链脂肪酸(Branched Chain Fatty Acids,BCFAs)的β-氧化、胆汁酸代谢、过氧化物酶体增殖调控等生理生化过程[7-8],是过氧化物酶体中脂肪酸β-氧化重要的调控酶。
2 ACAA1 基因的作用机制
硫解酶在脂肪酸代谢中发挥重要作用[3],ACAA1基因编码硫解酶家族的酶,它不仅能够催化乙酰CoA的硫解,而且能够催化更长碳链的底物,参与脂肪酸的延伸和降解(图2)。脂肪酸分解代谢主要通过β-氧化,主要部位在线粒体和过氧化物酶体。线粒体的β-氧化包括脂肪酸的脱氢、水合、再脱氢、硫解4 个过程,使酯酰基断裂生成1 分子乙酰CoA 和1 个新的脂酰CoA,由此形成适宜长度的长链脂肪酸以供机体代谢所需。
过氧化物酶体β-氧化与线粒体β氧化相似,主要将VLCFAs 缩短,而后缩短碳链的脂肪酸可在线粒体中进一步氧化。动物线粒体和过氧化物酶体的主要生化差异在于第一步,将酰基CoA 转化为反式-2-烯酰基-CoA。在线粒体中,该反应由酰基CoA 脱氢酶催化,氧化失去的电子通过呼吸链与O2结合,最终生成H2O。在过氧化物酶体中,该反应由酰基CoA 氧化酶催化,电子直接与O2结合并产生H2O2,随后立即被过氧化氢酶裂解[9]。
过氧化物酶体β-氧化包括4 种活性酶:酰基-CoA氧化酶、烯酰-CoA 水合酶、3-羟基酰基-CoA 脱氢酶和3-酮酰基-CoA 硫解酶。该途径产生的主要中间体反式-2-烯酰基-CoA、3-羟基酰基-CoA 和3-酮酰基-CoA。人类和其他哺乳动物利用过氧化物酶体β-氧化代谢各种化合物包括:VLCFAs、LCFAs、BCFAs、胆汁酸代谢中间产物和多不饱和脂肪酸等;根据酰基-CoA 底物的链长,取代基和链结构的不同,该途径中使用的酶可能有所不同。过氧化物酶体β-氧化第4 步由ACAA1基因编码的3-酮酰基-CoA 硫解酶裂解产生1 分子乙酰 CoA 或丙酰CoA 和碳链缩短了的酰基CoA(n-2),后者经过几轮过氧化物酶体β-氧化后,产物通过肉毒碱转移系统穿梭到线粒体中彻底氧化为乙酰CoA,最终生成的乙酰CoA 参与三羧酸循环(TCA)氧化释放能量[10](图2)。综上推测,过氧化物酶体中β-氧化不彻底可能与过氧化物酶体中的相关酶对短链脂肪酸的亲和力较低相关。
ACAA1 在脂肪酸代谢中发挥着重要作用[5],可将脂肪酸β-氧化反应产生的乙酰CoA(2 分子)浓缩成乙酰乙酰CoA,乙酰乙酰CoA 与乙酰CoA 进行缩合反应,生成β-羟-β-甲基戊二酰-CoA(HMG-CoA),HMGCoA 在 HMG-COA 裂解酶的催化作用下生成乙酰乙酸,并释放出乙酰CoA。乙酰乙酸可通过还原反应及氧化脱羧反应分别生成β-羟丁酸或丙酮。肝脏中产生的酮体随着血液循环运输到心、脑、肾等各个肝外组织,然后经过一系列反应再生成乙酰CoA。最终乙酰辅酶A 参与到TCA 氧化释放能量以供机体代谢所需[11-12](图2)。
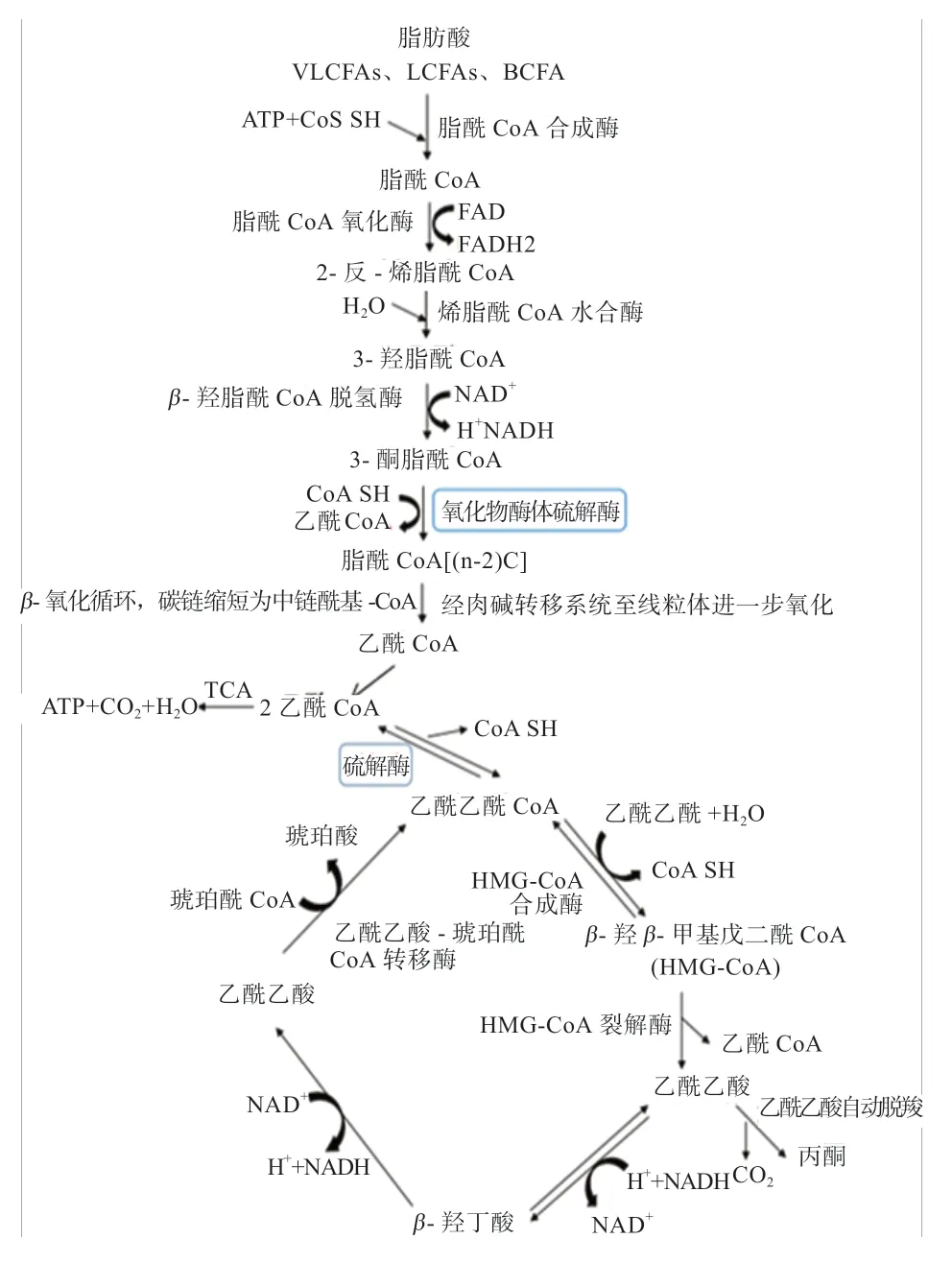
图2 ACAA1 基因的作用机制[6]
3 ACAA1 基因的生理功能
3.1ACAA1基因在过氧化物酶体中的研究 过氧化物酶体是普遍存在的具有不同代谢功能的单膜结合亚细胞细胞器[13]。哺乳动物过氧化物酶体含有一系列复杂的酶,对脂质代谢途径起着关键作用。过氧化物酶体负责合成初级胆汁酸、多不饱和脂肪酸和醚磷脂[14]。PPAR途径的靶点—ACAA1基因主要参与VLCFAs、BCFAs的β-氧化、胆汁酸代谢、过氧化物酶体增殖调控等生理生化过程[7-8]。过氧化物酶体缺失或酶的异常导致过氧化物酶体代谢的功能障碍[15]。过氧化物酶体疾病分为齐薇格综合征谱(Zellweger Syndrome,ZS)和过氧化物酶缺乏两大类。ZS 包括新生儿肾上腺脑白质营养不良、婴幼儿再灌注障碍、1 型根状软骨发育不良(RCDP)等,这些过氧化物酶体缺失病都存在β-氧化异常,体内VLCFAs、长链二羧酸、降植烷酸等分解障碍[9]。例如,研究发现ACAA1基因功能缺失与伪Zellweger 征相关,Zellweger 征是过氧化物酶体发育的原发性缺陷,继发于胆汁酸生物合成障碍。因氧化物酶的膜缺少转运蛋白,导致过氧化物酶不能对VLCFAs 进行氧化,积累在细胞质内形成片层状内含物,其可影响早期胚胎细胞的正常迁移,使胚胎产生多种畸形[13]。Sordillo 等[16]研究发现,ACAA1基因遗传多态性与内毒素暴露的儿童哮喘之间存在显著的相互作用。Krishnan 等[17]在研究早产儿常见遗传变异与白质发育之间可能存在的关系中发现,PPAR 信号通路成员ACAA1 与表型高度相关。该结果表明脂质途径,特别是PPAR 信号传导中个体间遗传变异在影响早产儿白质发育中具有重要作用。综上,深入研究ACAA1基因在过氧化物酶体中的作用机制,有望将该基因作为生物预防治疗靶点,为预防治疗相关疾病提供更多有价值信息。
3.2ACAA1基因在脂类代谢疾病中的研究 肿瘤细胞能量代谢异常被认为是恶性肿瘤的标志之一[18]。能量代谢主要包括糖酵解和脂肪酸代谢,糖酵解异常在很多肿瘤中己经得到证实。研究发现,肿瘤细胞中也普遍存在脂肪酸代谢异常,如脂肪酸代谢过程中信号通路转导异常、相关酶活性异常、代谢产物的异常增加或减少都可能促进肿瘤细胞的增殖。脂肪酸代谢作为能量代谢的主要形式之一,为细胞的快速分裂增殖提供其所必需的能量、生物信号及原料等[19]。研究发现脂肪酸的过度合成是恶性肿瘤形成的重要生化特征,多种与脂肪酸合成有关的关键酶在多种肿瘤中高表达[20]。研究发现ACAA1 在PPAR 途径中脂肪氧化过程起重要作用,当用药物诱导过氧化物酶体β-氧化时,ACAA1基因在脂肪酸代谢途径的转录表达活性从而受到了影响[21];如当用药物诱导肝脏脂肪酸代谢紊乱时,肝脏损伤程度越大,PPAR 表达下调幅度越大,两者呈负相关[22];另有研究在结肠癌中检测到PPAR 表达下调,推测其机制可能是PPAR 表达下调诱导脂肪酸代谢变化,促进结肠癌的增殖和生长[23]。近年来,研究报道ACAA1基因在多种肿瘤细胞中有不同程度的表达,如肝癌[24]、子宫内膜癌[25]、胃癌[26]等。黄润春[27]发现ACAA1基因在喉鳞状细胞癌、头颈部鳞状细胞癌、肺鳞癌、肝癌、肺腺癌等10 种肿瘤中表达显著下调,提示ACAA1基因转录下调可能是人类恶性肿瘤中普遍存在的现象,该结果与何峰[28]报道一致;何峰[28]发现鼻咽癌细胞中存在脂肪滴沉积现象,提示鼻咽癌的发生、发展可能与鼻咽癌细胞中的脂肪酸代谢异常密切相关;同时也发现ACAA1 在鼻咽癌和头颈部鳞状细胞癌、肺癌、肝癌等10 种恶性肿瘤中转录和表达均下调。
综上推测,ACAA1基因参与多种肿瘤的脂肪酸代谢途径。其机理可能是PPAR 表达下调影响ACAA1基因转录表达下调,诱导脂肪酸β-氧化紊乱,造成癌细胞脂肪过度合成,促进肿瘤癌细胞的增殖和生长。以上结果为阐明脂肪酸代谢在肿瘤、癌细胞的发生发展机制中的作用以及为预防治疗脂类代谢紊乱疾病提供新的思路和基础数据。
3.3ACAA1基因在脂代谢及肉质中的研究 脂肪沉积量不仅影响肉类的适口性,而且关乎人体健康。动物脂代谢受多种因素影响,其信号通路转导的调控网络复杂而精细,主要参与机体能量储备及供应、生物膜的构成以及一些重要的生命过程。脂代谢主要包括甘油三酯代谢、胆固醇及磷脂等。ACAA1基因编码硫解酶家族的酶,分布在细胞过氧化物酶体,是过氧化物酶体中脂肪酸β-氧化重要的调控酶,在脂肪酸代谢中发挥重要作用。
动物的肉质与肌内脂肪含量(IMF)含量密切相关。研究表明,IMF 能够影响肉质的嫩度、色泽和风味等感观指标,而脂肪含量又受脂代谢调控[4]。近年来该领域已成为畜禽肉类品质研究的热点,目前关于IMF 沉积规律性的研究主要集中在肉牛[29]、鸡[30]、猪[31],而绵羊IMF 发育规律及脂肪沉积的机制的研究相对较少,目前关于ACAA1基因的研究鲜见报道,且在畜牧领域的研究主要集中于探索该基因与肉质性状的相关性,以望利用分子遗传学筛选肉质性状优良的肉用家畜。目前已报道ACAA1基因与肉牛的眼肌面积存在相关性[13],但ACAA1基因的具体研究还存在很大发展空间,对ACAA1基因的深入研究可改善畜禽肉类中有益脂肪含量。Lisowski 等[32]对肉牛(Herefords)肝脏进行高通量测序发现,ACAA1基因上调参与脂肪酸生物合成和脂质代谢。推测ACAA1基因可能通过调控脂肪酸代谢而影响牛肉的品质,为进一步探索脂类代谢对肉品质的调控提供了新的参考依据。曹阳[33]对杜寒杂交羊(Test)和小尾寒羊(Control)进行转录测序组分析发现,与绵羊脂肪沉积相关的PPAR 信号通路和脂肪酸代谢通路成员ACAA1 转录水平存在显著差异,并且在脂肪酸代谢信号通路中占据节点位置。初步推测ACAA1基因可能通过调节脂代谢参与脂肪沉积过程,是影响脂类代谢的关键基因,为进一步探索ACAA1基因在调控肉羊脂代谢及肌内脂肪生成过程中的作用、提高绵羊肉质性状的选育提供新的思路及依据。
一些外源物可能通过间接调控ACAA1基因催化β-氧化,参与脂肪酸的延伸和降解;增强脂代谢及甘油三酯代谢,降低动物脂肪沉积,进而可能影响动物的肉类品质。张铃玉等[34]研究发现,摄食海参磷脂的小鼠肝脏ACAA1基因明显上调,且随喂养时间的延长2组差异增大;白色脂肪组织中β-氧化相关基因与肝脏组织有相近趋势。推测海摄食海参磷脂的小鼠肝脏中ACAA1基因的明显上调,增强了肝脏脂肪酸β-氧化及甘油三酯代谢,降低动物脂质积累。Zhu 等[35]研究发现,松子油(PNO)摄入导致高脂肪饮食(HFD)小鼠肝脏三酰甘油(TG)及参与脂类分解和脂肪酸氧化ACAA1 的mRNA 水平升高。这些结果表明PNO 的补充可以降低小鼠肠道脂质吸收,增加肝脏TG 代谢及脂肪酸氧化。Xie 等[36]研究发现,菠萝叶酚(PLP)显著降低了HFD 小鼠的腹部脂肪和肝脏脂质积累,并且发现非诺贝特(Fenofibrate,FB)与PLP 的效果相当。PLP 主要促进线粒体中CPT-1、UCP-1 的mRNA 表达,而FB 主要增强过氧化物酶体中ACOX1、ACAA1 的mRNA 表达,推测PLP 和FB 分别可能通过上调线粒体及过氧化物酶体中参与脂代谢基因的表达来增强肝脏脂代谢。
在动物科学领域,协同脂代谢调控研究动物脂肪细胞分化的调控机理,增加肌内脂肪沉积,减少皮下和内脏脂肪的积累,以实现对动物脂肪沉积的调控,从而改善肉类品质。固醇调节元件结合蛋白(SREBP-1)是重要的核转录因子,其能与基因的启动子/增强子的固醇调节元件结合,激活靶基因转录,介导胆固醇合成,在脂肪细胞形成、分化及脂肪酸合成过程中发挥重要的调节作用[37]。许会芬等[38]研究表明,SREBP-1 能够促进脂肪酸合成相关基因的表达,对山羊乳腺脂肪酸代谢具有调控作用。何侃等[39]研究发现与 SREBP-1c 存在正相关的ACAA1基因涉及的显著性通路包括 PPAR 信号通路、脂肪酸代谢通路、多不饱和脂肪酸生物合成、胆汁酸生物合成。推测,SREBP-1c 可能协同ACAA1基因及其通路参与调控脂肪代谢过程。对SREBP-1基因及其协同的ACAA1基因进一步研究将有助于更好地了解脂代谢机理,指导动物的遗传育种和饲养管理,同时提高对人类脂质代谢性疾病(如肥胖、脂肪肝、高脂血症等)的认识并指导临床治疗。
4 总结及展望
随着分子生物学的发展,许多研究发现脂代谢与各类代谢疾病的发生、发展及肉类品质等密切相关。近年来,关于ACAA1基因的研究多集中在人类代谢疾病、肿瘤、癌症等方面,而在其他物种及畜牧领域鲜见报道。深入研究ACAA1基因的功能及其分子机制,将进一步拓展对该基因在其他领域的了解,为治疗相关疾病、明确该基因在与肉质相关的脂代谢过程中的作用及肉质性状选育提供更多思路及参考,尤其是在肉羊肉用性状和经济性状的选育方面,可从分子生物学角度提供技术支持,对推动我国肉羊选育具有重要意义。

