2型糖尿病患者血清Apelin、AngⅡ与颈动脉内膜中层厚度的相关性
张亚迪 孙卫华 吴晨辰 薛丽 张晓梅
蚌埠医学院第一附属医院内分泌科 233000
糖尿病是由多病因引起的以慢性高血糖为特征的代谢性疾病。糖尿病大血管病变主要是指中等以上动脉发生的动脉粥样硬化(AS),是糖尿病患者致残、致死的主要原因,其发病机制尚未明确。AS不仅是简单脂质积累的过程,内皮功能障碍以及炎性反应等因素也与其发生、发展密切相关[1-2]。
Apelin是一种新型的脂肪因子,广泛分布于体内[3]。其在糖尿病微血管病变中通过增强肾小球内皮细胞的增殖、迁移和趋化作用,从而促进血管生成,增加肾小球内皮细胞的通透性,促进白蛋白尿的发生[4]。在糖尿病视网膜病变中,Apelin能促进视网膜内皮细胞增殖、迁移及非血管性血管重建,加重视网膜病变[5]。因此,Apelin可能会通过影响内皮细胞功能参与糖尿病AS的发生、发展。颈动脉内膜中层厚度(CIMT)作为早期AS标志,是大血管病变的常用指标。本研究分析了血清Apelin、血管紧张素(Ang)Ⅱ水平与CIMT的相关性及可能的影响因素,以期为2型糖尿病(T2DM)大血管病变的防治提供理论依据。
1 对象与方法
1.1 研究对象 选取2018年1月—2018年6月于蚌埠医学院第一附属医院住院的T2DM患者共103例,所有入选者均符合 1999 年 WHO 的T2DM分型诊断标准[6]。根据CIMT分组, CIMT<0.9 mm为NCITM组,共48例,男23例,女25例,平均年龄(49.61±14.07)岁;CIMT≥0.9 mm为ACIMT组,共55例,男25例,女30例,平均年龄(53.87±12.31)岁。另外,选取蚌埠医学院第一附属医院同期健康体检者49名为健康对照组(NC组),其中男23名,女26名,平均年龄(44.36±13.78)岁,NC组均行颈动脉彩色超声排除颈动脉内膜病变。排除标准:合并糖尿病急性并发症者;恶性肿瘤患者;半年内有手术创伤史者;严重的感染者;肝、肾功能异常者;吸烟、饮酒史者。
1.2 研究方法
1.2.1 一般资料 所有入选对象均登记性别、年龄,T2DM患者询问病程;测量身高、体重、腰围、臀围,计算体重指数、腰臀比;测量血压时,应至少测量2次,间隔1~2 min,若差别≤5 mmHg(1 mmHg=0.133 kPa),则取2次测量的平均值;若差别>5 mmHg,应再次测量,取3次测量的平均值。
1.2.2 生化指标检测 所有入选对象禁食10~12 h,次日清晨采肘静脉血,分别测定空腹血糖、甘油三酯、总胆固醇、低密度脂蛋白-胆固醇(LDL-C)、高密度脂蛋白-胆固醇(HDL-C)、HbA1c等。
1.2.3 血清Apelin、Ang Ⅱ浓度测定 使用EDTA抗凝管抽取3 ml静脉血,立即以1 000 r/min(r=10 cm)离心20 min,将分离的血清置于-80℃保存,待测定时将所有标本置于37℃恒温水槽中复融,使用武汉伊莱瑞特生物科技有限公司Apelin、Ang Ⅱ试剂盒,采用ELISA法检测。
1.2.4 CIMT测量 均由同一名医师操作,使用美国PHILPS-IU22彩色超声诊断仪进行动脉检测,探头频率10 MHz。分别检测颈总动脉、分叉部、颈内动脉3个部位动脉内膜厚度。
CIMT定义为腔内膜交界面至外膜上层之间的距离,以后壁值为标准,共测量6个点,取平均值为CIMT值。据《中国高血压防治指南》(2010年版),以CIMT>0.9 mm为内膜增厚标准[7]。
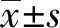
2 结果
2.1 各组一般资料与生化指标比较 各组性别、年龄、体重、甘油三酯、HDL-C差异均无统计学意义(P均>0.05)。与 NC组相比,NCIMT组和ACIMT组 体重指数、腰围、臀围、腰臀比、舒张压、总胆固醇、LDL-C、空腹血糖、HbA1c升高(P均<0.05);与NCIMT组相比,ACIMT组尿素、肌酐、尿酸、HbA1c、总胆固醇、LDL-C、收缩压升高(P均<0.05),见表1。
2.2 血清Apelin、Ang Ⅱ水平比较 与NC组相比,NCIMT组血清Apelin水平升高(P<0.01);与ACIMT组相比,NCIMT组Apelin水平降低(P<0.01)。与NC组相比,血清Ang Ⅱ水平在 NCIMT组及ACIMT组递增(P<0.01),见表1。
2.3 Apelin、Ang Ⅱ与其他指标的相关分析 将性别、年龄纳入控制变量,各组 Apelin、Ang Ⅱ水平分别与各临床生化指标进行偏相关分析,结果显示,血清Apelin水平与腰围、腰臀比、空腹血糖、总胆固醇、HbA1c呈正相关(表2)。血清Ang Ⅱ水平与收缩压、总胆固醇、HbA1c呈正相关(表3)。
2.4Logistic二元回归分析CIMT的影响因素 以CIMT为因变量,以各项指标为自变量,行logistic二元回归分析,结果显示,Apelin是CIMT增厚的保护因素(P<0.05),年龄、HbA1c、Ang Ⅱ是CIMT增厚的危险因素(表4)。

表1 各组一般资料及生化指标比较
注:BMI:体重指数;LDL-C:低密度脂蛋白-胆固醇;HDL-C:高密度脂蛋白-胆固醇; AngⅡ:血管紧张素Ⅱ;NC组:健康对照组;NCIMT组:颈动脉内膜未增厚组;ACIMT组:颈动脉内膜增厚组;1 mmHg=0.133 kPa;与NC组相比,aP<0.05,bP<0.01;与NCIMT组相比,cP<0.05

表2 血清Apelin与各项临床指标的相关性分析
注:BMI:体重指数;LDL-C:低密度脂蛋白-胆固醇; 1 mmHg=0.133 kPa

表3 血清Ang Ⅱ与各项临床指标的相关性分析
注:BMI:体重指数;LDL-C:低密度脂蛋白-胆固醇;AngⅡ:血管紧张素Ⅱ;1 mmHg=0.133 kPa

表4 CIMT影响因素的logistic二元回归分析
注:CIMT:颈动脉内膜中层厚度;AngⅡ:血管紧张素Ⅱ
3 讨论
AS是糖尿病大血管病变的主要病理特征,而CIMT是AS的标志,是评估糖尿病患者是否合并大血管病变的主要指标[8]。Apelin是从牛的胃中提取的生物活性肽,主要参与机体的血压调节、血管形成、高血糖以及神经系统等多种生理过程[9]。APJ系统是Apelin的受体,是一种具有7个跨膜结构域的G蛋白耦联受体,其与AngⅡ的1型受体(AT1)具有31%的同源性[10]。肾素-血管紧张素-醛固酮系统(RAAS)主要作用于肾脏、心血管等器官,在人体水电解质的平衡、调节心血管功能及靶器官损伤中有重要作用[11]。Ang Ⅱ在RAAS中是生物活性最强的分子,其发挥作用需要与受体结合,具有强烈的收缩血管功能[12]。
本研究显示,与NC组相比,T2DM患者血清Apelin水平升高。与现有研究结果一致,该研究表明T2DM患者血清Apelin浓度高于正常对照组,且与HbA1c呈负相关;Apelin可能在T2DM患者AS中发挥作用,但作用机制尚不明确[13]。糖尿病初期患者血清Apelin的表达代偿性增加,Apelin具有抗炎、抑制免疫反应的作用[14]。一方面,肿瘤坏死因子(TNF)-α作为炎性因子,可以直接损伤血管内皮细胞,使血管通透性增加,诱发血栓形成,从而引起AS[15]。Apelin能够通过抑制炎性因子如TNF-α和白细胞介素1β的表达,有效抑制AS斑块的形成[16]。另一方面,内膜泡沫细胞的形成是早期AS的特征性病理改变,研究表明,Apelin-13可以通过促进细胞内胆固醇外流,减少泡沫细胞的形成,从而减少AS的发生[17]。
本研究结果还显示,Ang Ⅱ可能参与T2DM患者AS的发生、发展。与NC组相比,NCIMT组及ACIMT组Ang Ⅱ表达均升高,主要原因可能是Ang Ⅱ能诱导内皮表达的NADPH氧化酶与腺苷A2A受体结合,通过激活细胞外信号调节激酶1/2信号通路、 p38丝裂原活化蛋白激酶信号通路和丝氨酸/苏氨酸激酶信号通路的磷酸化,造成大量活性氧簇在内皮细胞堆积,产生氧化应激反应,损伤内皮细胞[18]。
本研究中,与NCIMT组相比,ACIMT组Apelin表达反而下降,可能是随着T2DM患者病程的发展,Apelin的表达从过度代偿到失代偿导致。也有研究提出Apelin-血管紧张素转换酶2-Ang(1-7)轴,认为Apelin可以通过抑制载脂蛋白E基因敲除小鼠体内的AngⅡ/AT1活性,延缓AS的发生[19]。在糖尿病发展的后期失代偿,Apelin表达下降,从而抑制AngⅡ/AT1活性的作用减弱,故促进了AS的发展。关于Apelin在T2DM患者AS中的具体分子机制仍需进一步研究。
本研究中相关分析结果显示,血清Apelin浓度与腰围、腰臀比、总胆固醇、空腹血糖、HbA1c呈正相关。血清Ang Ⅱ浓度与收缩压、总胆固醇、HbA1c呈正相关。Logistic回归分析显示,年龄、HbA1c、AngⅡ是CIMT增厚的危险因素,血清Apelin是CIMT增厚的保护因素。
综上所述,Apelin能够抑制T2DM患者CIMT增厚,是一种保护因素;AngⅡ能够促进T2DM患者CIMT增厚,是一种危险因素,与Apelin之间可能具有拮抗作用,共同参与T2DM患者AS的发生、发展。此外,T2DM患者血清Apelin水平降低可能是糖尿病发生大血管病变的一个预测因子。

