异叶败酱化学成分及其生物活性
王雅婧, 穆丽华, 刘 屏*
(1.山西中医药大学,山西 晋中030619;2.中国人民解放军总医院药理药学研究室,北京100853)
异叶败酱Patrinia heterophylla Bunge 是败酱科败酱属多年生草本植物,其根茎或根与糙叶败酱的根茎或根混用,药材名墓头回[1]。文献报道墓头回对各类急慢性白血病细胞有抑制作用,并且临床上用于治疗白血病[2-3]。异叶败酱作为墓头回的药源植物,对其化学成分报道较少,为进一步明确异叶败酱中的药效物质基础,本实验对异叶败酱进行化学成分研究,并对其单体化合物进行抗肿瘤活性筛选。从中分离得到7 个化合物,化合物2 ~6 均为首次从该属植物中分离得到,化合物1 为首次从该植物中分离得到,化合物1 ~6 对白血病细胞有一定的抑制作用。
1 仪器与材料
高效 液 相 色 谱 仪 (日 本 Hitachi 公 司);2000ES 蒸发光散射检测器(美国Altech 公司);R1-102 示差检测器(日本Shodex 公司);NP7000半制备液相泵(汉邦公司);R200 旋转蒸发仪、中压反相色谱柱(瑞士Buchi 公司);Bruker AV-ⅢHD 600 超导核磁共振仪(瑞士Bruker 公司);Q-TOF 高分辨质谱仪(美国Sciex 公司);YT-CJ-1ND 超净工作台(北京亚泰科隆技术有限公司);MCO-15ACCO2 恒温培养箱 (日本Sanyo 公司);DT5-2 离心机(北京时代北利离心机有限公司);1420-012 酶标仪 (美国Perkin Elmer 公司); ECLIPSE TS100 显微镜(日本Nikon 公司);D-101大孔树脂(天津南开和成科技有限公司);薄层层析硅胶GF254、柱层析硅胶100 ~200 目(青岛海洋化工厂)。分析纯石油醚、氯仿、丙酮、乙酸乙酯、正丁醇和甲醇等试剂(国药集团化学试剂有限公司);色谱纯甲醇、乙腈(国药集团化学试剂有限公司);娃哈哈纯净水(杭州娃哈哈公司)。RPMI 1640 培养基(美国Gibco 公司);胎牛血清(美国HyClone 公司);二甲基亚砜(美国Amresco公司);CCK-8 试剂盒(Biosharp 生物科技公司)。
异叶败酱于2014 年采于河南省,经中国人民解放军总医院刘萍研究员鉴定为正品。
人早幼粒白血病细胞(HL-60)、人慢性粒细胞白血病细胞(K562) 均购于中国医学科学院肿瘤医院细胞中心。
2 提取与分离
干燥的异叶败酱全草(2 kg) 粉碎,75%乙醇回流提取3 次,过滤后减压浓缩得异叶败酱总浸膏。总浸膏加水成悬浮液,依次用石油醚、氯仿、乙酸乙酯、正丁醇各萃取3 次,取有机相层,用旋转蒸发仪减压浓缩,回收溶剂,分别得石油醚、氯仿、乙酸乙酯、正丁醇部位63、112、36、95 g。取正丁醇部分用大孔树脂色谱进行分离,依次用30%、60%、95%乙醇进行梯度洗脱,减压浓缩后得到30%、60%、95%部分浸膏。
将30%部分浸膏(50 g) 经硅胶柱(100 ~200目) 分离,以氯仿-甲醇-水(25 ∶1 ∶0、9 ∶1 ∶0、9 ∶1 ∶0.1、8 ∶2 ∶0.2、7 ∶3 ∶0.5) 梯度洗脱,共得到263 个馏分A1-263,通过薄层色谱检测,合并相同馏分。馏分A180-190合并后经硅胶柱,以氯仿-甲醇-水(9 ∶1 ∶0.1、8 ∶2 ∶0.2) 梯度洗脱,再经半制备HPLC (乙腈-水2 ∶8) 得化合物1(21.5 mg)。馏分A120-159合并后经中压反相柱以乙腈-水(1 ∶9、3 ∶17、1 ∶4、1 ∶3、3 ∶7) 梯度洗脱,得化合物2(12.1 mg)。
将60%部分的浸膏经硅胶柱色谱(100 ~200目) 分离,经氯仿-甲醇-水(9 ∶1 ∶0.1、8 ∶2 ∶0.2、7 ∶3 ∶0.5) 梯度洗脱,共得到245 个馏分B1-245,通过薄层色谱检测,合并相同馏分。馏分B93-100合并后经中压反相柱以甲醇-水 (5 ∶95 ~55 ∶45) 梯度洗脱得化合物3 (11 mg)。 馏分B60-70号合并后经中压反相柱以乙腈-水(3 ∶97 ~48 ∶52) 梯度洗脱,F23 重结晶得化合物4(16.4 mg),F26 重结晶得化合物5 (9.1 mg)。 馏分B77-91号合并后经中压反相柱以甲醇-水(5 ∶95 ~80 ∶20) 梯度洗脱,F30 重结晶得化合物6(8.8 mg),F40 重结晶得化合物7(10.6 mg)。
3 结构鉴定
化合物1:白色粉末(甲醇)。ESI-MS m/z:485[M +Na]+。1H-NMR(600 MHz,CD3OD) δ:1.78(1H,m,H-13),2.03(2H,m,H-6),2.13(1H,m,H-9),2.19(2H,dd,J =7.2 Hz,H-12),2.95(1H,q,J =7.8 Hz,H-8),3.15(1H,t,J =8.4 Hz,H-7),3.24(2H,m,H-10),4.04(1H,d,J =11.4 Hz,H-1),4.22(1H,m,H-11);13CNMR(150 MHz,CD3OD)δ:93.5(C-1),140.0(C-3),116.4(C-4),34.1(C-5),40.9(C-6),73.3(C-7),49.0(C-8),42.7(C-9),62.2(C-10),69.6(C-11),103.4(C-1′),75.1(C-2′),78.1(C-3′),71.7(C-4′),77.9(C-5′),62.8(C-6′),173.3(C-1″),44.1(C-2″),26.8(3″),22.6(4″)。以上数据与文献 [4] 一致, 故鉴定为patrinoside。
化合物2:黄色粉末(甲醇)。ESI-MS m/z:677[M +Na]+。1H-NMR(600 MHz,CD3OD) δ:2.10(1H,d,J =16.8 Hz,H-2),2.47(1H,d,J =16.8 Hz,H-2),5.81(1H,quin,H-4),4.36(1H,m,H-9),1.21(3H,d,J =6.6 Hz,H-10),0.90(3H,s,H-11),0.91(3H,s,H-12),1.86(3H,d,J =1.2 Hz,H-13),4.28(3H,d,J =7.8 Hz,Glu-1′);13C-NMR(150 MHz,CD3OD)δ:42.4(C-1),50.6 (C-2),201.1 (C-3),127.1 (C-4),167.2(C-5),79.9(C-6),131.5(C-7),135.2(C-8),77.2(C-9),21.1(C-10),23.4(C-11),24.6(C-12),19.5(C-13),102.7(C-1′),75.2(C-2′),78.1(C-3′),71.6(C-4′),77.9(C-5′),62.8(C-6′)。以上数据与文献[5] 一致,故鉴定为roseoside Ⅱ。
化合物3:白色粉末(甲醇)。ESI-MS m/z:951[M +Na]+。1H-NMR(600 MHz,CD3OD) δ:3.06(1H,dd,J =4.8 Hz,H-3),5.20(1H,brs,H-12),4.21(1H,d,J =8.4 Hz,H-Ara-1),4.29(1H,d,J =8.4 Hz,H-Glu-1′),5.30(1H,d,J =7.8 Hz,H-Glu-1);13C-NMR(150 MHz,CD3OD)δ:39.8(C-1),27.0(C-2),90.7(C-3),40.1(C-4),57.0(C-5),19.3(C-6),33.9(C-7),40.7(C-8),49.0(C-9),37.9(C-10),24.5(C-11),123.8(C-12),144.8(C-13),42.8(C-14),28.9(C-15),24.0(C-16),49.0(C-17),41.8(C-18),41.4(C-19),36.7(C-20),29.2(C-21),32.4(C-22),28.5(C-23),16.9(C-24),16.1(C-25),17.8(C-26),26.3(C-27),178.0(C-28),74.3(C-29),107.1(C-Ara-1),78.1(C-Ara-2),72.8(C-Ara-3),69.5(C-Ara-4),66.3(CAra-5),95.7(C-Glu-1),73.8(C-Glu-2),78.0(C-Glu-3), 70.9 (C-Glu-4), 78.0 (C-Glu-5),69.5(C-Glu-6),104.6(C-Glu-1′),75.4(C-Glu-2′),78.0(C-Glu-3′),71.5(C-Glu-4′),77.8(CGlu-5′),62.7(C-Glu-6′)。以上数据与文献[6]一致,故鉴定为(3-O-α-L-arabinopyranosyl hederagenin 28-O-β-D-glucopyranosyl-(1 →6) -β-D-glucopyranoside。
化合物4:黄色晶体(DMSO)。ESI-MS m/z:455[M +Na]+。1H-NMR(600 MHz,CD3OD) δ:7.95(2H,d,J =8.4 Hz,H-2′,6′),6.93(2H,d,J =8.4 Hz,H-3′,5′),6.82(1H,s,H-3),5.06(1H,d,J =7.8 Hz,H-Glu-1),3.76(1H,s,H-Glu-6);13C-NMR(150 MHz,CD3OD)δ:182.0(C-4),164.2(C-7),162.9(C-2),161.4(C-4′),161.1(C-9),156.9(C-5),128.6(C-2′,C-6′),121.0(C-1′),116.0 (C-3′, C-5′),105.3 (C-10),103.1(C-3),99.9(C-Glu-1),99.5(C-6),94.8(C-8),77.2(C-Glu-3),76.4(C-Glu-5),73.1(C-Glu-2),69.5(C-Glu-4),60.6(C-Glu-6)。以上数据与文献[7] 一致,故鉴定为apigenin4′-O-β-D-glucopyranoside。
化合物5:白色针晶(DMSO)。ESI-MS m/z:483[M +Na]+。1H-NMR(600 MHz,CD3OD) δ:5.00(1H,m,H-10),4.78(1H,s,H-10),4.58(1H,s,H-1″),4.35(1H,d,J =7.8 Hz,H-3),4.23(1H,d,J =7.8 Hz,H-1′),2.42(1H,t,J =5.4 Hz,H-1),2.28(1H,m,H-7),1.63(1H,d,J =9.6 Hz,H-7),2.12(1H,m,H-4),1.95(1H,overlap,H-4),1.23(3H,s,H-8),0.61(3H,s,H-9);13C-NMR(150 MHz,CD3OD)δ:150.8(C-2),113.4(C-10),101.1(C-1′),100.9(C-1″),76.6(C-3′),75.2(C-5′),73.3(C-2′),71.8(C-3),70.7(C-4′),70.5(C-3″),70.3(2″),68.3(C-5″),67.2(C-6′),50.0(C-1),40.3(C-6),39.9(C-5),31.9(C-4),26.8(C-7),25.8(C-8),21.9(C-9),17.9(C-6″)。以上数据与文献[8] 一致,故鉴定为fissoside B。
化合物6:黄色晶体(DMSO)。ESI-MS m/z:577[M +Na]+。1H-NMR(600 MHz,CD3OD) δ:1.07(3H,d,J =6.0 Hz,H-6‴),4.54(1H,d,J =6.0 Hz,H-1‴),5.06(1H,d,J =7.2 Hz,H-1″),6.44(1H,s,H-6),6.76(1H,s,H-8),6.85(1H,s,H-3),6.95(2H,d,J =8.4 Hz,H-3′,H-5′),7.95(2H,d,J =8.4 Hz,H-2′,H-6′),10.37(1H,s,4′-OH),12.95(1H,s,5′-OH);13C-NMR(150 MHz,CD3OD)δ:17.8(C-6‴),66.0(C-6″),68.3(C-5‴),69.5(C-2‴),70.3(C-3‴),70.7(C-4″),72.0(C-2″),73.1(C-4‴),75.6(C-3″),76.3(C-5″),94.8(C-8),99.5(C-6),99.9(C-1‴),100.5(C-1″),103.1(C-3),105.4(C-10),116.1(C-3′),121.0(C-1′),128.6(C-2′,C-6′),156.9(C-9),161.2(C-4′),161.3(C-7),162.9(C-5),164.4(C-2),182.0(C-4)。以上数据与文献 [9] 一 致, 故 鉴 定 为 芹 菜 素-7-O-β-D-芦 丁糖苷。
化合物7:黄色晶体(甲醇)。ESI-MS m/z:807[M +Na]+。1H-NMR(600 MHz,CD3OD) δ:3.83(3H,s,H-7),5.01(1H,d,J =7.8 Hz,H-1″),6.29(1H,d,J =7.2 Hz,H-6),6.55(1H,s,H-8),6.83(2H,d,J =9.0 Hz,H-3′,H-5′),8.07(2H,d,J =8.4 Hz,H-2′,H-6′);13C-NMR(150 MHz,CD3OD) δ:179.7 (C-4),167.4 (C-7),162.7(C-5),161.8(C-4′),159.7(C-9),158.5(C-2),135.9(C-3),132.6(C-2′,C-6′),122.5(C-1′),116.2(C-3′),106.5(C-10),105.5(C-1″),104.0(C-1″″),101.9(C-1‴),99.2(C-6),93.3(C-8),79.6(C-4‴),75.4(C-5″),75.0(C-3″),74.0(C-4″″),73.2(C-3″″),73.0(C-2″″),72.2(C-2″),72.1(C-3‴),71.9(C-2‴),70.2(C-5″″),70.0(C-5‴,C-4″),67.6(C-6″),56.6(C-OMe),18.0(C-6″″),18.0(C-6‴)。以上数据与文献 [10] 一致, 故鉴定为rhamnocitrin 3-O-[ α-L-rhamnopyranosyl ( l → 4 ) -O-α-Lrhamnopyranosyl(1→6) ] -β-D-galactopyranoside。
4 活性测试
4.1 细胞培养 将细胞从液氮罐中取出,常规方法[11-12]复苏,将细胞用含15%胎牛血清的RPMI 1640 培养液,在37 ℃,5%CO2饱和湿度条件下培养。根据不同细胞的生长速度1 ~2 d 更换新鲜的培养液或者传代。
4.2 CCK-8 检测 将处于对数生长期的HL-60、K562 细胞制成密度9×104/mL、8×104/mL 的细胞悬液接种于96 孔板中,每孔100 μL,每组设置5个平行孔。在培养箱中培养24 h 后分别加入不同质量浓度的化合物1 ~6(从低到高依次为0、20、40、60、80、 100 μg/mL) 及 阳 性 对 照 品 顺 铂50 μL。给药后继续在培养箱中培养48 h,取出培养板,每孔加入10 μL CCK-8 溶液。1~2 h(K562 1.5 h,HL-60 2 h) 后在450 nm 处测OD 值。并计算细胞抑制率及IC50值。
4.3 对白血病细胞增殖抑制活性测定 各化合物的IC50值见表1。据相关文献报道[13],单体化合物的IC50<100 μg/mL,表明实验样品具有明显的细胞毒活性。结果显示,化合物1~3、5 ~6 对HL-60细胞具有一定的毒性抑制作用,化合物2 ~6 对K562 细胞具有一定的毒性抑制作用。
5 讨论
异叶败酱是墓头回最早的药源植物[14],是历代本草中以墓头回使用的主流,但是关于异叶败酱的化学成分报道却很少,目前国内外有12 个三萜类、5 个环烯醚萜酯、3 个木脂素、2 个甾体类、3个黄酮类、1 个多糖和1 个香豆素类化合物的报道。异叶败酱总皂苷和粗制剂可用于治疗急慢性白血病、子宫癌、宫颈癌和大肠癌[15],但是其发挥药效的确切化合物尚未确定。本研究从异叶败酱中分离得到7 个化合物,其中化合物1 为环烯醚萜类、化合物2 为单环降倍半萜苷类、化合物3 为三萜皂苷类、化合物5 为单萜类龙脑苷、化合物4、6~7 为黄酮类。通过CCK-8 法筛选了化合物1 ~6对HL-60 和K562 细胞的增殖抑制作用。结果显示,各单体化合物对白血病细胞具有一定的毒性抑制作用,且化合物1 ~3、5 ~6 对HL-60 细胞、化合物2~6 对K562 细胞的抑制作用与药物质量浓度有一定的依赖关系,以期为今后进一步研究异叶败酱的抗白血病作用提供参考。虽然单体化合物对白血病细胞表现出了体外毒性,但中药成分复杂,异叶败酱化学成分抗白血病作用的确切机制还需进一步研究。
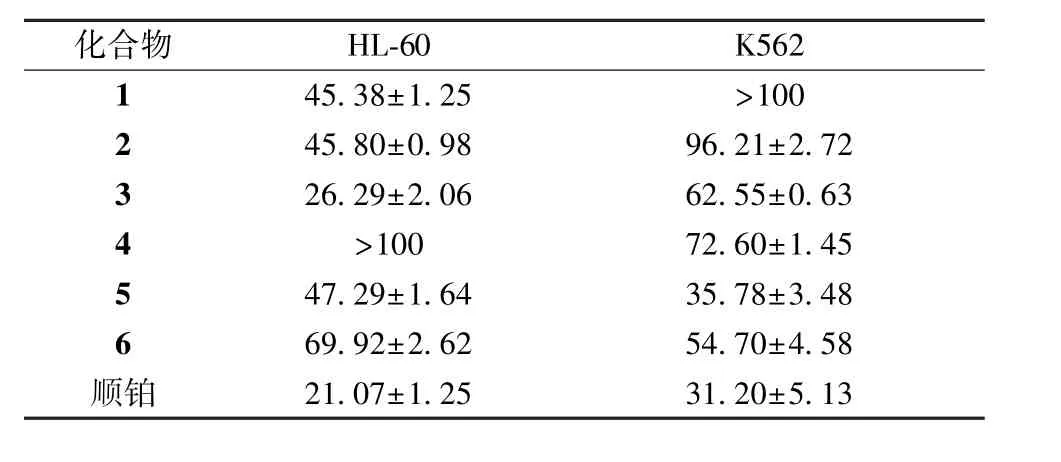
表1 各化合物抗白血病细胞IC50值(μg/mL)Tab.1 IC50 values of various compounds on leukemia cells(μg/mL)

