黄连与肉桂不同配伍干预奥氮平致糖脂代谢紊乱的药效分析
江西省九江市第五人民医院精神科,江西 九江 332000
奥氮平等第二代抗精神病药可有效改善精神分裂症。长期应用易引起糖脂代谢紊乱,增加心脑血管并发症和早逝的风险[1],已成为临床医疗关注的热点。针对奥氮平等第二代抗精神病药物致糖脂代谢紊乱的日常生活方式干预、行为治疗等非药物方式干预远远不够,目前主要药物干预手段是二甲双胍、他汀类等降糖降脂类药。二甲双胍疗效并不特别突出,不良反应报道不详细[2]。他汀类药物是细胞色素P450(CYP)酶系中某些亚型酶的抑制剂[3],可抑制奥氮平等抗精神病药物的代谢。Neuvonen等研究[4]报道,他汀类药物因药物相互作用导致肌毒性甚至横纹肌溶解等严重药源性疾病风险的增加,妨碍了他汀类药物的应用。中药黄连可治疗糖尿病等代谢性疾病,其主要效应成分是黄连素[5-6],单独口服黄连素吸收差、生物利用度低。黄连与肉桂配伍可促进黄连素经大鼠小肠黏膜吸收和转运[7],作用机制尚不清楚。前期研究表明黄连与肉桂(1∶0.5)配伍改善糖脂代谢紊乱的效果显著优于二甲双胍[8],本研究试图探讨黄连与肉桂不同配伍干预奥氮平致糖脂代谢紊乱的药效,为探寻其更有效防治手段提供依据。现报告如下。
1 资料与方法
1.1 一般资料 选取2017年12月至2018年11月住院单一服奥氮平的精神分裂症患者105例。将患者随机分配到黄连与肉桂(1∶0.5)配伍组(A组)、黄连与肉桂(1∶0.1)配伍组(B组)、安慰剂组(C组)。A组因病情调整奥氮平剂量而脱落1例、病情好转出院失访1例,33例患者中男22例、女11例,年龄(27.97±7.31)岁,精神分裂症病程(6.67±2.25)月,奥氮平日用量(12.58±3.34)mg/d;B组因病情调整奥氮平剂量而脱落1例、病情好转出院失访2例,32例患者中男21例、女11例,年龄(26.09±5.96)岁,精神分裂症病程(7.00±1.90)月,奥氮平日用量(13.59±3.17)mg/d;C组因病情调整奥氮平剂量而脱落2例、病情好转出院失访3例,30例患者中男20例、女10例,年龄(26.00±6.41)岁,精神分裂症病程(6.37±2.13)月,奥氮平日用量(12.67±2.86)mg/d。3组性别(x2=0.010,P=0.995)、年龄(F=0.915,P=0.404)、病程(F=0.708,P=0.495)、奥氮平日用量(F=1.032,P=0.360)比较差异均无统计学意义(P>0.05)。九江市第五人民医院医学伦理委员会审查批准本研究(九五医伦字[2017]6号)。
1.2 纳入标准 精神分裂症诊断采用《国际疾病分类(第10版)》(International Classification of Diseases,tenth edition,ICD-10)标准;年龄在18~45岁;单服奥氮平致体质量增加≥10%;病情稳定至少1个月;禁止从事剧烈运动,统一进食标准。受试者均被要求签署知情同意书。
1.3 排除标准 高血压、糖尿病、内分泌疾病等重大躯体疾病;妊娠或哺乳期妇女;药物、酒依赖;正在接受抗炎、免疫抑制剂治疗;结核病、艾滋病等慢性感染。
1.4 治疗方法 3组奥氮平(江苏豪森药业集团有限公司,批号170107),保持原日用量不变。A组给予黄连与肉桂颗粒(华润三九医药有限公司提供,每袋0.5 g黄连颗粒相当于黄连生药3 g,批号:1708001W;每袋1 g肉桂颗粒相当于肉桂生药3 g,批号:1709001W)(1∶0.5)配伍治疗,用法:每次黄连6 g与肉桂3 g,早、晚饭后各冲服1次。B组给予黄连与肉桂颗粒(1∶0.1)配伍治疗,用法:每次黄连6 g与肉桂0.6 g,早、晚饭后各冲服1次。C组给予安慰剂(黄连、肉桂模拟颗粒组成)治疗,用法:早、晚饭后各冲服1次。3组疗程均为12 w。
1.5 观察指标
1.5.1 血样采集及检测 禁食12 h,清晨7时空腹抽取肘静脉血5 mL,2 mL用于血糖血脂检测(7180日立全自动生化分析仪,日本),3 mL离心后的血清置于-80 ℃冰箱保存,取冰冻血清复溶进行化学发光分析(安图LUMO化学发光分析仪,河南郑州)测定胰岛素,采用酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)测定血清IL-1β、IL-6、TNF-α水平。稳态模型评估胰岛素抵抗指数(homeostasis model assessment-insulin resistance index,HOMA-IRI)=FINS×FBG/22.5。
1.5.2 安全性评估 治疗前后检查全套血生化、血常规、心电图及生命体征。
1.5.3 精神症状评定 阳性和阴性症状量表(the positive and negative syndrome scale,PANSS):包括阳性症状分量表7个症状条目、阴性症状分量表7个症状条目、一般精神病理症状分量表16个症状条目,共30项内容。严重度评分标准:采用1~7分的7级评分法;不良反应量表(treatment emergent symptoms scale,TESS):采用0~4分的5级评分法评定。使用PANSS、TESS前进行一致性培训,严格按照统一的指导语进行,考核合格的评定者对患者进行问卷调查,组内相关系数( ICC)≥0.95。

2 结果
2.1 3组血清IL-1β、IL-6、TNF-α水平变化比较 治疗前3组血清IL-1β、IL-6、TNF-α水平差异无统计学意义(F=0.332~0.664,P=0.726~0.517);治疗第12周末,A、B组血清IL-1β、IL-6、TNF-α水平较治疗前均显著性降低(F=41.178~458.927),且显著性低于C组(P均=0.000);A组血清IL-1β、IL-6、TNF-α水平显著性低于B组(P=0.014~0.000)。见表1。
2.2 3组血清TG、TC、HDL-C、LDL-C 水平变化比较 治疗前3组血清TG、TC、HDL-C、LDL-C水平差异均无统计学意义(F=0.036~0.286,P=0.964~0.752);治疗第12周末,A、B组血清TG、TC、LDL-C水平较治疗前显著性降低(F=34.791~173.331,P均=0.000),且显著性低于C组(P均=0.000);A组血清TG显著性低于B组(P=0.008)。见表2。

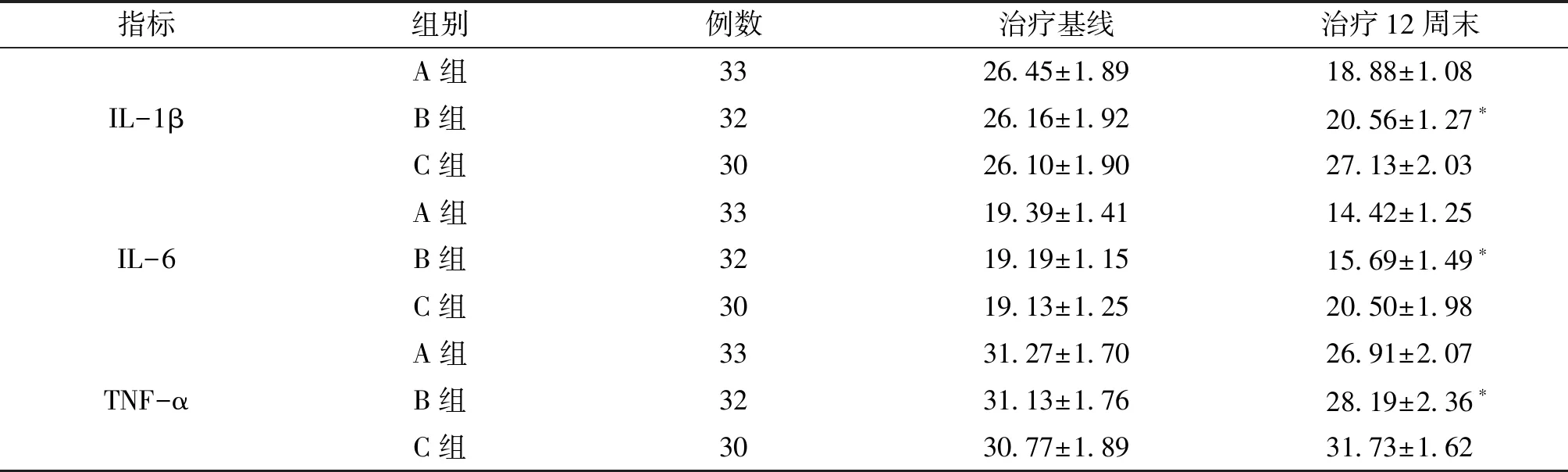
指标组别例数治疗基线 治疗12周末IL-1βA组3326.45±1.8918.88±1.08B组3226.16±1.9220.56±1.27∗C组3026.10±1.9027.13±2.03IL-6A组3319.39±1.4114.42±1.25B组3219.19±1.1515.69±1.49∗ C组3019.13±1.2520.50±1.98 TNF-αA组3331.27±1.7026.91±2.07 B组3231.13±1.7628.19±2.36∗ C组3030.77±1.8931.73±1.62
注:与A组、C组比较,*P<0.05。
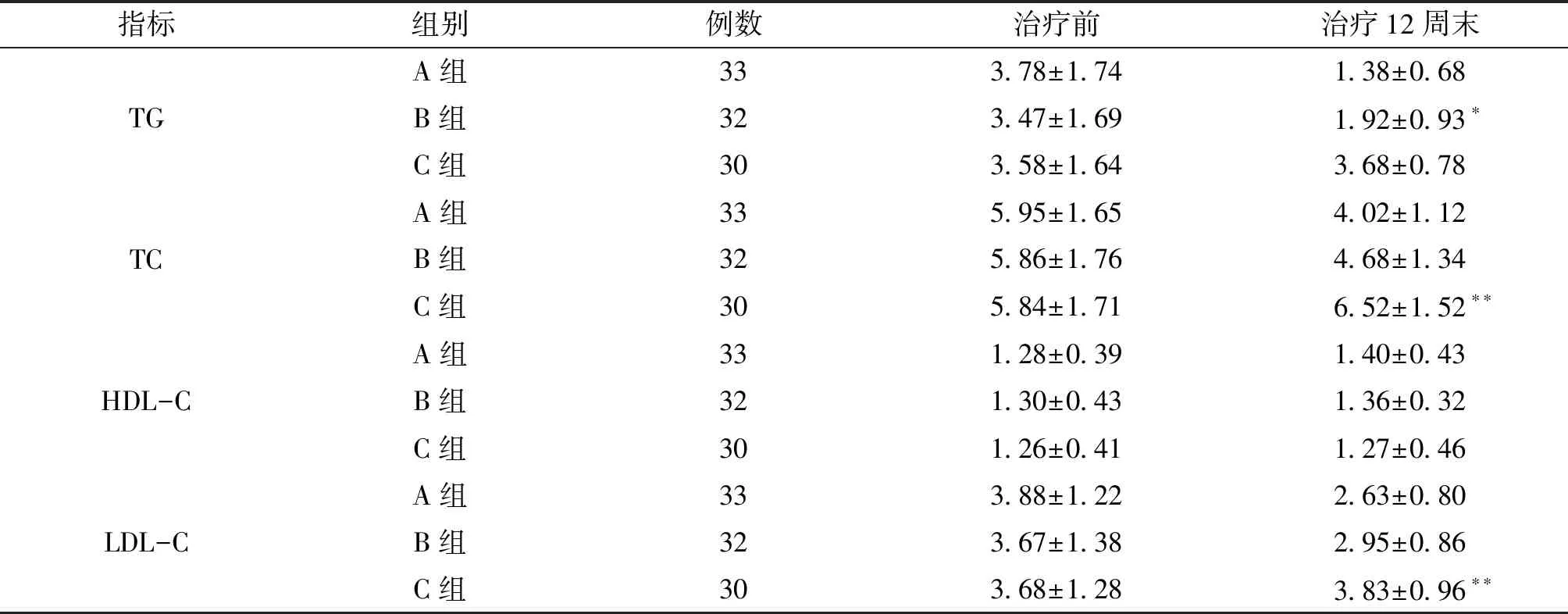
指标组别 例数治疗前 治疗12周末TGA组333.78±1.741.38±0.68B组323.47±1.691.92±0.93∗C组303.58±1.643.68±0.78TCA组335.95±1.654.02±1.12B组325.86±1.764.68±1.34 C组305.84±1.716.52±1.52∗∗HDL-CA组331.28±0.391.40±0.43B组321.30±0.431.36±0.32C组301.26±0.411.27±0.46LDL-CA组333.88±1.222.63±0.80B组323.67±1.382.95±0.86C组303.68±1.283.83±0.96∗∗
注:与A组、C组比较,*P<0.05;与A组、B组比较,**P<0.05。
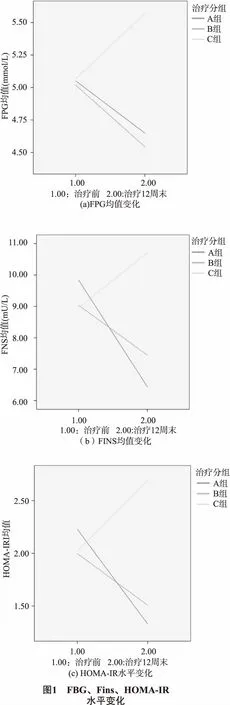
2.3 3组FBG、Fins、HOMA-IR水平变化 治疗前3组FBG、Fins、HOMA-IRI水平差异均无统计学意义(F=0.084~0.445,P=0.919~0.642);治疗第12周末,A、B组FBG、Fins和HOMA-IRI水平较治疗前均显著性降低(F=18.757~63.773,P均=0.000),A、B组间差异均无统计学意义(P=0.455~0.052),A、B组均显著性低于C组(P=0.001~0.000)。如图1。
2.4 3组阳性症状、阴性症状、一般精神病理症状和PANSS总评分比较 治疗前3组阳性症状评分、阴性症状评分和PANNS总评分差异均无统计学意义(F=0.027~0.779,P=0.974~0.462);治疗第12周末,3组阳性症状评分、阴性症状评分和PANNS总评分差异均无统计学意义(F=0.075~0.764,P=0.928~0.467);与治疗前比较,3组各项评分均显著性降低(F=14.381~70.526,P=0.001~0.000)。如图2。
2.5 3组药物不良反应比较 A组在研究期间出现恶心、便秘、椎体外系反应共7例,B组出现恶心、便秘、腹泻、椎体外系反应共6例,C组出现口干、便秘、椎体外系反应共6例,3组不良反应发生率分别为21.21%(7/33)、18.75%(6/32)、20.00%(6/30),差异比较无统计学意义(F=0.150,P=0.928);出现不良反应的患者TESS评分分别为(2.43±0.53)、(2.50±0.55)、(2.33±0.52)分,差异比较无统计学意义(F=0.148,P=0.864)。
3 讨论
3.1 黄连与肉桂配伍规律和作用机制阐明有助于提高临床用药的准确性及有效性 明代韩懋《韩氏医通》最早记载了“黄连生用为君,佐官桂少许”,治心肾不交、怔忡无寐,未标明黄连与肉桂用量。直至清代王士雄《四科简效方》才记载“生川连五钱,肉桂心五分”,明确黄连与肉桂(10∶1)配伍比例。现代研究发现,黄连与肉桂配伍比例不同而药效不同[9]。高效液相色谱(High performance liquid chromatography, HPLC)法测得正常人服黄连素后的色谱图显示波峰尖而陡[10],说明黄连素在体内的药效维持时间短。而黄连素可随体内停留时间延长而增强药效[11-12]。本研究结果表明,黄连与肉桂(1∶0.5)配伍降低TG水平显著优于(1∶0.1)配伍(P<0.05),可能原因有:①黄连的主要效应成分黄连素具有P-糖蛋白(P glycoprotein, P-gp)底物的作用性质,肉桂可能是P-gp的抑制剂,抑制P-gp携黄连素排出细胞[7],黄连与肉桂(1∶0.5)、(1∶0.1)配伍中的黄连剂量相同,黄连与肉桂(1∶0.5)配伍因肉桂剂量较大而抑制P-gp作用较强,造成其黄连主要有效成分黄连素在细胞内停留时间较长,黄连素与肌体细胞酶系、靶点相互作用时间也较长,药效维持时间较长。②P-gp主要分布于胃肠道的柱状上皮细胞、肝细胞与肾近曲小管刷状缘等,可选择性表达于药物吸收、代谢、消除的关键部位细胞中[13],黄连与肉桂(1∶0.5)配伍因肉桂对P-gp抑制作用较强,其黄连主要成分黄连素被吸收的量较大、体内停留时间较长[14],药效维持时间也较长。
3.2 黄连与肉桂(1∶0.5)配伍干预奥氮平致脂代谢紊乱是一种有效的方药手段 奥氮平致脂代谢紊乱的可能原因有:①单磷酸腺苷活化蛋白激酶(AMP-activated protein kinase, AMPK)活性取决于AMPKα蛋白的苏氨酸磷酸化(Thr172)[15],奥氮平可抑制AMPKα蛋白(Thr172)的磷酸化,AMPK对哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)2个下游效应分子S6KI和4E-BPI的抑制作用减弱,mTOR活性增强,增加下游甾醇调节因子结合蛋白-1(sterol regulatory element binding protein-1, SREBP-1)调控因子的转录[16],TG合成增加;②奥氮平可上调肝脏中甾醇调节因子结合蛋白-2(sterol regulatory element binding protein-2, SREBP-2)控制的胆固醇合成基因表达[17],胆固醇合成增加。本研究结果发现,黄连与肉桂(1∶0.5)、(1∶0.1)配伍均可抑制奥氮平引起TC、TG水平升高,而黄连与肉桂(1∶0.5)配伍降低TG水平更显著(P<0.05)。可能原因:①黄连的主要成分黄连素可通过抑制呼吸链来提高.AMP/ADP水平,激活AMPK信号通路[18],从而抑制TG合成,黄连与肉桂(1∶0.5)配伍因药效维持时间较长而药效较好;②黄连的主要成分黄连素可抑制SREBP-2调控因子的转录[19],故黄连与肉桂(1∶0.5)、(1∶0.1)配伍均可下调肝脏中SREBP-2控制的胆固醇合成基因表达,抑制TC合成。
3.3 黄连与肉桂(1∶0.1)配伍干预奥氮平致糖代谢紊乱可能更合理 炎性细胞因子IL-1β、IL-6、TNF-α可干扰胰岛素受体底物(insulin receptor substrate, IRS)信号转导通路,导致IR。本研究发现,黄连与肉桂(1∶0.5)配伍降低炎性细胞因子IL-1β、IL-6、TNF-α水平较(1∶0.1)配伍存在明显优势(P<0.05),但两者降低FBG水平差异无统计学意义(P>0.05)。由此推测黄连与肉桂配伍改善糖代谢紊乱的途径是一个复杂网络,通过抑制炎性细胞因子IL-1β、IL-6、TNF-α改善IR而降低FBG水平只是其一。唐偲等[20]研究认为,黄连的主要成分黄连素能有效抑制小肠上皮细胞上二糖酶(主要是蔗糖酶、麦芽糖酶)活力,抑制或延缓小肠上皮细胞吸收葡萄糖,以降低血糖水平。可以看出黄连素在肠道就可抑制葡萄糖吸收,改善糖代谢紊乱似乎运用黄连与肉桂(1∶0.1)配伍更合理。
3.4 黄连与肉桂配伍方药安全、有效 本研究提示,黄连与肉桂不同配伍组患者的TESS量表评分与安慰剂组比较差异没有统计学意义(P>0.05),说明其安全性良好。本研究结果还表明,黄连与肉桂配伍对精神分裂症阳性症状、阴性症状和PANNS总评分影响与安慰剂比较差异无统计学意义(P>0.05),推测黄连与肉桂配伍不影响抗精神病药代谢和疗效。
总之,黄连与肉桂不同配伍对奥氮平所致糖脂代谢紊乱均有明显疗效,而黄连与肉桂(1∶0.5)配伍降低炎性细胞因子IL-1β、IL-6、TNF-α以及TG水平更有优势。这一结果的意义在于:①黄连与肉桂(1∶0.5)配伍更有利于改善奥氮平致糖脂代谢紊乱;②黄连可通过多靶点作用干预糖代谢紊乱,黄连与肉桂(1∶0.1)配伍干预糖代谢紊乱可能更合理;③掌握黄连与肉桂配伍规律和作用机制有利于提高临床用药的准确性、有效性。

