丹参无糖配方颗粒制备工艺研究及其质量评价
李筱玲,邓寒霜,赵月梅,牛灵霄
(商洛学院 生物医药与食品工程学院,陕西商洛 726000)
丹参为唇形科鼠尾草属植物丹参(SalviamiltiorrhizaBge.)的干燥根及根茎[1],主产于陕西、安徽、山西、河北、四川、江苏等地,具有活血通络、祛瘀止痛、凉血消痈、清心除烦等功效,常用作于治疗心绞痛、冠心病及胸腹刺痛、经闭痛经等病症,入药历史悠久[2-4]。丹参的主要化学成分可分为两类,一是脂溶性的丹参酮类化合物,主要有丹参酮ⅡA、丹参酮Ⅰ和隐丹参酮等;二是水溶性的丹酚酸类成分,主要有丹酚酸B、原儿茶醛、丹参素等[5,6]。丹参酮ⅡA具有抗肿瘤、抗氧化、抗凝血及抗血栓等作用,是治疗冠心病的主要有效成分之一;丹酚酸B、丹参素具有抗心肌缺血、缺氧等活性,临床用途十分广泛[7-9]。
中药配方颗粒是以传统中药为原料,经提取、浓缩、制粒等工艺,制成的一种统一规格、统一剂量、统一标准的新型配方用药,是由单味中药饮片制成的、供中医临床配方用的颗粒。相比于传统中药,中药配方颗粒制剂具有服用方便、易于携带,质量规格统一,便于保管、存放,临床使用组合方便快捷,灵活多变等优势[10-12]。
中药颗粒剂按照是否添加蔗糖为辅料,可以分为含糖颗粒和无糖颗粒两类。由于蔗糖具高生物活性,易诱发胃炎、龋齿、糖尿病及肥胖等病症,含糖颗粒不宜用于年老及禁糖患者。无糖颗粒是一种新型的中药颗粒剂,扩大了颗粒剂的适应范围,可解除糖尿病患者及糖耐量不足患者的用药限制[13-16]。本课题旨在遵循传统中医用药理论、确保药材有效成分得以保留的前提下,探索丹参无糖配方颗粒的最优制备工艺,以期为进一步开发丹参药材资源奠定一定的基础。
1 材料与方法
1.1 实验材料
1.1.1 药材与药品 丹参,购自陕西天士力植物药业有限公司,经商洛学院执业药师李筱玲鉴定为唇形科鼠尾草属植物丹参(SalviamiltiorrhizaBge.)的干燥根及根茎;丹参酮ⅡA对照品(批号:568-72-9)、丹酚酸B对照品(批号:115939-25-8),购自北京世纪奥科生物技术有限公司;可溶性淀粉(AR,山东德彦化工有限公司);色谱纯甲醇(HPLC,Fisher Chemical);95%乙醇(AR,天津元泽化工贸易有限公司);无水乙醇(AR,天津元泽化工贸易有限公司);甲醇(AR,天津元泽化工贸易有限公司);磷酸(AR,山东德彦化工有限公司);纯净水(杭州娃哈哈集团有限公司)等。
1.1.2 仪器与设备 高效液相色谱仪(LC-20A,岛津公司,具体配置为:在线脱气机、四元泵、自动进样器、二极管阵列检测器);C18色谱柱(4.6 mm×250 mm,5μm,Kromasil公司);电子天平(BS110,赛多利斯天平公司);电热鼓风干燥箱(DHG-9030A,上海齐欣科学仪器有限公司);微型粉碎机(FW80,天津泰斯特仪器有限公司);旋转蒸发器(RE52-99,上海亚荣生化仪器厂)等。
1.2 试验方法
1.2.1 药材前处理 取丹参药材,除去泥土等杂质后,剪成0.5 cm的小段,干燥备用。
1.2.2 丹参提取物的制备 主要有:
(1)水提物的制备。
取处理好的药材100 g,加入12倍量的水,置锅中煎煮3次,每次1.5 h,过滤,收集滤液;合并3次滤液置旋转蒸发仪中减压浓缩至约100 mL,将浓缩后的滤液转移至蒸发皿中,置恒温水浴锅上,继续浓缩至稠膏状,控制相对密度约为1.3左右,即得[17]。
(2)醇提物的制备
将水提后的药渣置圆底烧瓶内,加入8倍量的95%乙醇,在80℃下加热回流提取3次,每次1 h,过滤,收集滤液;合并3次滤液,置旋转蒸发仪中减压浓缩至约100 mL,将浓缩后的滤液转移至蒸发皿中,置恒温水浴锅上,继续浓缩至稠膏状,控制相对密度约为1.3左右,即得[18-20]。
1.2.3 活性成分的含量测定[1]主要有:
(1)丹参酮类。
对照品溶液的制备取丹参酮ⅡA对照品适量,加甲醇溶解,配制成浓度为19 μg·ML-1的对照品溶液,备用。供试品溶液的制备取样品粉末(过三号筛)约0.3g,精密称定重量,置具塞锥形瓶中,精密加入甲醇50 mL,密塞,称定重量,超声处理(功率140W,频率42 kHz)30 min,取出放冷,再称定重量,用甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。
色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂;以乙腈为流动相A,以0.02%磷酸溶液为流动相B,按表1中的规定进行梯度洗脱;柱温为20℃;检测波长为270 nm。

表1 高效液相梯度洗脱程序
测定法分别精密吸取对照品溶液与供试品溶液各10 μL,注入液相色谱仪,以丹参酮ⅡA对照品为参照,以其相应的峰为S峰,照表2中规定,计算样品色谱图中隐丹参酮、丹参酮Ⅰ的相对保留时间,其相对保留时间应在规定值的±5%范围之内;以丹参酮ⅡA的锋面积为对照,分别乘以校正因子,计算样品中隐丹参酮、丹参酮Ⅰ、丹参酮ⅡA的含量。相对保留时间及校正因子见表2。
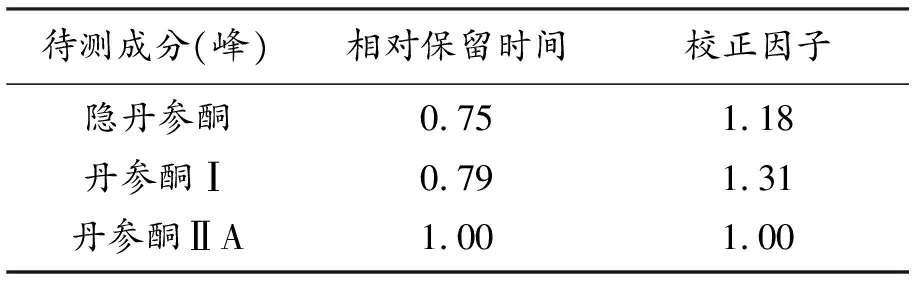
表2 丹参酮类成分的相对保留时间及校正因子
(2)丹酚酸B。
对照品溶液的制备取丹酚酸B对照品适量,以甲醇-水(8:2)混合溶液溶解,制成浓度为0.201 mg·mL-1的对照品溶液,备用。
供试品溶液的制备取样品粉末(过三号筛)约0.15 g,精密称定重量,置具塞锥形瓶中,精密加入甲醇-水(8:2)混合溶液50mL,密塞,称定重量,超声处理(功率140 W,频率42 kHz)30 min,取出放冷,再称定重量,用甲醇-水(8:2)混合溶液补足减失的重量,摇匀,滤过,精密量取续滤液5mL,移至10mL量瓶中,加甲醇-水(8:2)混合溶液稀释至刻度,摇匀,滤过,取续滤液,即得。色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂;以乙腈-0.1%磷酸溶液(22:78)为流动相;柱温为20℃;流速为1.0 mL·min-1;检测波长为286 nm,进样量10 μL。
1.2.4 颗粒剂制备流程 将1.2.2项中所得全部丹参药材水提物、醇提物浸膏合并,混合均匀,取混合浸膏适量,按表3中方法加入辅料、润湿剂,用手不断搓捏混匀至“手握成团,轻压即散”状后,挤压通过制粒筛,收集所得颗粒,在60 ℃下烘干,即得。
1.2.5 正交试验方案 以可溶性淀粉为辅料、不同浓度的乙醇溶液为润湿剂;以辅料用量、润湿剂用量、乙醇浓度为考察因素,以颗粒剂中有效成分含量及外观性状等检查项目为评价指标,进行3因素4水平正交试验。因素水平和正交试验设计方案见表3、表4。
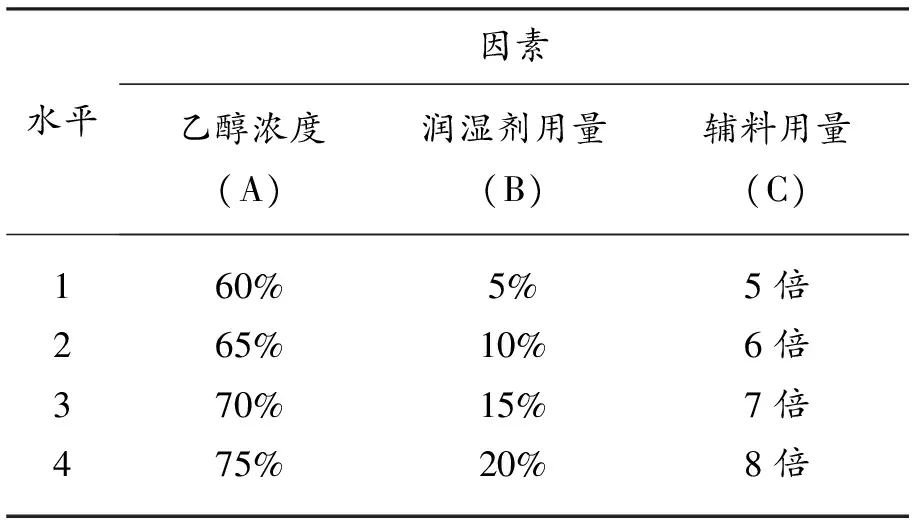
表3 丹参无糖配方颗粒制备正交试验因素水平
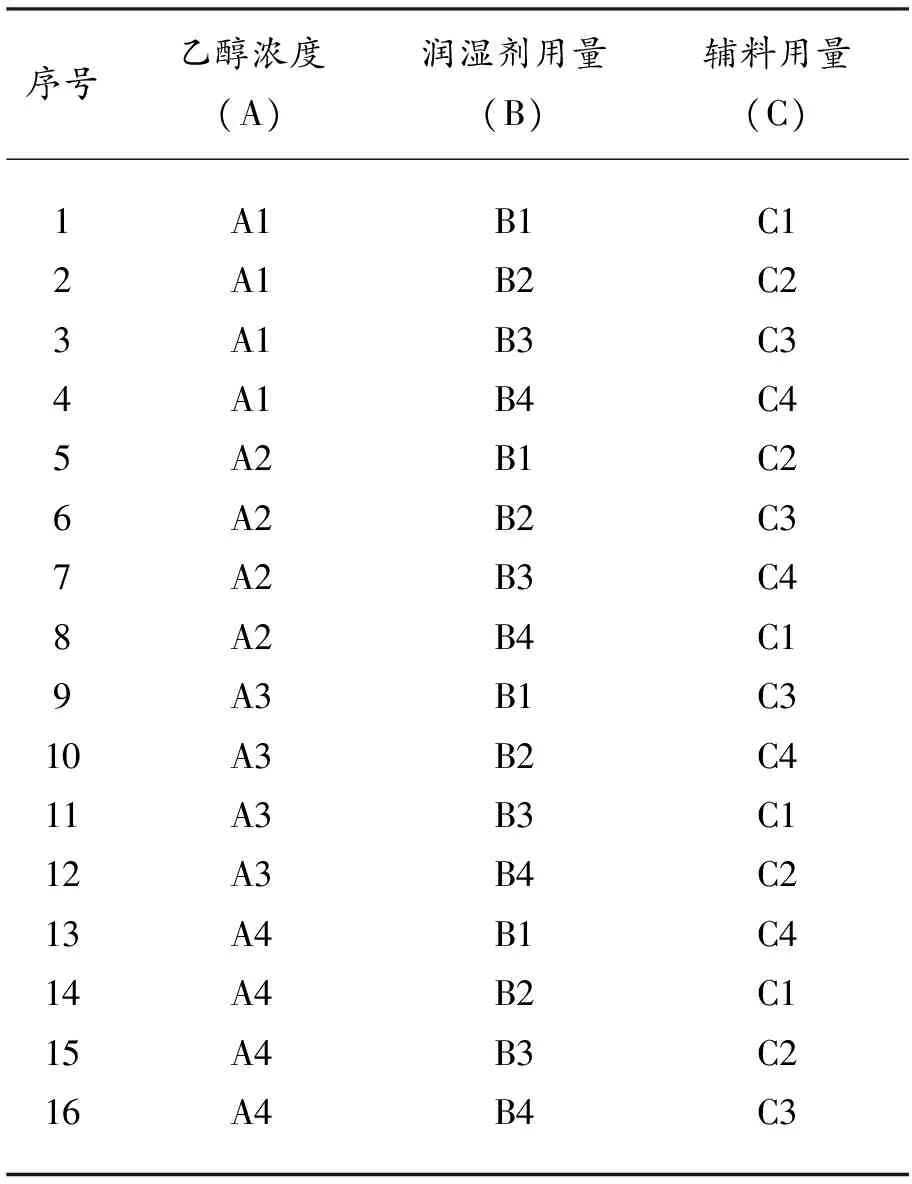
表4 丹参无糖配方颗粒制备正交试验方案
1.2.6 颗粒剂质量评分标准 照1.2.3项中规定,对所得丹参无糖配方颗粒进行含量测定;照《中国药典(2015版,第四部)》中有关颗粒剂质量评价的规定,对所得丹参无糖配方颗粒进行粒度、溶化性、水分和干燥失重检查;对含量测定及各项检查结果进行打分,以各项目得分总和为综合评价指标。其中丹参酮类成分含量占30分,丹酚酸B含量占30分;颗粒剂粒度、水分、溶化性和干燥失重的检查结果各占10分,具体评分标准如下。
①含量测定项目,以含量最高者为满分30分,其他组数据与最高者相比,再乘以30分,即为其分数;
②粒度检查项目,以不合格率最低者为满分为10分,最低者与其他组数据相比,再乘以10分,即为其他组分数;
③溶化性检查项目,以全部溶化者为满分10分,轻微浑浊8—9分,中度浑浊6—7分,重度浑浊0—5分;
④水分检查项目,以含水量最低者为满分10分,最低者与其他组数据相比,再乘以10分,即为其他组分数;
⑤干燥失重项目检查,以减失重量最低者为满分10分,最低者与其他组数据相比,再乘以10分,即为其他组分数。
2 结果与分析
2.1 丹参原药材的含量测定
取丹参药材适量,照1.2.3项中规定,分别进行丹参酮类和丹酚酸B含量测定,记录其色谱分析信号,如图1-图4所示。
图1 丹参酮ⅡA标准品色谱
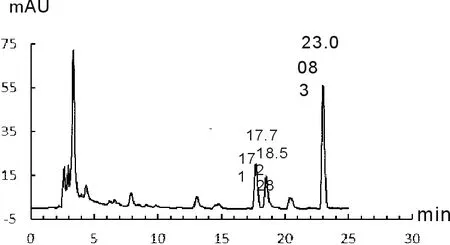
1 隐丹参酮 2 丹参酮Ⅰ 3 丹参酮ⅡA
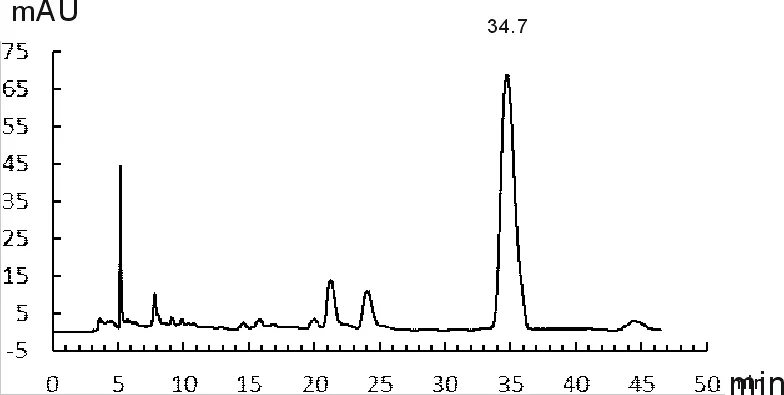
图3 丹酚酸B标准品色谱
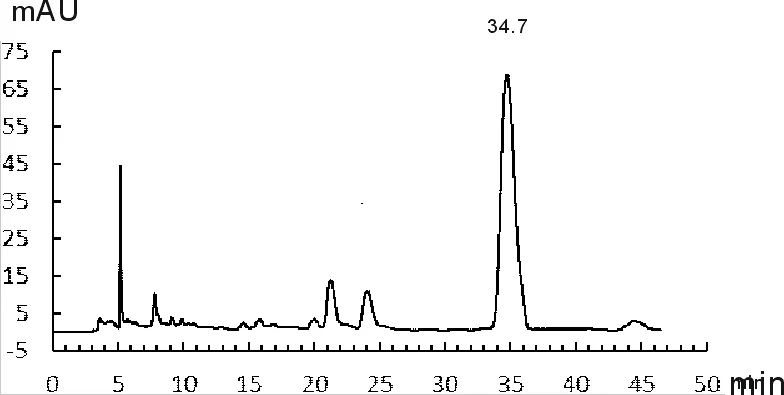
图4 丹参药材中丹酚酸B色谱
由图1~图4可知,丹参酮ⅡA保留时间为22.930 min、丹酚酸B的保留时间为34.731 min;供试品溶液中隐丹参酮、丹参酮Ⅰ、丹参酮ⅡA保留时间分别为17.717 min、18.528 min和23.008 min,其相对保留时间分别为0.77、0.80和1.00,与药典规定相比均末超出5%范围,符合药典要求;供试品溶液中丹酚酸B保留时间为34.737 min,与对准品保留时间基本一致。计算得药材中丹参酮ⅡA的含量为0.36%、隐丹参酮的含量为0.43%,丹参酮Ⅰ的含量为0.48%,三者总量为1.27%;丹酚酸B的含量为4.16%,均符合药典要求。其中丹参酮总量达到药典标准5倍以上,丹酚酸B含量达到药典要求2倍以上,说明本研究所用丹参药材质量较好。
2.2 丹参无糖配方颗粒的质量检查
2.2.1 外观性状 如图5所示,试验所得颗粒剂干燥、粒度均匀,同处理颗粒剂色泽一致,呈浅红棕色,无吸潮、软化、结块、潮解等现象。
2.2.2 粒度、水分、干燥失重及溶化性检查 照《中国药典(2015版,四部)》颗粒剂相关检查项目规定[21],对不同处理所得颗粒进行粒度、水分、干燥失重及溶化性检查,具体结果见表5。
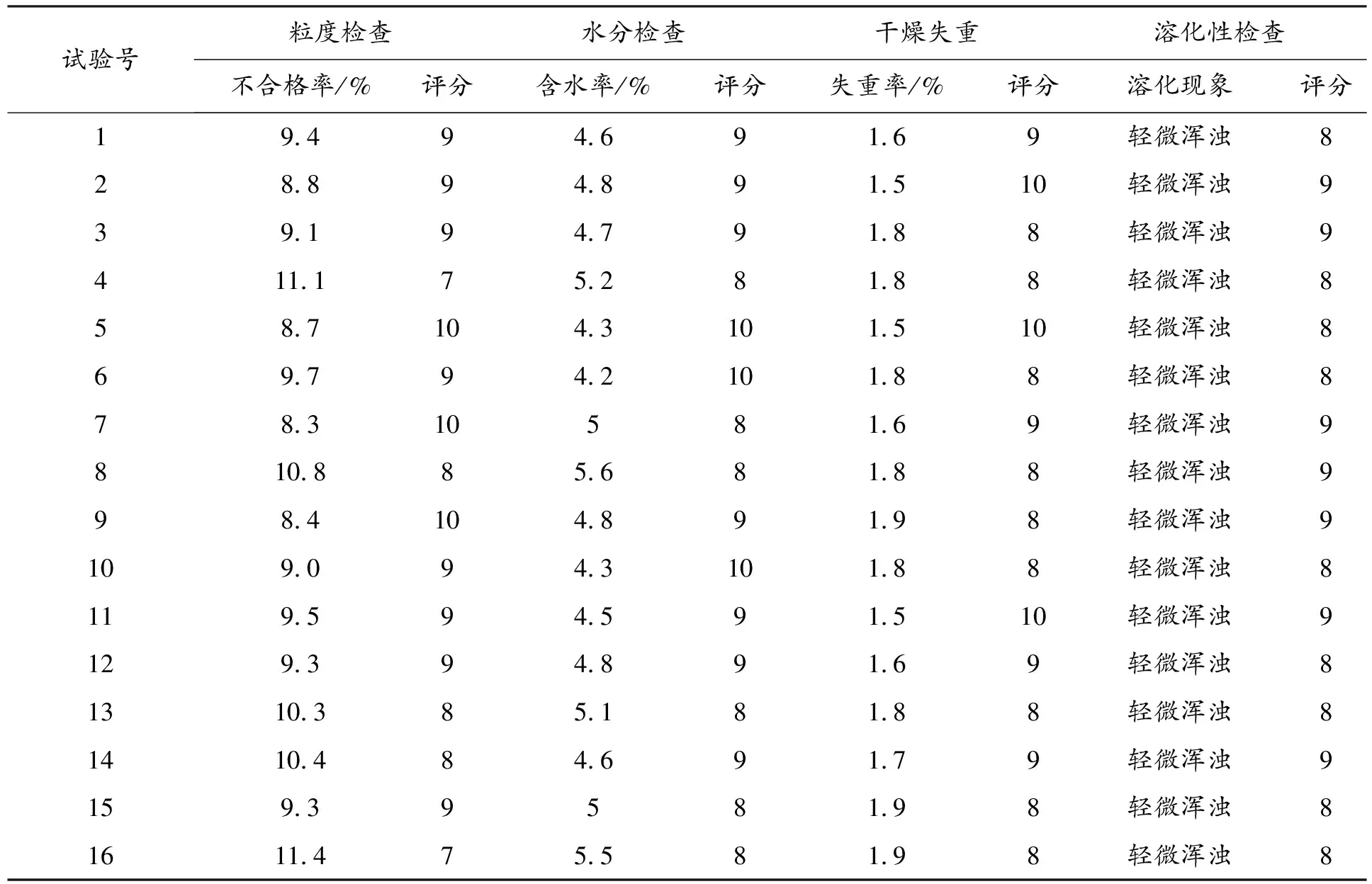
表5 丹参无糖配方颗粒粒度、水分、溶化性检查结果
注:《中国药典》规定粒度不合格率≤15%、水分≤8%、干燥失重≤2.0%,溶化性应为全部溶解或轻微浑浊。
由表5数据可知,不同处理所得丹参无糖配方颗粒各项检查指标均符合药典要求。
2.2.3 丹参无糖配方颗粒的含量测定 取不同处理所得颗粒剂适量,照1.2.3项中规定进行含量测定,记录色谱图如图5、图6所示,具体检测结果见表6。
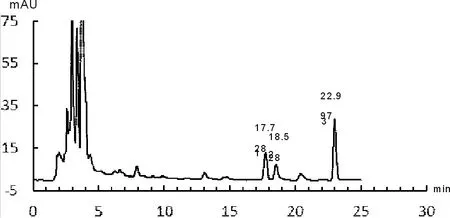
1 隐丹参酮 2 丹参酮Ⅰ 3 丹参酮ⅡA
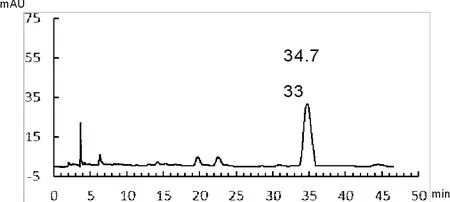
图6 丹参无糖配方颗粒丹酚酸B色谱
由图6、图7及表6可知,所得各颗粒剂样品中均含有隐丹参酮、丹参酮Ⅰ、丹参酮ⅡA和丹酚酸B等成分,且颗粒剂与药材色谱图形状基本一致,说明丹参原药材中的有效成分已成功转移至无糖配方颗粒中。各处理中,当辅料用量为浸膏量5倍,乙醇浓度为75%,润湿剂用量为辅料与浸膏总量的10%时,所得颗粒剂中丹参酮类成分含量最高,为0.628%;当辅料用量为浸膏量5倍,乙醇浓度为60%,润湿剂用量为辅料与浸膏总量的5%时,所得颗粒剂中丹酚酸B含量最高,为2.030%。

表6 丹参无糖配方颗粒活性成分含量测定结果
2.3 正交试验结果
将各处理所得颗粒剂按1.2.6项下规定进行质量评分,并以各项目得分之和作为综合评价指标进行正交分析,具体结果见表7、表8。

表7 丹参无糖配方颗粒制备试验正交分析结果
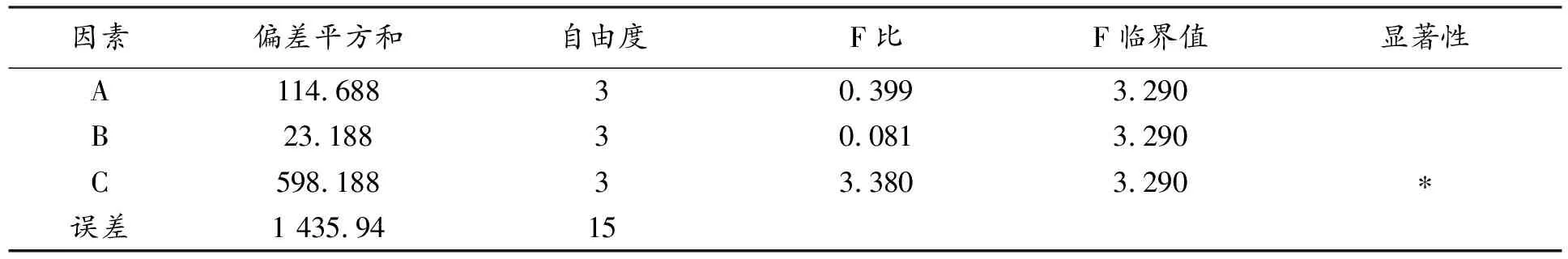
表8 丹参无糖配方颗粒制备工艺正交试验方差分析
由表7、表8数据分析可知,试验因素对实验结果影响的主次顺序为C>A>B,即辅料用量对颗粒剂质量影响最大,其次是乙醇浓度的影响,润湿剂用量对实验结果影响最小。经正交实验优选得最佳因素水平组合为A4B2C1,即以75%的乙醇溶液为润湿剂,润湿剂用量为辅料与浸膏总量的10%,辅料用量为药物浸膏量的5倍,在此条件下制得的丹参无糖配方颗粒质量最优。由表7可知,14号试验处理条件与本文优选出的最优条件完全相同,在此处理下制得的颗粒剂综合评分在所有处理中得分最高,说明正交试验结果可信。
为进一步检验正交试验结果的可靠性,本文对筛选出的最优工艺进行了验证,结果见表9。
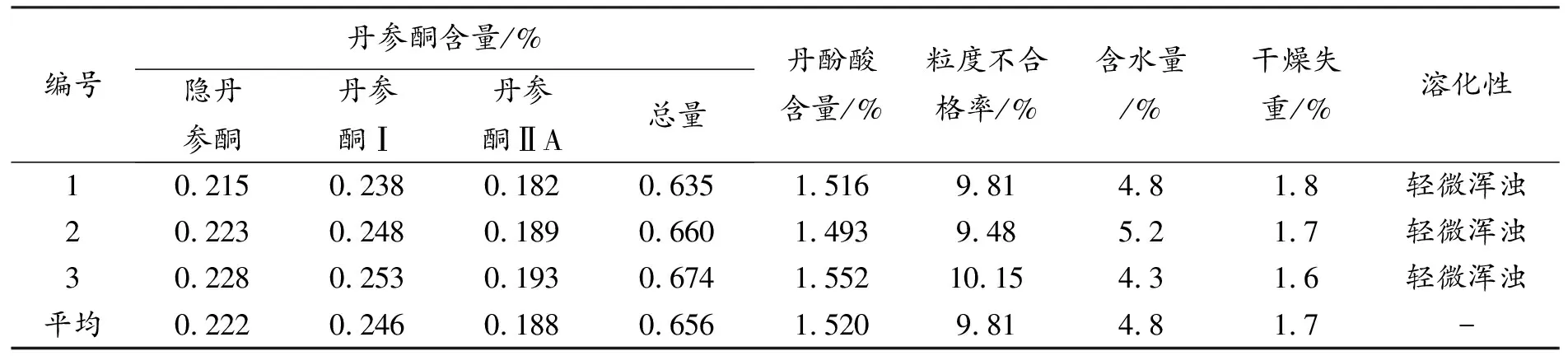
表9 丹参无糖配方颗粒制备最优工艺条件验证试验结果
由表9可知,验证试验各项指标检测结果与正交试验最优处理结果相近,所得颗粒剂干燥、粒度均匀、色泽一致,呈浅红棕色,无吸潮、软化、结块、潮解等现象,表明正交试验优选结果可靠,所得最优制备工艺可行,在最优工艺下制备所得丹参无糖配方颗粒质量较好。
3 结论与讨论
中药配方颗粒相较于传统汤剂来说,具有方便服用、便于携带、易于调配、剂量准确等优点;而相对于片剂来说,颗粒剂的溶解时间短、药物溶出迅速、患者吸收快,能降低部分药物对胃的刺激、生物利用度高。特别是无糖型颗粒,因其不含蔗糖,使得颗粒剂质量更为稳定,且更适合老年、儿童及糖尿病患者使用。本文在参阅部分参考文献及充分预试验的基础之上,对丹参无糖配方颗粒的制备工艺进行了探索,得出其最佳制备工艺为:取丹参药材提取物适量,以5倍于丹参提取物的可溶性淀粉为辅料,加入辅料与浸膏总量的10%的75%乙醇为润湿剂,充分搓捏混匀,制成软材后,挤压通过制粒筛,制成颗粒,于60℃烘干,即得。
因药材浸膏的相对密度,对颗粒剂制备效果影响较大,本文还对浸膏密度进行了考察,发现当相对密度在1.25~1.30之间时,药材浸膏粘度适宜,挂壁现象较轻,浸膏损失小,因此本文所有试验处理均将药材浸膏相对密度控制在1.30左右。
丹参作为一种传统中药,长期记载于《中国药典》中,且成为我国第一个被列入美国药典的中药[22]。丹参是“五大商药”之首,陕西省商洛市是我国丹参主要产区之一,丹参蕴藏量丰富。陕西天士力植物药业有限公司生产的丹参是我国第一个拿到国家《中药材生产质量管理规范》(Good Agricultural Practice ,GAP)认证的药材。丹参作为中医临床使用和中成药生产中最为常见的品种之一,具有良好的市场开发前景。本课题组在今后的研究中将进一步对丹参无糖配方颗粒的制备工艺进行优化,并对其药理、药效做初步的探索。

