黄花蒿醇提物对奶牛乳腺细胞中共轭亚油酸合成相关酶基因表达的作用
王丽芳,张兴夫
黄花蒿醇提物对奶牛乳腺细胞中共轭亚油酸合成相关酶基因表达的作用
王丽芳,张兴夫
(内蒙古自治区农牧业科学院,呼和浩特 010031)
【】通过奶牛乳腺上皮细胞体外培养试验,研究黄花蒿乙醇提取物对乳腺上皮细胞中与共轭亚油酸(CLA)合成相关酶的基因SCD表达的影响,探讨其对乳脂肪合成相关酶ACACA和FASN基因以及与脂肪转运相关酶LPL基因表达的影响,旨在从乳腺层次探明黄花蒿乙醇提取物对乳中CLA合成的部分作用机制。将采自于健康泌乳中期荷斯坦奶牛的乳腺组织用保温盒带回实验室,在无菌条件选取腺泡较多的深层组织,采用胶原酶消化法获得乳腺上皮细胞,放于37℃,CO2浓度为5%的培养箱中进行原代培养。试验所用的细胞是经过复苏的第二代细胞,待细胞复苏后,以3×104个/mL的密度接种细胞到24孔板中,分别置于37 ℃的5% CO2培养箱中培养,采用台盼蓝计数法每天进行一次计数,设3个重复,连续7 d,未计数组每2天换液一次,绘制细胞生长曲线。另外,待细胞生长至对数增殖期,更换新鲜培养液,随机分为4组,即培养液中黄花蒿提取物的浓度为0、3.0、6.0、12.0 mg·L-1,提取物作用时间均为48 h,检测不同浓度黄花蒿提取物对与脂肪酸合成相关酶SCD、ACC、FAS、LPL 基因表达量的影响。每个处理3个重复。使用倒置显微镜观察,乳腺上皮细胞形态呈铺路石样;在3×104个/mL的接种密度下,细胞生长曲线呈S型,在1—2d乳腺上皮细胞为潜伏期,3—6d为指数增长期,之后进入平台期,符合一般细胞生长曲线规律,说明培养的乳腺上皮细胞具有正常的增殖能力,可以用于后续的研究;与对照组相比,添加黄花蒿乙醇提取物有增加SCD酶基因表达量的趋势,其中3mg·L-1组显著增加了SCD酶的基因表达量(<0.05),而6 mg·L-1组和12mg·L-1组虽然增加了SCD酶的基因表达量,但与对照组相比差异不显著(>0.05);添加黄花蒿乙醇提取物有增加乳腺上皮细胞中ACACA基因表达量的趋势,但与对照组相比差异不显著(>0.05),且随着添加剂量的增加,有下降趋势;添加黄花蒿乙醇提取物可以增加乳腺上皮细胞中FASN基因表达量,呈剂量依赖型增加,且12mg·L-1组可以显著增加乳腺上皮细胞中FASN基因表达量(<0.05);添加黄花蒿乙醇提取物有降低乳腺上皮细胞中LPL基因表达量的趋势,呈剂量依赖型降低,且6 mg·L-1组和12mg·L-1组显著降低了乳腺上皮细胞中LPL基因表达量(<0.05)。黄花蒿乙醇提取物可以增加奶牛乳腺上皮细胞中SCD、ACACA和FASN酶基因的表达,有利于调控CLA和乳脂肪的生成。
黄花蒿乙醇提取物;奶牛乳腺上皮细胞;SCD;ACACA;FASN;LPL
0 引言
【研究意义】共轭亚油酸(CLA)是一组亚油酸的几何异构体和位置异构体的总称,主要来源于反刍动物,在瘤胃氢化过程中形成,也可以通过trans-11C18:1转化而成[1-2]。反式结构中含有双键的异构体具有生物活性,研究最多的具有生物活性的CLA是cis-9,trans-11和trans-10,cis-12。CLA具有许多生物学作用,对人和动物健康影响的研究表明,CLA可能在癌症、心血管疾病、肥胖、骨质疏松以及免疫和炎症反应中发挥重要的保护作用[3-6]。因此增加反刍动物产品中CLA含量成为当前的研究热点。【前人研究进展】Stefanie等[7]研究表明,奶牛日粮中添加亚麻籽可以增加乳中cis-9,trans-11CLA含量,其中以谷物青贮为粗饲料的日粮作为对照组,在此基础上添加亚麻籽作为试验组,试验组中cis-9,trans-11CLA含量比对照组增加了126.92%,以牧草青贮为粗饲料的日粮中添加亚麻籽cis-9,trans-11CLA含量比对照组增加了132.69%。Bayat等[8]研究表明,奶牛日粮中添加红花油和亚麻油分别极显著和显著增加了乳中cis-9,trans-11CLA含量,而添加菜籽油和肉豆蔻酸甲酯对乳中CLA含量没有显著影响;王丽芳[9]研究表明,与对照组相比,奶牛日粮中添加整粒亚麻籽和棉籽的混合物可以使乳中cis-9,trans-11CLA含量增加16.7%;也有研究报道,植物及其提取物可以增加羊奶、牛奶及乳腺上皮细胞中cis-9,trans-11CLA含量[10-15];另外,也有研究对乳中CLA含量的调控机制开展了相关研究。王丽芳等[16]通过奶牛饲养试验,研究了黄花蒿乙醇提取物对瘤胃中氢化菌—溶纤维丁酸弧菌和蛋白溶解梭菌的影响;孙攀峰[17]通过体外批次培养试验,研究了苜蓿、稻草和青贮玉米不同组合对瘤胃氢化菌—溶纤维丁酸弧菌和蛋白溶解梭菌的影响。【本研究切入点】乳中CLA主要来源于两方面,一方面是亚油酸和亚麻酸在瘤胃中通过氢化菌氢化形成,另一方面是trans-11C18:1在乳腺中通过硬脂酰辅酶A去饱和酶SCD去饱和形成。上述研究多数集中于如何增加乳中CLA含量,少数研究从瘤胃氢化角度探讨了CLA生成的调控机制,但是对于如何从乳腺层次研究CLA生成的调控机制却鲜有报道。【拟解决的关键问题】通过乳腺上皮细胞体外培养技术,研究黄花蒿乙醇提取物对影响CLA合成的SCD基因表达的影响,同时探讨对脂肪酸合成相关酶的基因表达的影响,旨在从乳腺层次探明黄花蒿乙醇提取物对乳中CLA合成的部分作用机制。
1 材料与方法
1.1 材料与仪器
1.1.1 黄花蒿乙醇取物 黄花蒿乙醇提取物购于南京泽朗公司,提取工艺条件是:乙醇浓度55%,提取温度95℃,提取2 h。GC-MS和LC-MS分析的黄花蒿乙醇提取物活性成分主要包括:倍半萜类35%、芳香族类29%、脂肪酸类6%、甾体类6%、三萜类6%、脂肪族类4%、生物碱类3%、酚类5%、杂环类2%、其他4%(GC-MS);黄酮类和萜类(LC-MS)。
1.1.2 试剂 DMEM/F12培养基(Gibco,美国)、双抗(Gibco,美国)、两性霉素B(Gibco,美国)、胎牛血清(Gibco,美国)、胰岛素转铁蛋白(Gibco,美国)、DPBS平衡盐缓冲溶液(Hyclone,美国)、0.25%的胰蛋白酶(Gibco,美国)、二甲基亚砜(DMSO,Sigma,美国)、0.25%Trypsin-EDTA(Gibco 25200- 056)、胶原酶Ⅱ(Gibco 17101-015)、EGF(Gibco PHG-0313)、催乳素(Sigma L6520)、氢化可的松(Sigma H0135)、L-谷氨酰胺(Sigma G-8540)、SYBR Premix Ex TaqTMⅡ(TaKaRa DRR 081A)、PrimeScript RT Master Mix(TaKaRa DRR036A)、细胞总RNA提取试剂盒(TIANGEN DP430)。
1.1.3 仪器 电热恒温CO2培养箱(Heal Force HF240)、超净工作台(泰斯特)、电热干燥箱、细胞培养用倒置相差显微镜(Olympus LX71)、普通冰箱(海尔)、超纯水机(Purelab ELGA LA-611)、超低温冰箱(Thermo)、电热鼓风干燥箱(上海恒科)、电热恒温水浴锅(北京光明仪器)、高压蒸汽灭菌仪(HIRAYAMA HVE-50)、细胞计数仪(Cytorecon CYT-1000)、常温低速离心机(Thermo)、磁力搅拌器、pH计、电子天平、荧光定量PCR仪(Bio-Rad)。
1.2 试验方法
1.2.1 乳腺上皮细胞培养 乳腺上皮细胞培养方法参照文献[18],将采自于健康泌乳中期荷斯坦奶牛的乳腺组织用保温盒带回实验室,在无菌条件选取腺泡较多的深层组织,采用胶原酶消化法获得乳腺上皮细胞,放于37℃,CO2浓度为5%的培养箱中进行原代培养。再利用成纤维细胞和乳腺上皮细胞对0.25%胰蛋白酶感受灵敏度的不同,通过调整消化时间来去除成纤维细胞,进而使乳腺上皮细胞得到纯化。纯化后的细胞冻于-80℃冰箱备用。试验所用的细胞是经过复苏的第二代细胞。
1.2.2 细胞生长曲线绘制 以3×104个/mL的密度接种细胞到24孔板中,分别置于37 ℃的5% CO2培养箱中培养,采用台盼蓝计数法每天进行一次计数,设3个重复,连续7d,未计数组每2d换液一次,绘制细胞生长曲线。
1.3 测定指标
1.3.1 脂肪酸合成相关酶的测定 待细胞生长至对数增殖期,更换新鲜培养液,随机分为4组,即培养液中黄花蒿提取物的浓度为0、3.0、6.0、12.0 mg·L-1,提取物作用时间均为48 h,检测不同浓度黄花蒿提取物对与脂肪酸合成相关酶SCD、ACC、FAS、LPL 基因表达量的影响。每个处理3个重复。
1.3.2 细胞总RNA提取 采用天根细胞RNA提取试剂盒(RNAprep pure Cell/Bacteria Kit ,DP430,离心柱型)提取细胞RNA。
1.3.3 反转录反应 按下列组配制RT 反应液(反应液的配制应在冰上进行):向200µL PCR管中依次加入5×PrimeScript Buffer 2µL、总RNA 2µL、Rnase Free dH2O 6µL;小心混匀;按以下条件进行反转录反应:37 ℃ 15 min ,85 ℃ 5 s ,4 ℃ 2 h ;得到的RT 反应液(cDNA)保存于4 ℃,用于后续的Real-Time PCR 反应。
1.3.4 Real-Time PCR 反应 在Bio-Rad IQ5 Real-Time PCR 仪上进行,试验所用引物参考见下表1。选用管家基因β-Actin为内参。选用TaKaRa Real-Time PCR试剂盒(SYBR Premix Ex TaqTMⅡ),反应体系为20 µL:10 μL SYBR Premix Ex TaqTMⅡ(2×),0.4 µL上游引物,0.4µL下游引物,2 µL cDNA模板,7.2µL dH2O。反应程序为:95℃ 30 s ;95 ℃ 10 s;退火温度下 20 s;72 ℃ 30 s;40个循环。熔解曲线程序为:95 ℃ 1 min;70 ℃ 1 min;温度变化为0.5 ℃/6 s 。反应结束后,仪器自动生成关于Ct值的数据报告,再根据文献采用2-ΔΔCt法计算得知各基因的相对表达量。
1.4 数据处理
试验数据采用Excel 2007 整理后,根据文献选用2-ΔΔCt法计算得知各基因的相对表达量[19],采用SAS9.0软件中的ANOVA程序进行方差分析,均值多重比较采用Duncan法,<0.05为差异显著水平。
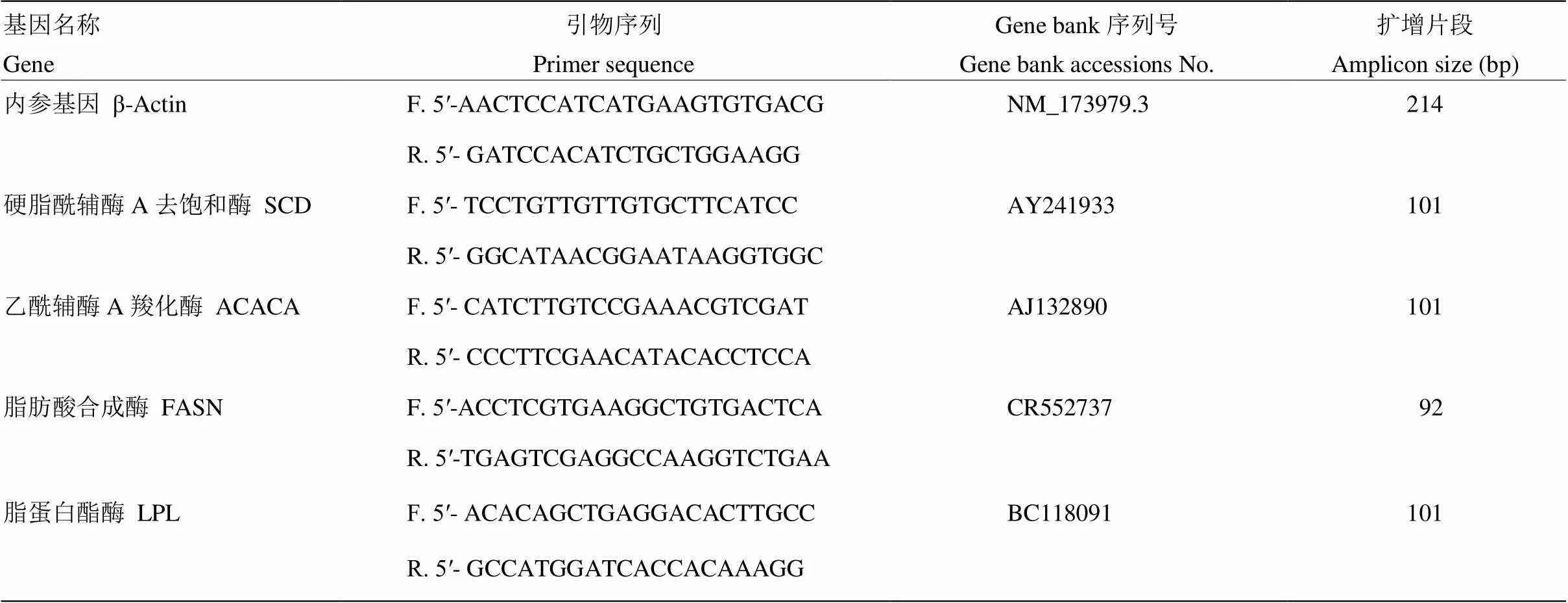
表1 脂肪酸合成相关酶基因的PCR引物序列
2 结果
2.1 乳腺上皮细胞生长曲线
从图1可以看出,在3×104个/mL 的接种密度下,细胞生长曲线呈S型,在1—2d乳腺上皮细胞为潜伏期,3—6d为指数增长期,之后进入平台期,符合一般细胞生长曲线规律,说明培养的乳腺上皮细胞具有正常的增殖能力,可以用于后续的研究。
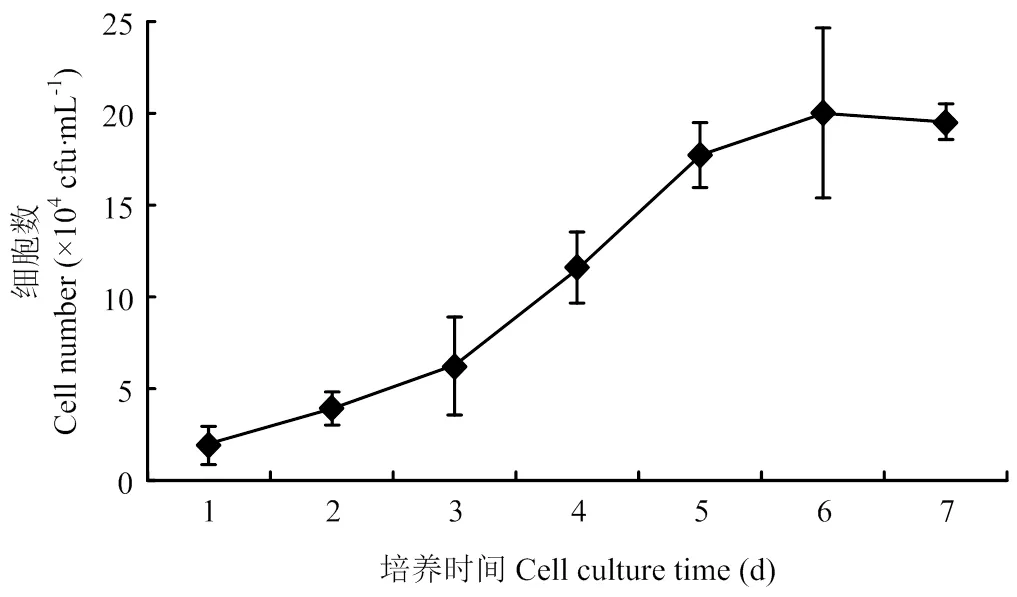
图1 乳腺上皮细胞生长曲线
2.2 不同浓度黄花蒿醇提物对SCD基因表达的影响
从图2可以看出,与对照组相比,添加黄花蒿乙醇提取物有增加SCD酶基因表达量的趋势,其中3 mg·L-1组显著增加了SCD酶的基因表达量(<0.05),而6 mg·L-1组和12mg·L-1组虽然增加了SCD酶的基因表达量,但与对照组相比差异不显著(>0.05)。

图中标注不同小写字母表示差异显著(P<0.05)。下同
2.3 不同浓度黄花蒿醇提物对脂肪酸合成相关基因表达的影响
从图3可以看出,添加黄花蒿乙醇提取物有增加乳腺上皮细胞中ACACA基因表达量的趋势,但与对照组相比差异不显著(>0.05),且随着添加剂量的增加,有下降趋势;添加黄花蒿乙醇提取物可以增加乳腺上皮细胞中FASN基因表达量,呈剂量依赖型增加,且12mg·L-1组可以显著增加乳腺上皮细胞中FASN基因表达量;添加黄花蒿乙醇提取物有降低乳腺上皮细胞中LPL基因表达量的趋势,呈剂量依赖型降低,且6 mg·L-1组和12mg·L-1组显著降低了乳腺上皮细胞中LPL基因表达量(<0.05)。
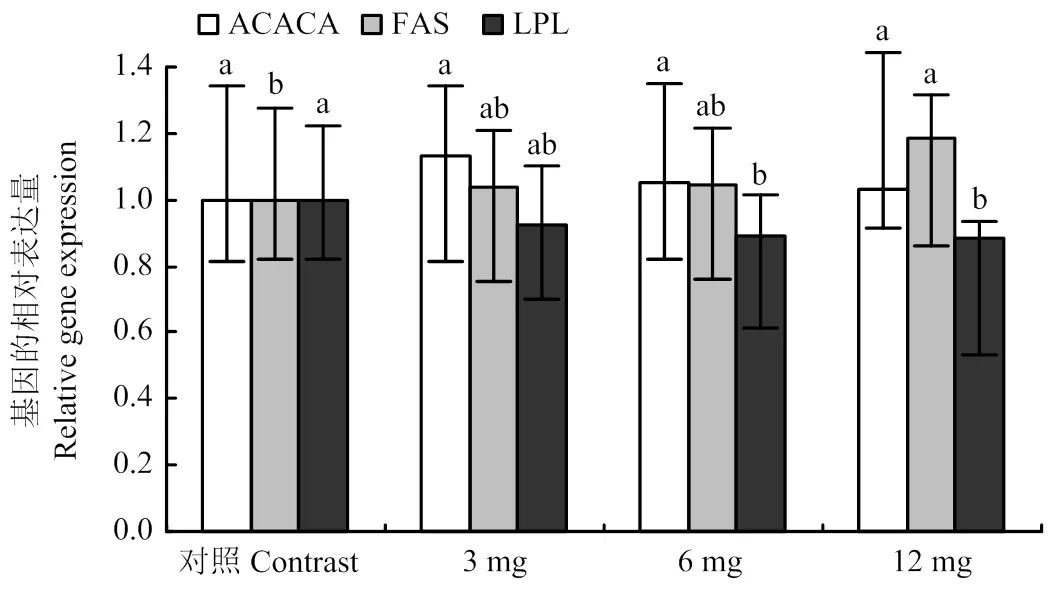
图3 不同浓度黄花蒿醇提物对脂肪酸合成相关酶基因表达的影响
3 讨论
3.1 黄花蒿醇提物对乳腺上皮细胞中SCD基因表达的影响
对于乳腺上皮细胞中SCD基因表达调控的研究多数集中于添加油酸、亚油酸、硬脂酸等游离脂肪酸。李大彪等[20]研究表明,与对照组相比,添加不同浓度亚油酸显著降低了乳腺上皮细胞中SCD酶的基因表达,且呈剂量依赖型下降;王治国等[21]研究表明,棕榈酸、硬脂酸、油酸、亚油酸对SCD基因的表达有抑制作用;YAO等[22]研究报道,亚油酸显著降低SCD1基因的表达;研究报道,奶牛皱胃灌注或静脉注射trans-10,cis-12 CLA可降低乳腺SCD1基因的转录[23-24];关于trans-10,cis-12 CLA对奶山羊SCD基因的影响,有研究报道十二指肠灌注trans-10,cis-12 CLA降低了乳脂肪中反应SCD酶基因的指数[25];上述研究均是关于不饱和脂肪酸对SCD基因的影响,INVERNIZZI等[26]研究报道,饱和长链脂肪酸或乳脂肪抑制剂可诱导牛乳腺组织中SCD1基因转录的持续上调;对于植物提取物影响乳腺中SCD基因表达的研究较少,王丽芳[11]研究报道,黄花蒿乙醇提取物可以降低奶山羊乳腺组织中SCD酶的基因表达。
本研究结果表明,黄花蒿醇提物有增加奶牛乳腺上皮细胞中SCD酶基因表达的趋势,其中低剂量组显著增加了乳腺上皮细胞中SCD酶的基因表达量。本研究结果与上述研究结果的作用机制可能不同,上述研究主要是脂肪酸对SCD酶基因表达的调控,本研究黄花蒿醇提物对SCD酶基因的表达调控可能主要是通过倍半萜类和芳香族类等多种活性成分;本研究结果与黄花蒿乙醇提取物对奶山羊乳腺组织中SCD酶基因表达的研究结果相反[11],原因可能是在研究黄花蒿乙醇提取物对奶山羊乳腺组织中SCD酶基因表达的影响时,奶山羊是活体动物,黄花蒿乙醇提取物进入奶山羊体内后在瘤胃微生物的作用下,经过了代谢转化,到达乳腺组织中的物质已完全不同于黄花蒿乙醇提取物中的活性物质,本研究是直接在乳腺上皮细胞培养液中添加黄花蒿乙醇提取物,对乳腺上皮细胞作用的是黄花蒿乙醇提取物中原始的活性物质,另外,也可能是奶牛和奶山羊属于不同种属的奶畜,因此会存在差异。
3.2 黄花蒿醇提物对乳腺上皮细胞中脂肪酸合成相关酶基因表达的影响
ACACA和FASN是乳腺脂肪酸从头合成的关键酶。首先,ACACA羧基化乙酰辅酶A形成丙二酰辅酶A,然后FASN利用乙酰辅酶A和丙二酰辅酶A合成脂肪酸[27],这两种酶的合成受许多因素的影响。研究报道,热应激会极显著降低ACACA和FASN的合成(<0.01),添加精氨酸和蛋氨酸可以极显著增加FASN的丰度(<0.01),但是对ACACA没有显著影响(>0.05)[28];ZHANG等[29]通过奶山羊乳腺上皮细胞体外培养试验研究表明,高剂量trans-10,cis-12 CLA(200μmol·L-1)和低剂量cis-12 CLA(100μmol·L-1)均显著降低了ACACA的mRNA丰度(<0.05),高剂量trans-10,cis-12 CLA显著降低了FASN的蛋白表达(<0.05);李大彪等[20]研究表明,与对照组相比,添加不同浓度亚油酸显著降低了乳腺上皮细胞中FASN酶的基因表达(<0.05);苏芮等[30]研究表明,添加VA均增加了ACACA和FASN的基因表达。从上述研究结果可以看出,脂肪酸有降低ACACA和FASN基因表达的趋势,氨基酸有增加FASN基因表达的趋势,VA有增加ACACA和FASN基因表达的趋势。本研究结果表明,添加黄花蒿乙醇提取物有增加FASN基因表达的趋势,呈剂量依赖性增加,其中高剂量组(12mg·L-1)显著增加了FASN基因的表达;添加黄花蒿乙醇提取物有增加ACACA基因表达的趋势,但是与对照组差异不显著。本研究结果与添加脂肪酸研究结果不同,可能原因是上述研究主要是脂肪酸对ACACA和FASN酶基因表达的调控,本研究黄花蒿醇提物对ACACA和FASN酶基因的表达调控可能主要是通过倍半萜类和芳香族类等多种活性成分,因此对ACACA和FASN的调控机制不同;本研究结果与VA和氨基酸的作用相似,可能本研究添加的植物提取物中所含有的活性成分结构与氨基酸和VA相似。
LPL是一种参与哺乳动物多种组织中长链脂肪酸LCFA 细胞内转运的重要基因[31],其表达具有组织特异性。胡仕良[32]研究表明,奶山羊脂肪、心脏、肺脏等组织LPL基因的表达水平较高,乳腺组织LPL基因的表达水平较低。LPL mRNA的特异性表达受许多因素的影响,包括日粮、激素和禁食等,其中关于日粮调控LPL基因表达的研究较多。茅慧玲[33]研究表明,添加茶皂素和豆油可以显著增加羔羊肌肉组织中LPL基因mRNA丰度(<0.05),但是对肝脏中LPL基因的表达却没有影响(>0.05);苏芮等[30]研究表明,维生素A 对奶牛乳腺上皮细胞中乳脂合成相关酶LPL活性无显著影响(>0.05);张博綦研究表明[34],LPS引起的奶牛乳腺上皮细胞氧化损伤可降低LPL的基因表达及其酶活性,但是添加硒可以有效减缓这种损伤作用;朱智[35]研究表明,添加不同浓度的大蒜油有增加奶山羊乳腺组织中LPL基因表达的趋势。本研究结果表明,添加黄花蒿醇提物有降低奶牛乳腺上皮细胞中LPL基因表达的趋势,与对照组相比,中高剂量组显著降低了LPL的基因表达(<0.05)。本研究结果与上述研究结果不同,可能原因是本研究所添加的黄花蒿乙醇提取物所含有的活性成分与上述研究所添加的大蒜油等的活性成分不同相关。
4 结论
黄花蒿乙醇提取物可以增加奶牛乳腺上皮细胞中SCD、ACACA和FASN酶基因的表达,有利于调控共轭亚油酸和乳脂肪的生成。
[1] SCHMID A, COLLOMB M, SIEBER R, BEE G. Conjugated linoleic acid in meat and meat products: A review., 2006, 73:29-41.
[2] BAUMAN D E, PERFIELD J W I, HARVATINE K J, BAUMGARD L H.Regulation of fat synthesis by conjugated linoleic acid: lactation and the ruminant model.2008, 138: 403-409.
[3] BENJAMIN S, SPENER F.Conjugated linoleic acids as functional food: An insight into their health benefits.2009, 6:36.
[4] MORAES M L, RIBEIRO A M L, KESSLER A M, LEDUR V S, FISCHER M M, BOCKOR L, GAVA D. Effect of CLA on performance and immune response of weanling piglets., 2012, 90(8):2590-2598.
[5] OLIVEIRA D E, GAMA M A S, FEMANDES D, TEDESCHI L O, BAUMAN D E. An unprotected conjugated linoleic acid supplement decreases milk production and secretion of milk components in grazing dairy ewes., 2012, 95:1437-1446.
[6] DU R, ZHONG T, ZhANG W Q, SONG P, SONG W D, ZHAO Y, WANG C, TANG Y Q, ZHANG X, ZHANG Q. Antitumor effect of iRGD-modified liposomes containing conjugated linoleic acid- paclitaxel (CLA-PTX) on B16-F10 melanoma.2014, 9:3091-3105.
[7] ENGELKE S W, DAS G, DERNO M, TUCHSCHERER A, WIMMERS K, RYCHLIK M, KIENBERGER H, BERG W, KUHLA B, METGES C C. Methane prediction based on individual or groups of milk fatty acids for dairy cows fed rations with or without linseed., 2019,102(2) :1-15.
[8] BAYAT A R, TAPIO I, VILKKI J, SHINGFIELD K J, LESKINEN H. Plant oil supplements reduce methane emissions and improve milk fatty acid composition in dairy cows fed grass silage-based diets without affecting milk yield., 2018, 101(2) :1136-1151.
[9] 王丽芳. 奶牛日粮中添加整粒胡麻籽和棉籽对牛奶品质的影响[D]. 呼和浩特: 内蒙古农业大学, 2005.
WANG L F. Effect of linseed and cottonseed on milk quality in lactating dairy cows[D]. Hohhot: Inner Mongolia Agricultural University, 2005. (in Chinese)
[10] 斯琴毕力格, 王丽芳, 丁赫, 刘旺景, 连海飞, 敖长金. 饲粮中添加黄花蒿乙醇提取物对奶牛产奶性能及乳脂中共轭亚油酸含量的影响. 动物营养学报, 2017, 29(11): 4137-4142.
SI Q B L G, WANG L F, DING H, LIU W J, LIAN H F, AO C J. Effects of dietaryextracts on milk performance and conjugated linoleic acid content in milk fat of lactating cows. Chinese Journal of Animal Nutrition, 2017, 29(11): 4137-4142. (in Chinese)
[11] 王丽芳. 添加菊科植物黄花蒿提取物对奶山羊乳中CLA含量影响及机理研究[D]. 呼和浩特: 内蒙古农业大学, 2010.
WANG L F. The study on effects of compositaeextracts on cla content in goat milk and the relative mechanism[D]. Hohhot: Inner Mongolia Agricultural University, 2010. (in Chinese)
[12] 王丽芳, 卢德勋, 高民. 添加菊科植物黄花蒿乙醇提取物对奶牛乳腺上皮细胞脂肪酸组成的影响. 饲料工业, 2010, 31(19):36-38.
WANG L F, LU D X, GAO M. The effects of compositaeextracts on fatty acid composition of mammary epithelial cells in dairy cows., 2010, 31(19):36-38. (in Chinese)
[13] COLLOMB M, BUTIKOFER U, SIEBER R, JEANGROS B, BOSSET J O. Correlation between fatty acids in cows’ milk fat produced in the Lowlands, Mountains and Highlands of Switzerland and botanical composition of the fodder., 2002, 12(8): 661-666.
[14] CABIDDU A, ADDIS M, PINNA G, SPADA S, FIORI M, SITZIA M, PIRISI A, PIREDDA G, MOLLE G. The inclusion of a daisy plant () in dairy sheep diet. 1: Effect on milk and cheese fatty acid composition with particular reference to C18: 2 cis-9, trans-11., 2006, 101(1): 57-67.
[15] WALLACE R J. Biohydrogenation of fatty acids in the rumen//The 6th Joint Symposium of China-Korea-Japan on Rumen Metabolism and Physiology. 2007, 4.
[16] 王丽芳, 斯琴毕力格, 敖长金. 黄花蒿提取物对奶牛瘤胃发酵指标的影响. 中国农业科学, 2018, 51(23): 4548-4555.
WANG L F, SI Q B L G, AO C J. The Effects ofextracts on the rumen fermentation in dairy cows., 2018, 51(23): 4548-4555. (in Chinese)
[17] 孙攀峰.粗饲料组合对瘤胃发酵及乳脂肪酸组成的影响及其机理研究[D]. 杭州: 浙江大学, 2007.
SUN P F. Effect of Forage Combination on Ruminal Fermentation and Milk Fatty Acids Composition[D].Hangzhou: Zhejiang University, 2007. (in Chinese)
[18] 张兴夫. 不同日粮模式对泌乳奶牛乳腺乳蛋白合成影响的研究[D]. 呼和浩特: 内蒙古农业大学, 2013.
ZHANG X F. Study on effects of different diets on milk protein synthesis in the mammary gland of dairy cows[D]. Hohhot: Inner Mongolia Agricultural University, 2013. (in Chinese)
[19] 塔娜, 李红磊, 侯先志, 考桂兰, 高民, 李大彪. 乙酸钠和β-羟丁酸钠对奶牛乳腺上皮细胞乳脂和乳蛋白合成相关基因表达的影响. 动物营养学报, 2014, 26(6): 1527-1534.
TA N, LI H L, HOU X Z, KAO G L, GAO M, LI D B. Effects of sodium acetate and sodium β-hydroxybutyrate on expressions of genes involved in milk fat and protein synthesis in bovine mammary epithelial cells., 2014, 26(6): 1527-1534. (in Chinese)
[20] 李大彪, 李红磊, 邢媛媛, 于永强, 王卫云, 陈玲, 李平. 亚油酸对奶牛乳腺上皮细胞乳脂肪和乳蛋白合成相关基因表达的影响. 中国细胞生物学报,2016, 38(3): 257-264.
LI D B, LI H L, XING Y Y, YU Y Q, WANG W Y, CHEN L, LI P. Effect of linoleic acid on the expression of genes associated with milk fat and milk protein synthesis of bovine mammary epithelial cells., 2016, 38(3)::257-264.
[21] 王治国. 奶牛乳腺上皮细胞的体外培养及应用[D]. 北京:中国农业科学院,2007.
WANG Z G.culture and application of bovine mammary epithelial cell[D]. Beijing: Chinese Academy of Agricultural Sciences, 2007. (in Chinese)
[22] YAO D W, LUO J, HE Q Y, LI J, WANG H, SHI H B, XU H F, WANG M, LOOR J J. Characterization of the liver X receptor- dependent regulatory mechanism of goat stearoyl-coenzyme A desaturase 1 gene by linoleic acid., 2016, 99(5): 3945-3957.
[23] BAUMGARD L H, MATITASHVILI E, CORL B, DWYER D, BAUMAN D. Trans-10, cis-12 conjugated linoleic acid decreases lipogenic rates and expression of genes involved in milk lipid synthesis in dairy cows., 2002, 85(9): 2155-2163.
[24] GERVAIS R, MCFADDEN J W, LENGI A J, CORL B A, CHOUINARD P Y. Effects of intravenous infusion of trans-10, cis-12 18:2 on mammary lipid metabolism in lactating dairy cows., 2009, 92(10) :5167-5177.
[25] DEANDRADE P V, SCHMIDELY P. Effect of duodenal infusion of trans-10, cis-12-CLA on milk performance and milk fatty acid profile in dairy goats fed high or low concentrate diet in combination with rolled canola seed., 2006, 46(1):31-48.
[26] INVERNIZZI G, THERING B J, MCGUIRE M A, SAVOINI G, LOOR J J. Sustained upregulation of stearoyl-CoA desaturase in bovine mammary tissue with contrasting changes in milk fat synthesis and lipogenic gene networks caused by lipid supplements., 2010, 10(4):561-575.
[27] CHAJÈS V, CAMBOT M, MOREAU K, LENOIR G M, JOULIN V. Acetyl-CoA carboxylase alpha is essential to breast cancer cell survival., 2006, 66(10): 5287-5294.
[28] SALAMA A A K, DUQUE M, WANG L, SHAHZAD K, OLIVERA M, LOOR J J. Enhanced supply of methionine or arginine alters mechanistic target of rapamycin signaling proteins, messenger RNA, and microRNA abundance in heat-stressed bovine mammary epithelial cells., 2019,102(3):1-12.
[29] ZHANG T Y, HUANG J T, TIAN H B, MA Y, CHEN Z, WANG J J, SHI H P, LUO J. Trans-10, cis-12 conjugated linoleic acid alters lipid metabolism of goat mammary epithelial cells by regulation of de novo synthesis and the AMPK signaling pathway., 2018, 101(6):5571-5581.
[30] 苏芮, 刘阳, 闫素梅, 史彬林, 赵艳丽, 石惠宇. 维生素A对奶牛乳腺上皮细胞乳脂和乳蛋白合成相关基因表达的影响. 动物营养学报, 2018, 30(8):3151-3158.
SU R, LIU Y, YAN S M, SHI B L, ZHAO Y L, SHI H Y. Effects of Vitamin A on gene expressions related to milk fat and protein synthesis in bovine mammary epithelial cells., 2018, 30(8): 3151-3158. (in Chinese)
[31] BIONAZ M, LOOR J J. Gene networks driving bovine milk fat synthesis during the lactation cycle., 2008, 9: 366-387.
[32] 胡仕良. 西农萨能奶山羊乳腺上皮细胞LPL基因特征与功能的初步研究[D]. 杨凌: 西北农林科技大学, 2012.
HU S L. Primary characteristics and function study of LPL in epithelial cell in Xinong Saanen dairy goat[D]. Yangling: Northwest A and F University, 2012. (in Chinese)
[33] 茅慧玲. 植物源性物质对生长湖羊瘤胃发酵和肉品质的影响及其作用机理的研究[D]. 杭州: 浙江大学, 2010.
MAO H L. Effects of plants-based materials on growth performance, rumen fermentation and meat quality of growing Hu lambs[D]. Hangzhou: Zhejiang University, 2010. (in Chinese)
[34] 张博綦. 硒对奶牛乳腺上皮细胞内乳脂肪和乳蛋白合成相关基因表达的影响[D]. 呼和浩特: 内蒙古农业大学, 2017.
ZHANG B Q. Effects of selenium on gene expression related to milk fat and protein synthesis in bovine mammary epithelial cells [D]. Hohhot: Inner Mongolia Agricultural University, 2017. (in Chinese)
[35] 朱智. 大蒜油对山羊瘤胃生物氢化、乳脂肪酸组成及乳腺脂肪生成相关基因表达影响的研究[D].南京: 南京农业大学, 2011.
ZHU Z. Effects of garlic oil on ruminal biohydrogenation, milk fatty acid profile and lipogenesis-related gene expression in mammary gland of goats [D]. Nanjing: Nanjing Agricultural University, 2011. (in Chinese)
Effects ofExtracts on CLA Synthesis and Mechanism
WANG LiFang, ZHANG XingFu
(Inner Mongolia Academy of Agricultural and Animal Husbandry Sciences, Hohhot 010031)
【】The effects ofextracts (AAE) on gene SCD, ACACA, FASN and LPL related to CLA and milk fat synthesis in the bovine mammary epithelial cells(BMECs) culturewere studied in this paper. The purpose of this study was to explore the effects of AAE on the part mechanism of effecting CLA synthesis from the mammary.【】We isolated BMEC by using tissue fragments from the mammary gland of a healthy Holstein cows in Mid lactation. The cells used in the experiment were the second generation ones which have been resuscitated. The cells were inoculated into 24-well plates at a density of 3×104cells/mL and cultured at 37℃ in a 5% CO2atmosphere. The cells were counted by trypan blue counting method once a day. The experiment lasted for 7 d to draw the growth curve of the cells with three replicates, and the uncounted groups changed liquid every 2 d. When the cells grew to logarithmic proliferation stage, fresh culture medium was replaced and randomly divided into four groups, and the concentration of AAE in culture medium was 0, 3.0, 6.0, and 12.0 mg·L-1individually for 48 h. The effects of different concentration of AAE on the gene expression of SCD, ACC, FAS and LPL related to fatty acid synthesis were detected. Each treatment was repeated for three times. 【】The results showed as follows: the morphology and the growth curve for the BMECS looked like paving appearance and S-shaped respectively at 3×104cfu/mL. The latent period and the exponential growth period for the BMECS was 1-2 d and 3-6 d, respectively, and then in the plateau stage, which were accorded with the general cells growth curve rule and showed that the cultured mammary epithelial cells had normal proliferation ability as used in the subsequent researches. Compared with the control group, there was the trend that AAE supplementation increased the expression of SCD enzyme gene, 3 mg·L-1group significantly increased the expression of SCD gene (<0.05), while the 6 mg·L-1group and the 12 mg·L-1group increased the expression of SCD gene, but there was no significant difference compared with the control group (>0.05). The addition of AAE increased the expression of ACACA gene in mammary epithelial cells (>0.05). The addition of AAE increased the expression of FASN gene with a dose-dependent manner, the 12mg·L-1group increased the expression of FASN gene significantly (<0.05). There was the trend that AAE supplementation decreased the expression of LPL enzyme gene with a dose-dependent manner, and the 6 mg·L-1group and the 12 mg·L-1group decreased the expression of LPL gene significantly (<0.05). 【】It was concluded that AAE supplementation could increase the expression of SCD, ACACA and FASN genes in BMECS, which was beneficial to CLA synthesis.
extracts; BMECS; SCD; ACACA; FASN; LPL
10.3864/j.issn.0578-1752.2019.18.018

2019-01-24;
2019-08-16
国家自然科学基金(31860663)、内蒙古自治区自然科学基金(2013MS0418)、内蒙古农牧业科学院青年创新基金(2014QNJJM02)
王丽芳,Tel:13848189461;E-mail:wanglifang100008@163.com
(责任编辑 林鉴非)

