2种中草药组方减肥功能的动物试验研究
陶倩 金鑫 刘硕 马思遥 吴松青 吴赟

摘要 [目的]为探讨2种中草药组方的潜在减肥效果,成功构建肥胖大鼠试验模型。[方法]在连续饲养8周后,取肥胖大鼠的肝脏和脂肪组织称重,检测3项血清生化指标和大鼠体内14项肥胖相关因子水平,并将相关结果进行统计学分析。[结果]2种受试样品都能够降低肥胖大鼠的体重和脂肪重量,改善血清中血糖、甘油三酯和胆固醇的水平;降低下丘脑中神经肽Y的水平、肝脏中脂肪酸合成酶的活性、血清中生长激素释放肽、生长激素和胰岛素的浓度;升高下丘脑中瘦素和血清中胰高血糖素样肽-1的浓度。[结论]2种受试样品对肥胖模型大鼠都有一定的减肥作用,有进一步开发成减肥类产品的潜力。
关键词 中草药组方;肥胖模型大鼠;肥胖相关因子;减肥;功能
中图分类号 R285.5文献标识码 A
文章编号 0517-6611(2019)17-0169-05
Abstract [Objective] The research aimed to investigate the potential effects of two formulas of Chinese herbal medicine that offer weight loss,the rat model of obesity induced by highfat diet was established.[Method]After 8 weeks of continuous feeding,the weight of liver and adipose tissues of the obese rats were measured; three serum biochemical indicators and 12 obesityrelated factors in vivo were detected; and the results were analyzed statistically.[Result]Both of the two samples could reduce the body weight and fat weight of obese model rats,and improve the levels of glucose,triglyceride and cholesterol in serum,and decrease the contents of NPY in hypothalamus,FAS in liver,ghrelin,GH,INS in serum,and increase the contents of leptin in hypothalamus and GLP1 in serum.[Conclusion]The two samples have a certain effects of weight loss on the obese model rats,and have the potential to develop weight loss products furtherly.
Key words Formulas of Chinese herbal medicine;Obese rat;Obesityrelated factor;Weight loss;Function
隨着全球经济的蓬勃发展和生活水平的不断提高,人类的日常饮食习惯和活动模式发生了巨大的变化。高能量、高脂肪的食品摄入量在持续的增加。同时工作方式的改变、交通工具的便捷以及城市化进程的不断加剧,这些因素都造成人类运动的缺乏。英国帝国理工学院的一项研究发现,近40年来肥胖人群的数目呈迅速增加的趋势,从1975年的1.05亿增加到2014年的6.41亿。截止到2017年,全球成人肥胖者人数已经超过体重过轻者。中国的肥胖总人数达8 980万人,高居全球第一。此外,儿童和青少年的肥胖问题也正在成为一个极大的隐患[1-2]。肥胖还是导致非传染性疾病的重大风险因素之一,如心血管疾病、糖尿病、肌肉骨骼疾患、某些癌症等,都与肥胖相关[3-4]。因此研究开发出安全有效的减肥药物和保健食品,已经成为一项国际范围的研究热点。该研究通过构建肥胖大鼠的动物模型,考察了2种具有潜在减肥功能的中草药组方对实验大鼠的体重控制效果及其对大鼠体内多种肥胖相关因子的影响。
1 材料与方法
1.1 试验材料
1.1.1 试验样品。样品1为沙棘甘草黑胡椒的提取物,深褐色粉末。样品2为陈皮的超临界萃取物,黄色粉末。
1.1.2 试验动物。
SD大鼠,SPF级,体重180~220 g,购自广州中医药大学实验动物中心(实验动物生产许可证号:SCXK(粤)2013-0034)。大鼠配合维持饲料购自北京华阜康生物科技股份有限公司(生产许可证号:SCXK(京)2014-0008)。高热能饲料(总能量18.59 kJ/g):在大鼠维持饲料中添加15%蔗糖、15%猪油、8%酪蛋白、0.6%磷酸氢钙、0.4%石粉等,基础饲料占60.6%,预混料0.4%,由广东省医学实验动物中心提供。
1.1.3 试剂及药品。血糖(blood glucose,GLU)、总胆固醇(cholesterol,CHOL)、甘油三酯(triglyceride,TG)ELISA检测试剂盒购自中生北控生物科技股份有限公司;神经肽Y(neuropeptide Y,NPY)、胆囊收缩素(cholecystokinin,CCK)、瘦素(leptin)、生长激素释放肽(ghrelin)、脂肪酸合成酶(fatty acid synthase,FAS)、胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)、胰岛素(insulin,INS)、皮质醇(cortisol)、生长激素(somatropin,GH)、肾上腺素(epinephrine,EPI)、三碘甲状腺原氨酸(triiodothyronine,T3)、四碘甲状腺原氨酸(tetraiodothyronine,T4)ELISA检测试剂盒购自上海研谨生物科技有限公司。
1.2 试验方法
1.2.1 剂量设置。具体试验剂量按照体表面积等效系数换算后,设置见表1。其中,样品1组大鼠的给药剂量为0.22 g/kg,按体重换算相当于体重为60 kg的成人日服用量1.3 g的10倍。样品2组大鼠的给药剂量为0.20 g/kg,按体重换算相当于体重为60 kg的成人日服用量1.2 g的10倍。
1.2.2 动物试验方法。
选取体重在180~220 g的健康SD雄性大鼠138只,于屏障系统下大鼠喂饲维持饲料观察2周。适应期结束后按体重随机分成2组:12只大鼠给予维持饲料作为正常对照组(空白对照);126只给予高热量饲料作为模型对照组。每周记录投料量、剩食量,称量体重1次。喂养2周后,将模型对照组的大鼠按体重增重排序,淘汰体重增重较低的肥胖抵抗大鼠,完成。
从模型对照组大鼠中筛选出30只肥胖敏感大鼠,按体重将其再随机分成3组,每组10只大鼠,分别命名为模型对照组(阴性对照)、样品1组和样品2组,均给予高热能饲料,连续饲喂8周。从正常对照组大鼠中也筛选出10只,给予维持饲料,连續饲喂8周。
样品组分别灌胃给予受试样品,各组的具体给药剂量见表1所示。正常对照组和模型对照组给予等量的纯净水,受试样品给药时间8周。每周记录投料量、剩食量,称量体重1次,记录体重值、体重增量、每日摄食量,计算每只大鼠平均摄食总热量(摄食量×每公斤饲料热量)和食物利用率。
末次给药后,称体重,1%戊巴比妥钠(5 mL/kg)麻醉,大鼠行后腔静脉真空负压采血管采集全血5 mL,静置30 min以上,2 000 r/min离心,收集血清-20 ℃保存备用。处死大鼠,解剖取肝脏称重,另取腹腔包括肾周围和睾丸周围脂肪,并称重,计算脂肪/体重的比值。另取大鼠的大脑皮质,下丘脑等组织,-20 ℃冰箱冻存,与大鼠ELISA检测试剂盒配套,酶标仪检测肥胖相关因子;采用全自动生化检测血生化指标,包括总胆固醇、血糖及甘油三酯。将各组结果进行统计学分析处理,比较组间差异性。
1.3 试验数据处理 试验数据均采用Excel软件进行统计学处理,结果以±SD表示,并进行T-test分析,t值法比较组间差异的显著性。
2 结果与分析
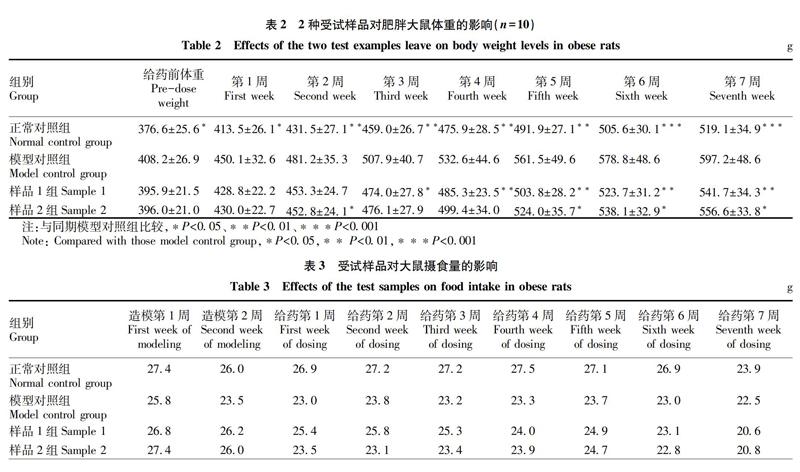
2.1 受试样品对大鼠体重的影响
通过2周时间,成功构建了肥胖大鼠试验模型。此后,开始对4个试验组大鼠的体重进行连续7周的检测。由表2可知,给予高热能饲料的各组大鼠的体重,在给药前无显著性差异,但模型对照组与正常对照组相比具有显著性差异(P<0.05)。给药7周内,与正常对照组相比,模型对照组大鼠的体重明显增加,提示高热能饲料能明显增加大鼠的体重,导致大鼠肥胖。从第5周开始,2个受试样品组均能明显抑制体重的快速增长。该结果表明受试样品对肥胖大鼠的体重都具有一定的抑制增长作用,其中效果较好的是样品1组。
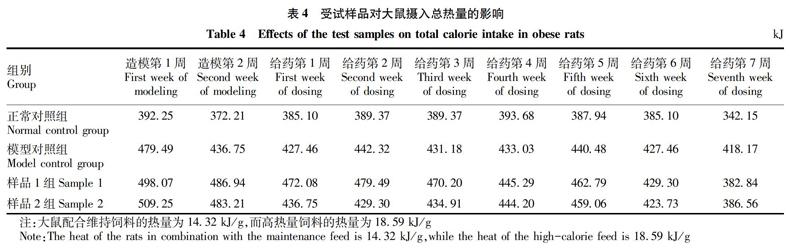
2.2 受试样品对大鼠的摄食量和摄入总热量的影响
从表3~4可看出,在造模前后及给药周期内,2个受试样品组的大鼠的摄食量和摄入总热量随着给药周期的延长略有降低,但与同期模型对照组数据相比,不具有显著性差异,表明受试样品对实验大鼠的摄食量和摄入总热量的影响较小。实验大鼠在整个给药周期内,没有出现腹胀腹痛的典型表现,精神状况良好,摄食饮水行为均正常,表明受试样品具有较好的安全性。
2.3 受试样品对大鼠血清生化指标的影响
在第7周试验结束之后,处死实验大鼠,对其3项血清生化指标(血糖GLU、总胆固醇CHOL、甘油三酯TG)进行检测。由表5可见,由于高热能饲料中添加了15%蔗糖,与正常对照组相比,模型对照组大鼠的GLU水平明显升高,且接近高血糖症的临界值(6.1 mmol/L);与模型对照组相比,样品1组和样品2组大鼠的GLU水平明显降低,并且在大鼠的正常血糖值范围内[5]。以上结果提示,受试样品具有一定程度的调节血糖水平的作用。
此外,高热能饲料中还添加了15%猪油,与正常对照组相比,模型对照组大鼠的CHOL和TG水平明显升高;与模型对照组相比,样品1组和样品2组大鼠的CHOL和TG的水平明显降低。以上结果提示,受试样品可能具有不同程度地改善体内脂质代谢的作用,其中样品2组对CHOL的作用效果较好,样品1组对TG的作用效果较好。
2.4 受试样品对大鼠脏器重量及指数的影响
处死实验大鼠后,解剖取其肝脏和脂肪组织进行称重,并计算脂肪/体重的比值。由表6可见,高热能饲料给予大鼠饲喂造模60 d后,与正常对照组相比,模型对照组大鼠的体重明显升高,肝脏重量和指数、脂肪重量和指数均明显升高,说明大鼠肥胖模型构建成功。2种受试样品都具有不同程度的减脂作用。与模型对照组相比,样品1组和样品2组大鼠的体重、肝脏重量、脂肪重量与指数均明显降低,此结果与各受试样品能够抑制大鼠体重增长的试验结果相吻合。
2.5 受试样品对大鼠体内多种肥胖相关因子的影响
处死实验大鼠后,取其大脑皮质、下丘脑等组织,与相应的ELISA检测试剂盒配套,检测受试样品对大鼠体内多种肥胖相关因子(NPY,下丘脑神经肽;Leptin,下丘脑瘦素;CCK,大脑皮质胆囊收缩素;FAS,肝脏脂肪酸合成酶;Ghrelin,生长激素释放肽;GLP-1,胰高血糖素样肽-1;INS,胰岛素;GH,生长激素;EPI,肾上腺素;Cortisol,皮质醇;T3,血清三碘甲状腺原氨酸;T4,总甲状腺素)[6-8]的影响,具体试验结果见表7。
NPY是由下丘脑弓状核神经元分泌和产生,作为一种食欲促进因子,对机体的摄食活动发挥重要作用[9]。与正常对照组相比,模型对照组大鼠下丘脑NPY含量明显升高;与模型对照组相比,受试样品组大鼠下丘脑NPY含量均有不同程度的降低。此结果显示受试样品具有一定的调节下丘脑神经肽的作用,其中以样品1组的作用效果较好。
Leptin是一种循环激素,可以作用于下丘脑的体重调节中枢,引起食欲降低,能量消耗增加,从而减轻体重[9]。与正常对照组相比,模型对照组大鼠下丘脑Leptin含量明显降低;与模型对照组相比,给予2种受试样品的各剂量组大鼠的Leptin含量均有不同程度的升高,其中样品2组的Leptin含量升高较为明显。
CCK是一种重要的胃肠激素,可以通过诱发中枢饱腹感以及影响胃肠道运动从而减少摄食[10]。与正常对照组相比,模型对照组大鼠脑中CCK含量明显降低;与模型对照组相比,受试样品组的大鼠CCK含量没有显著性变化,表明2种受试样品对大脑皮质的CCK含量没有明显的作用效果。
FAS将碳水化合物合成脂肪酸并以甘油三酯的形式储存,在正常生理状态下其主要受饮食和激素的调节[11]。与正常对照组相比,模型对照组大鼠的FAS活性明显升高;与模型对照组相比,样品1组和样品2组的大鼠肝脏FAS活性均有不同程度的降低,表明2种样品都具有一定的FAS抑制作用。
Ghrelin 是一种来源于胃肠道的内源性肽,它能刺激食欲、增加食物摄入量、增加脂肪含量,引起体重增加,可能参与了肥胖的病理生理机制[12-13]。與正常对照组相比,模型对照组大鼠血清中Ghrelin含量明显升高;与模型对照组相比,样品1组和样品2组的大鼠血清Ghrelin含量均有不同程度的降低。此结果显示2组样品都具有较好地抑制Ghrelin含量的作用,从而减少了实验大鼠的摄食量及摄入总热量,最终减少了脂肪的含量。
GLP-1主要通过刺激胰岛β细胞分泌胰岛素和抑制胰岛α细胞分泌胰高血糖素,从而发挥降糖作用[12-13]。与正常对照组相比,模型对照组大鼠血清GLP-1含量明显降低,提示高热能饲料中的高糖和高脂成分长期大量给予后,可能抑制了GLP-1活性,导致大鼠食欲和体重增加。2个受试样品组中大鼠血清GLP-1的含量均有少量升高,其中样品1组大鼠血清GLP-1的含量与模型对照组相比,升高较为明显。
INS是机体内唯一能降低血糖的激素,其对食欲的调节作用主要是随血液循环通过血脑屏障作用于脑,抑制进食[14]。与正常对照组相比,模型对照组大鼠血清INS含量明显升高,此结果与模型组大鼠血糖浓度明显升高相对应。与模型对照组相比,样品1组和样品2组的大鼠血清INS含量均出现了不同程度的降低,此结果与这几组大鼠血糖浓度比模型组大鼠低的试验结果相对应。
GH具有促进生长、调节代谢的作用[15]。与正常对照组相比,模型对照组大鼠血清GH含量明显升高;与模型对照组相比,各样品组大鼠的血清GH含量均出现明显降低。
EPI的升高,将使机体代谢增加,可能会促进脂肪的分解消耗[6]。与正常对照组相比,模型对照组大鼠血清的EPI含量明显降低。与模型对照组相比,各样品组大鼠的EPI含量略有升高,但无显著性差异。
Cortisol浓度的增加,可导致增加食欲和能量摄入,促进脂肪合成,导致肥胖[16]。与正常对照组相比,模型对照组大鼠血清Cortisol浓度明显升高;与模型对照组相比,样品1组和样品2组的大鼠血清Cortisol浓度有一定的降低,但是没有显著性差异。
甲状腺分泌的主要激素是血清三碘甲状腺原氨酸(T3)以及总甲状腺素(T4),其最重要的是促进生长发育[17-18]。与正常对照组相比,模型对照组大鼠的T3和T4浓度无显著性变化;各受试样品组大鼠血清T3和T4浓度与模型对照组相比,也无明显差异。此结果显示各受试样品对大鼠的甲状腺功能无明显影响。
综合以上结果可见,2种受试样品对肥胖大鼠的作用效果相似,都能够降低肥胖模型大鼠的体重,改善其血清中甘油三酯和胆固醇水平,减少体内脂肪重量及脂肪指数;降低下丘脑NPY的含量、肝脏FAS活性、血清中Ghrelin、GH和INS的含量;升高下丘脑Leptin含量和血清GLP-1含量;但对大脑皮质中CCK含量、血清中肾上腺素EPI、Cortisol、甲状腺素T3和T4的影响较小。
3 结论与讨论
通过成功构建肥胖大鼠动物模型,对2种中草药组方样品的潜在减肥效果进行了初步研究。2种样品对于受试大鼠的摄食量和摄入总热量与模型对照组相比并无明显影响,但受试大鼠的体重和体内脂肪重量都明显下降。这提示受试样品的潜在减肥机理可能与大鼠的脂肪代谢相关。在摄食量不变的情况下,通过加强体内的脂肪代谢,从而实现体重的减轻。
瘦素Leptin和NPY 是体内2种调节能量代谢、控制食欲、维持体重平衡的肽类物质[19]。其中Leptin是由肥胖基因(obesity genes)受神经-内分泌系统和体内能量代谢的反馈调节而表达。Leptin由脂肪组织分泌后,进入到血液循环中,参与机体摄食、能量代谢、体重平衡的调节。NPY 是在1982 年首次从猪脑中提取的一种含36个氨基酸的单链多肽,它主要参与摄食行为的启动与维持,是下丘脑中重要的食欲促进因子。下丘脑组织中的Leptin和NPY相互作用,构成了调节体内脂肪储积和消耗的环路。该研究结果也显示,与模型对照组(阴性对照)相比,受试样品组大鼠下丘脑中的Leptin含量升高,而NPY含量则降低。由于受试大鼠的摄食量在整个试验过程中并未出现明显变化,因此Leptin和NPY的含量发生变化后,应该是通过调节脂肪代谢,最终导致受试大鼠的体重减轻。
生长激素释放肽Ghrelin主要由胃组织的X/A细胞分泌,具有增加食欲、促进生长激素分泌、改善线粒体功能、调节胃肠运动及免疫等作用[20];体内的多种激素包括INS、生长抑素、生长激素、催产素、胰高血糖素、胃泌素抑制肽、胆囊收缩素、Leptin等均对血浆Ghrelin 水平产生影响[21]。而胰高血糖素样肽-1(GLP-1)是由末端回肠L 细胞分泌的一种多肽性激素,主要通过调节胰岛素和胰高血糖素的浓度来实现降糖作用[22]。GLP-1和Ghrelin对于机体的糖代谢和胰岛素分泌存在一定的拮抗作用。该研究结果显示,与正常对照组相比,模型组大鼠的Ghrelin含量明显升高,GLP-1含量则明显降低;而在服用了受试样品后,各样品组的Ghrelin含量有不同程度的下降,GLP-1含量则明显回升。此结果与Leptin和NPY在大鼠血清中的检测结果类似。因此GLP-1和Ghrelin的拮抗作用可能是通过调节体内糖代谢,最终影响大鼠的体重。
脂肪酸合成酶FAS是生物体内催化乙酰辅酶A和丙二酰辅酶A合成内源性长链脂肪酸的关键酶,主要在肝、肾、脑、肺、乳腺及脂肪组织中表达,它将碳水化合物合成脂肪酸并以甘油三酯的形式儲存[23]。FAS在正常生理状态下主要受饮食和激素的调节,而脂肪酸合成酶抑制剂则通过抑制脂肪酸合成酶的活性来抑制脂肪酸的合成,从而起到降低体重的作用。该研究结果显示,模型对照组大鼠FAS含量明显升高,说明通过高热能饲料的喂养,可以有效地增加大鼠体重。各受试样品组肝脏中的FAS含量,与模型对照组相比,均有不同程度的降低;这也与样品组大鼠的体重和脂肪重量相比模型组大鼠降低的试验结果相吻合。
胰岛素INS是由胰脏内的胰岛β细胞受内源性或外源性物质如葡萄糖、乳糖、核糖、精氨酸、胰高血糖素等的刺激而分泌的一种蛋白质激素,是机体内唯一降低血糖的激素[24]。该研究结果中,大鼠血清中的INS浓度与血糖浓度是相对应的。在血糖浓度较高时,机体通过分泌更多的INS来实现降低血糖的目的。受试样品通过调节脂肪和糖代谢,降低了血糖浓度,从而也反馈性地降低了INS浓度。
人体的肥胖病症是多种基因和相关作用因子异常表达、共同作用的结果。在该研究中,虽然几种受试样品对于大鼠血清中12种肥胖相关因子的含量的影响不一,但是初步的试验结果显示这些样品都表现出了一定的减轻体重功能,有良好的应用价值和市场前景,值得进一步更深入的研究。
参考文献
[1] NCD Risk Factor Collaboration (NCDRisC).Trends in adult bodymass index in 200 countries from 1975 to 2014:A pooled analysis of 1698 populationbased measurement studies with 19·2 million participants[J].Lancet,2016,387(10026):1377-1396.
[2] NCD Risk Factor Collaboration (NCDRisC).Worldwide trends in bodymass index,underweight,overweight,and obesity from 1975 to 2016:A pooled analysis of 2416 populationbased measurement studies in 128·9 million children,adolescents,and adults[J].Lancet,2017,390(10113):2627-2642.
[3] 郑红星,相辉,张志健,等.杜仲叶提取物减肥功能评价[J].食品研究与开发,2016,37(13):169-172.
[4] 白晓丽,李长文,凌芳,等.某种保健食品减肥功能的动物实验研究[J].保健医学研究与实践,2014,11(4):17-18,21.
[5] 王竹,杨月欣,向雪松,等.实验大鼠血糖正常范围的估算[J].卫生研究,2010,39(2):133-137.
[6] 雷帆,邢东明,孙虹,等.肥胖相关生物因子的研究[J].中国药学杂志,2002,37(1):5-8.
[7] 尚明夏,杨娇娇,张韵,等.肥胖状态下的内分泌功能[J].现代生物医学进展,2013,13(6):1168-1171.
[8] 孙晓宇,郭汝涛,张洪涛,等.胃肠激素与肥胖关系的研究进展[J].现代生物医学进展,2015,15(14):2786-2789.
[9] 何仁胜,方春华,常城,等.针刺对肥胖大鼠血中瘦素、神经肽Y表达的影响[J].中国中医急症,2013,22(2):255-256.
[10] 魏立民,任路平,李海英,等.八肽胆囊收缩素对肥胖大鼠血脂、胰岛素抵抗及腹内脂肪的影响[J].中国现代医学杂志,2015,25(26):33-36.
[11] 刘姚,陈婷婷,傅凌韵,等.青钱柳多糖对高脂血症小鼠脂肪酸合成酶(FAS)表达影响[J].江西农业大学学报,2013,35(2):392-397.
[12] 严玲玲,朱占永,吴丹,等.改良胃袖状切除对肥胖大鼠ghrelin及胰高血糖素样肽-1水平的影响[J].中国普外基础与临床杂志,2011,18(5):498-502.
[13] 王一凡,王强,张伟,等.胃饥饿素通过cAMP/PKA通路对胰高血糖素样肽1促胰岛素分泌功能的影响[J].第二军医大学学报,2017,38(5):679-682.
[14] 徐姝迪,郑玉建,丁红,等.高脂饲料诱导肥胖及肥胖抵抗大鼠的瘦素、胰岛素水平[J].中国妇幼保健,2011,26(17):2666-2668.
[15] 王慧,于立君.儿童肥胖症与生长激素、甲状腺激素关系的研究进展[J].疑难病杂志,2015,14(12):1316-1319.
[16] 曲建梅,王晓梅.糖尿病患者高血糖与皮质醇分泌状况的关系[J].中国卫生产业,2013(18):80,82.
[17] 孙文早,王亮,黄晶,等.甲状腺功能对肥胖人群代谢异常的评估价值[J].安徽医药,2015,19(1):102-103.
[18] 薛君.甲状腺功能与肥胖人群代谢综合征的评价分析[J].中国卫生标准管理,2017,8(18):3-4.
[19] 杨新玲,李杰,卢素玉,等.瘦素-下丘脑神经肽Y轴在2型糖尿病大鼠发病过程中的变化[J].中国全科医学,2014,17(36):4329-4332.
[20] MLLER T D,NOGUEIRAS R,ANDERMANN M L,et al.Ghrelin[J].Mol Metab,2015,4(6):437-460.
[21] IWAKURA H,KANGAWA K,NAKAO K,et al.The regulation of circulating ghrelinwith recent updates from cellbased assays[J].Endocrine journal,2015,62(2):107-122.
[22] 杜莉,卢顺娇,王英超,等.胰高血糖素样肽-1生物学功能的研究进展[J].生物化工,2017,3(6):97-98.
[23] 张芮,陈斯钰.脂肪酸合成酶(FAS)的研究综述[J].农村经济与科技,2018,29(13):103-105.
[24] 孙丰卉,王秋虹,邱宗林,等.中医药治疗2型糖尿病胰岛素抵抗的机制研究进展[J].医学综述,2018,24(20):4068-4072

