药物性胆管消失综合征45例临床病理特点及预后分析
叶立红,王翀奎,赵亮亮,唐亚芳,刘志权,张海丛,刘文宗
药物性肝损伤(drug-induced liver injury,DILI)在我国发生率逐年升高,是临床引起胆汁淤积的主要原因之一。药物引起的淤胆既可以发生于毛细胆管,也可以发生于各级胆管水平,因药物或其代谢产物导致的各级胆管(特别是小叶间胆管)损伤持续进展时可演变为药物性胆管消失综合征(drug-vanishing bile duct syndrome,D-VBDS)。随着化学药物、生物制剂、中草药、天然药、保健品等广泛应用,使得DVBDS的发生并不罕见,但临床医生对D-VBDS认识不够,使得该病在临床诊疗中时常被忽视或误诊,特别是目前通过临床及血清学指标均不能明确是否存在D-VBDS,病理组织学诊断依然是诊断D-VBDS的金标准。国内外有关报道多以某一类药物引起DVBDS的分析研究为主,而结合预后转归对病人临床资料、实验室检查及病理学特点进行研究的相关报道很少。因此,本研究通过回顾性收集经肝穿病理明确诊断为D-VBDS的45例病人临床病理资料,根据预后转归不同从性别构成、发病年龄、用药史、生化特点、病理形态学特点等方面进行对比分析,探讨与D-VBDS病人预后相关的临床病理特征。
1 资料与方法
1.1一般资料本研究采用回顾性研究方法,收集2003年1月至2017年12月石家庄市第五医院经肝穿组织病理明确诊断为D-VBDS并有详细肝生化学指标的45例病人,根据再次追踪随访的肝生化指标及临床症状体征情况,将45例病人分为预后好组及预后差组,其中预后好组31例(68.9.%),肝生化指标为仅有碱性磷酸酶(ALP)、γ-谷氨酰转移酶(GGT)升高,或肝功能完全恢复正常,无阳性症状体征;预后差组14例(31.1%),除ALP、GGT依然升高外,丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、总胆红素(TBil)、直接胆红素(DBil)、总胆汁酸(TBA)、总胆固醇(TC)、三酰甘油(TG)不同程度的升高,胆碱酯酶(CHE)、白蛋白(ALB)降低,并有相应的临床症状体征[1]。所有病人均有明确用药史,并排除原发性胆汁性胆管炎、原发性硬化性胆管炎、胆管不全梗阻、乙醇性肝病、脂肪性肝炎、嗜肝及非嗜肝病毒感染及遗传代谢性疾病等。病人或其近亲属对所受治疗知情同意,本研究方案经石家庄市第五医院伦理委员会审批(批号SWY070915)同意。
1.2观察指标详细收集所有入选病例的一般资料(发病年龄、性别)、用药史、历次血清学指标(包括肝生化指标、血常规、病毒标志物、自身抗体)等数据资料,病理诊断由1名经验丰富的病理医生独立进行,并对病理形态学特点进行半定量评分[2]。将收集的数据资料建立详细数据库。
1.3肝穿刺活体组织检查及VBDS诊断标准在超声引导下经皮肝穿刺活组织取材,肝穿刺标本长度>1.5 cm,即刻放入10%甲醛溶液固定,常规脱水、浸蜡包埋,进行厚度为4 μm连续切片。所有标本均依次进行苏木精—伊红(HE)染色、网状纤维+Masson染色、淀粉酶消化过碘酸希夫法染色(D-PAS)、细胞角蛋白7/19(CK7/CK19)免疫组织化学染色。
VBDS诊断标准为每条肝穿组织至少包括10个汇管区,并且>50%的汇管区内缺乏小叶间胆管。
1.4统计学方法统计处理采用SPSS 19.0进行分析,计量资料以±s表示,组间比较采用成组t检验,计数资料采用Pearsonχ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1两组在性别及发病年龄构成比较预后好组31例,其中女性22例(71%),男性9例(29%),发病年龄范围为29~69岁,发病年龄(42.6±11.9)岁。预后差组14例,其中女性11例(78.6%),男性3例(21.4%),发病年龄范围为30~71岁,发病年龄(43.1±12.7)岁。两组在性别构成(χ2=0.106,P=0.745)及发病年龄(t=2.988,P=0.394)比较,均差异无统计学意义(P>0.05)。
2.2D-VBDS病人45例引起肝损伤药物的种类本研究中引起D-VBDS的药物种类较多,其中以服用中草药(包括中药汤剂和中成药)最常见,共有23例,占51.1%,主要包括治疗骨关节病、风湿性关节炎、椎间盘膨出、镇静安神、皮肤病等中药,位于第2位的药物是阿奇霉素,共有5例,占11.1%,位于第3位的药物是解热镇痛药,共有4例,占9.0%,其它药物包括抗过敏药物、抗生素、激素类、降压药、保健品及化学接触等。
2.3两组肝生化各指标高峰值对比及自身抗体情况收集两组病人历次肝生化学指标,对比分析各指标高峰值水平显示,预后差组TBil、DBil、TBA、TC、球蛋白(GLB)水平明显高于预后好组,ALB、CHE水平明显低于预后好组,差异有统计学意义(P<0.05),其他肝生化指标ALT、AST、ALP、GGT、ALB、TG高峰值在两组之间比较,均差异无统计学意义(P>0.05),统计结果见表1。
两组自身抗体情况显示,抗线粒体(AMA)抗体阳性在预后好组中3例(10.3%),预后差组中4例(28.6%);抗核(ANA)抗体阳性在预后好组中10例(34.5%),预后差组7例(50%);抗干燥综合征抗原A(SSA)/52kd及抗gp210抗体在预后好组均为2例(6.9%),预后差组均为1例(7.1%)。此外预后差组1例抗肝/肾微粒体(SMD1)抗体弱阳性,1例抗着丝点蛋白B抗体阳性,预后好组1例核糖核蛋白/Sm抗体阳性。
2.4病理形态学特点及预后转归情况在31例预后好组中,9例病人肝穿时病变即较轻或已基本恢复,随访病程分别为2年、3年、3年、4年、5年、7年、7年、8年及11年,表现为小胆管损伤缺失的汇管区为终末或小汇管区,汇管区内炎症及纤维增生均不明显,肝小叶结构尚好,未见明显炎症坏死及毛细胆管淤胆。22例病人肝穿时形态学表现为轻度慢性淤胆改变,随访病程为半年至13年,表现为小胆管损伤缺失的汇管区亦为终末或小汇管区,汇管区炎症轻,有或无轻度细胆管增生、轻度早期胆盐淤积(表现为肝细胞呈CK7阳性表达)、轻度胆盐淤积(肝细胞肿胀或Mallary小体形成),其中8例病人肝小叶内可见到少量毛细胆管胆栓及泡沫样细胞,7例病人见淤胆性菊形团。在14例预后差组中,5例病人肝穿时已形成胆汁性肝硬化,随访病程分别为2年、3.5年、4.5年、4.5年及5.5年,病理形态表现为胆管消失的汇管区纤维化扩大相连,不规则分隔肝实质,致小叶结构紊乱,细胆管明显增生,肝小叶内均可见明显的毛细胆管淤胆,临床表现为一系列门脉高压症状及体征,其中2例死于肝衰竭,1例进行了肝移植;9例病人肝穿时形态学表现为明显慢性淤胆改变,随访病程为1年半至5年半,病理形态表现为损伤消失的汇管区多为中等大的汇管区,汇管区炎症重,胆管消失的汇管区周围肝细胞明显肿胀、Mallary小体形成,严重者可见铜或铜结合蛋白沉积,呈明显慢性胆盐淤积改变,伴程度不一的细胆管增生及轻至中度胆汁性肝纤维化。14例病人均可见程度不一的毛细胆管胆栓,9例病人可见泡沫样细胞,7例病人可见淤胆性菊形团。通过对比两组病理形态评分显示,汇管区炎症和纤维化、胆盐淤积,细胆管增生及毛细胆管淤胆评分在两组之间比较差异有统计学意义(P<0.05),为与预后相关的病理形态学特点,统计结果见表2,3。
表1 药物性胆管消失综合征45例中预后好组与预后差组肝生化指标高峰值比较/±s
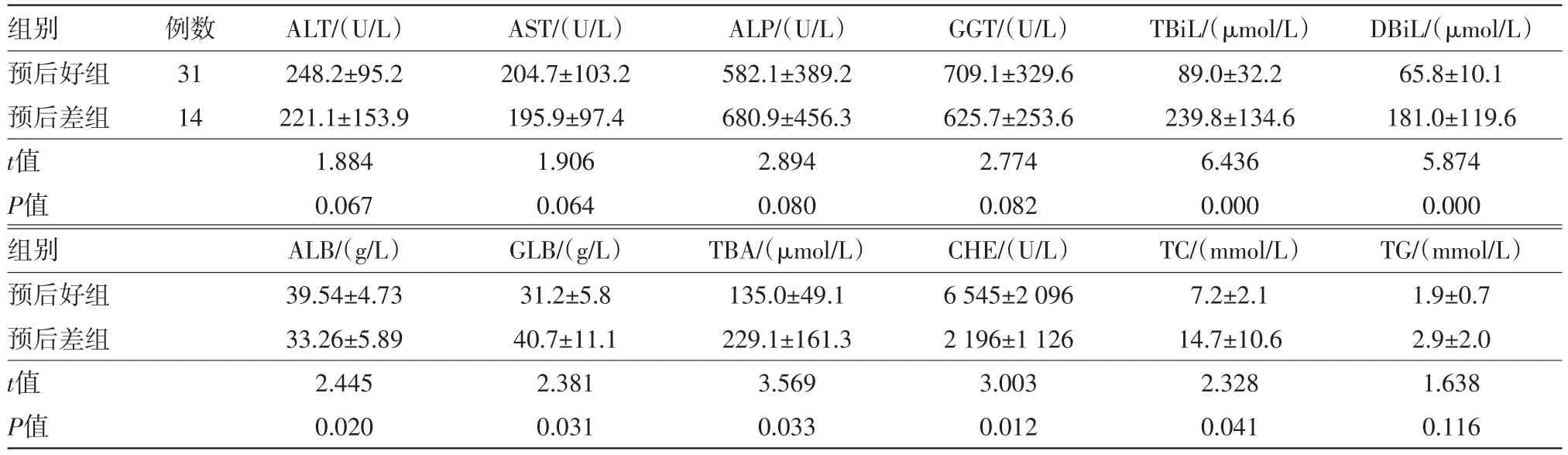
表1 药物性胆管消失综合征45例中预后好组与预后差组肝生化指标高峰值比较/±s
注:ALT为丙氨酸氨基转移酶,AST为天门冬氨酸氨基转移酶,ALP为碱性磷酸酶,GGT为γ-谷氨酰转移酶,TBil为总胆红素,DBil为直接胆红素,ALB为白蛋白,GLB为球蛋白,TBA为总胆汁酸,CHE为胆碱酯酶,TC为总胆固醇,TG为三酰甘油
组别预后好组预后差组t值P值组别预后好组预后差组t值P值例数31 14 ALT/(U/L)248.2±95.2 221.1±153.9 1.884 0.067 ALB/(g/L)39.54±4.73 33.26±5.89 2.445 0.020 AST/(U/L)204.7±103.2 195.9±97.4 1.906 0.064 GLB/(g/L)31.2±5.8 40.7±11.1 2.381 0.031 ALP/(U/L)582.1±389.2 680.9±456.3 2.894 0.080 TBA/(μmol/L)135.0±49.1 229.1±161.3 3.569 0.033 GGT/(U/L)709.1±329.6 625.7±253.6 2.774 0.082 CHE/(U/L)6 545±2 096 2 196±1 126 3.003 0.012 TBiL/(μmol/L)89.0±32.2 239.8±134.6 6.436 0.000 TC/(mmol/L)7.2±2.1 14.7±10.6 2.328 0.041 DBiL/(μmol/L)65.8±10.1 181.0±119.6 5.874 0.000 TG/(mmol/L)1.9±0.7 2.9±2.0 1.638 0.116
表2 药物性胆管消失综合征45例中预后好组与预后差组病理形态评分比较/(分,±s)
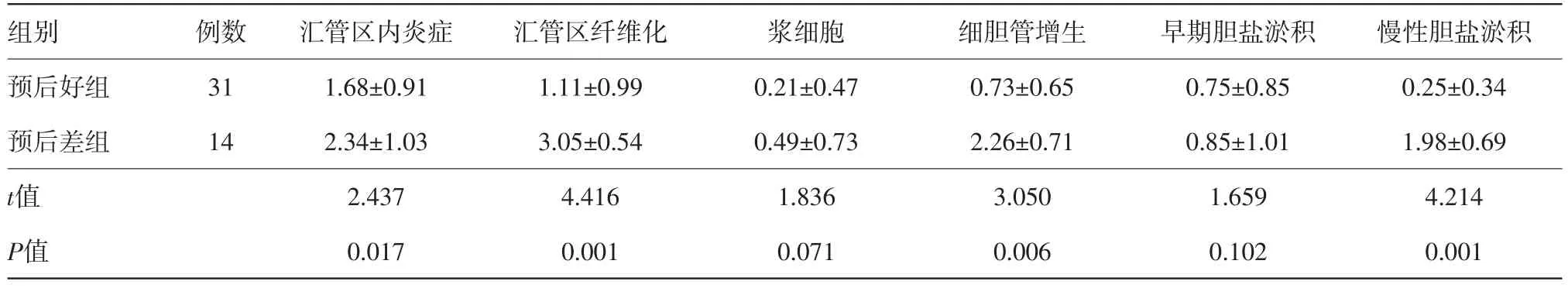
表2 药物性胆管消失综合征45例中预后好组与预后差组病理形态评分比较/(分,±s)
组别预后好组预后差组t值P值例数31 14汇管区内炎症1.68±0.91 2.34±1.03 2.437 0.017汇管区纤维化1.11±0.99 3.05±0.54 4.416 0.001浆细胞0.21±0.47 0.49±0.73 1.836 0.071细胆管增生0.73±0.65 2.26±0.71 3.050 0.006早期胆盐淤积0.75±0.85 0.85±1.01 1.659 0.102慢性胆盐淤积0.25±0.34 1.98±0.69 4.214 0.001
表3 药物性胆管消失综合征45例中预后好组与预后差病理形态评分比较/(分,±s)
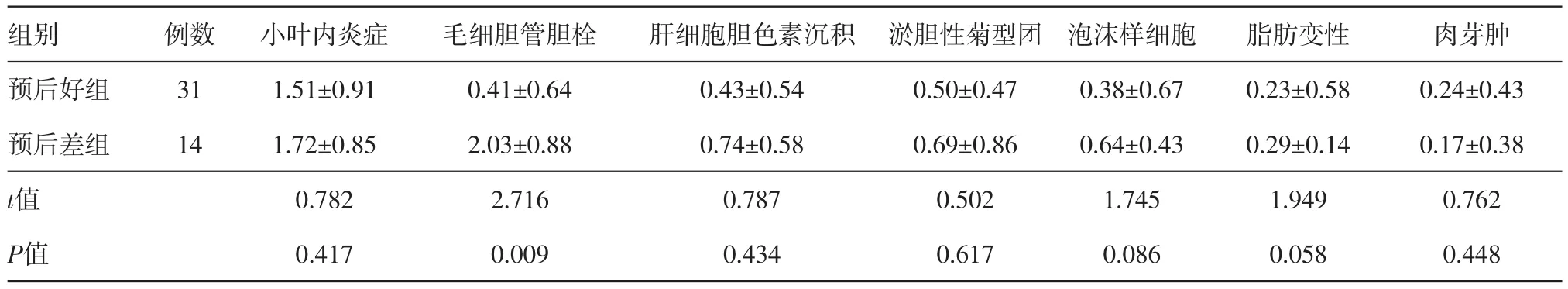
表3 药物性胆管消失综合征45例中预后好组与预后差病理形态评分比较/(分,±s)
组别预后好组预后差组t值P值例数31 14小叶内炎症1.51±0.91 1.72±0.85 0.782 0.417毛细胆管胆栓0.41±0.64 2.03±0.88 2.716 0.009肝细胞胆色素沉积0.43±0.54 0.74±0.58 0.787 0.434淤胆性菊型团0.50±0.47 0.69±0.86 0.502 0.617泡沫样细胞0.38±0.67 0.64±0.43 1.745 0.086脂肪变性0.23±0.58 0.29±0.14 1.949 0.058肉芽肿0.24±0.43 0.17±0.38 0.762 0.448
3 讨论
VBDS并非一种独立性疾病,而是由于多种因素引起的肝内部分胆管树持续进行性破坏后出现的一种病理形态特征,当小胆管缺乏>50%时定义为VBDS[3]。其中药物因素已成为继原发性胆汁性胆管炎(PBC)之外引起VBDS的另一重要诱发因素。大多数药物诱发的胆管消失是一个逐渐发展的过程,为病程早期阶段急性胆管炎损伤持续进展的结果。药物或其代谢产物可以损伤肝内不同级别的胆管,临床上常呈现出不同的胆汁淤积症状及肝生化改变。但由于药物优先影响肝内胆管树的最小分支(直径<30 μm胆管支)[4],因此D-VBDS常主要发生在一些小汇管区或终末汇管区[5],肝实质内有或无胆汁淤积。研究表明,DVBDS根据胆管损伤消失级别和严重程度可出现两种结局:当药物只损伤较小级别胆管时,肝功能多保留,肝生化和胆汁淤积可逐渐代偿改善甚至恢复正常;当药物损伤较大级别胆管时,可导致肝脏长期慢性淤胆及胆汁性肝纤维化,甚至进展为胆汁性肝硬化和肝衰竭[6-7]。其中以前一种情况更为常见。
已有多种药物被报道是以胆管上皮为损伤靶点,从而诱发胆管损伤、消失的[8-9]。克罗地亚萨格勒布大学医院中心报道1例应用阿奇霉素后导致DVBDS的病人,于发病后7个月进行肝移植[10]。Bessone F等[11]报道1例应用氯丙嗪治疗后出现PBC样临床症状,持续22月黄疸并应用熊去氧胆酸后黄疸消退,但慢性淤胆及低水平的炎症活动仍然存在,经3次肝穿活检证实为VBDS,并最终发展为胆汁性肝硬化。但本研究显示,中药及中成药是引起D-VBDS最主要的药物(53.3%),特别是用药时间较长的病人所占比例较高,考虑由于长期药物的慢性蓄积对胆管造成持续损伤增加了VBDS发生率,也与我国应用中药及中成药的情况比国外多见有关。位于第2位的阿奇霉素及第3位的解热镇痛药为临床常用药,应提高临床医生对应用这些药物可能引起D-VBDS的警惕性,特别是用药后出现ALP、GGT水平的持续升高。两组在性别构成上均是女性明显多于男性,大多数研究表明,女性是发生DILI的高危人群,特别是由中草药和膳食补充剂引起的,并且更多进展为胆汁淤积性肝损伤[12]。可能由于女性对药物的敏感性高于男性,或者由于男性肝微粒体内的药酶活性高于女性所致[13]。此外,两组的发病年龄均在40~60岁之间(P>0.05)。研究认为高龄是DILI的一项重要易感因素[14],与药物代谢酶细胞色素P450活性降低、药物清除率下降、基础性疾病、服药种类多或长期服药等多种因素有关[15],从而增加DILI发生的风险。
本研究通过对比两组肝生化指标峰值显示,TBil、TBA及TC水平在两组间差异有统计学意义(P<0.05)。TBil、TBA、TC为胆汁重要组成成分,预后差组由于胆管损伤消失严重且广泛,则明显影响胆汁中胆红素(TBil)、胆汁酸盐(TBA)、胆固醇(TC)等有机溶质代谢。且部分预后好组病人病程中可以无黄疸(TBil正常),或病程初期有黄疸,但随病变恢复而逐渐下降。预后差组均有黄疸,特别是病程中TBil水平持续升高,往往预示病变进展,预后差。而反映胆管损伤的胆管酶ALP、GGT的水平与预后无相关性(P>0.05)。特别是预后差组病人病程后期明显淤胆,TBil、TBA、TC持续升高,但ALP、GGT水平却逐渐下降,ALP及GGT的下降不代表胆管损伤恢复,反而提示病变进一步加重。考虑由于广泛胆管消失及明显增生的纤维组织取代肝实质,使产生分泌ALP及GGT的胆管及肝细胞明显减少所致。因此对于既往明显ALP及GGT升高,当TBLI、TBA逐渐升高,而ALP及GGT水平却逐渐下降时,往往提示病变加速进展,预后差。预后差组球蛋白水平明显高于预后好组,提示免疫介导机制的参与可能加重胆管损伤、消失及长期淤胆的程度。此外,两组中部分病人均可见不同抗体一过性阳性表达,但多逐渐阴转,亦提示胆管损伤过程中有免疫反应的存在。此外,反应肝脏储备及合成功能的CHE及ALB水平在判断预后方面也具有临床意义。
本研究中通过对比两组病理形态学特点显示,31例预后好组病人病理改变显示为终末及小汇管区内胆管消失,由于消失的小胆管及终末小胆管对整个胆汁排流的影响较少,胆汁可通过其他胆管代偿排流,即使有轻度的胆盐淤积及轻度纤维化,但随着其它胆管支的代偿及导流,胆盐淤积可逐渐改善或长期存在,并不影响整个肝脏的功能[16]。表明胆管消失级别较小的D-VBDS病人随着病变逐渐恢复而临床恢复,预后较好。预后差组14例病人中,有5例肝穿时即为胆汁性肝硬化,9例病人病理形态为较严重的慢性淤胆改变及中-重度胆汁性肝纤维化,均提示损伤了较大级别的胆管以及胆管消失范围广泛。此外,毛细胆管淤胆发生率及严重程度均高于预后好组的病人,特别是病程后期毛细胆管淤胆更加明显。其中,汇管区炎症和纤维化程度、胆盐淤积程度、细胆管增生程度及毛细胆管淤胆程度在两组之间比较差异有统计学意义,为与预后相关的病理形态学特点。考虑是由于胆管消失的汇管区内炎症越重,触发纤维组织增生越明显,同时由于胆管损伤消失,造成胆盐排泄障碍,继发性引起细胆管代偿性增生,形成伴有较多中性粒细胞浸润的细胆管性界面炎[17],进一步促进纤维组织增生,加重毛细胆管淤胆。
综上所述,D-VBDS的发生以40~60岁的中年女性多见,中药及中成药是引起D-VBDS最主要的药物,约2/3 D-VBDS病人预后较好,1/3 D-VBDS病人预后较差。影响其预后的因素与胆管损伤的级别、范围、胆管再生修复状况等因素有关。血清TBil、DBil、TBA、TC、GLB水平的持续升高及ALB、CHE水平持续降低可作为预测预后的肝生化学指标。肝组织中汇管区炎症和纤维化程度、胆盐淤积程度、细胆管增生程度及毛细胆管淤胆程度为与预后相关的病理形态学特点,肝穿组织病理仍是明确诊断及判断预后的金标准。

