激素冲击联合血浆置换治疗对ANCA相关性血管炎患者血清CECs、vWF、ES、VCAM-1水平的影响
李思吟
(绵阳市中心医院风湿免疫科,四川 绵阳 621000)
抗中性粒细胞胞质抗体(anti-neutrophil cytoplasmic autoantibody,ANCA)相关性血管炎(ANCA-associated vasculitis,AAV)属于少见系统性小血管炎之一[1-2],多见于中老年人,死亡率和残疾率极高。在我国,AAV的类型多以显微镜下多血管炎( microscopic polyangiitis,MPA )为主。该疾病发病时全身多个系统均可受到累及,其中肾脏累及率可达80%以上[3],多合并为急性肾小球肾炎,严重者可出现不可逆性肾损伤,这也是AAV较为严重的危害性并发症[4-5]。早发现、早诊断和积极应对治疗是延缓患者生命的重要因素。目前,对该病的预防及诊断主要通过ANCA指标[6]的监测,激素联合环磷酰胺(CTX)是临床上治疗的常见诱导方案[7]。近年来,AAV合并肾损伤的相关分子机制以及标志物引起了越来越多的医学专家的关注。内皮损伤已成为临床诊断AAV的重要病理特征[6],也是引发肾小球血管损伤的重要因素。有研究[8]报道,血浆置换(plasma exchange,PE)对于肾功能已受损严重的患者疗效较好。但关于激素冲击联合血浆置换治疗AAV报道尚不多见。本研究通过回顾性分析绵阳市中心医院既往五年的AAV的病例资料,探究激素冲击联合血浆置换治疗对ANCA相关性血管炎患者血清CECs、vWF、ES、VCAM-1水平的影响。
1 资料及方法
1.1 一般资料
50例患者的临床资料来自2013年3月至2018年3月在绵阳市中心医院风湿免疫科经临床病理确诊为AAV者。依照治疗方式不同进行分组,其中采用单纯大剂量激素冲击治疗的患者26例纳入常规组,采用激素冲击配合PE联合治疗的患者24例纳入PE组。常规组患者中,男性16例,女性10例;年龄42~70岁,平均(55.64±7.89)岁;病程(2.24±0.49)个月。PE组中,男性15例,女性9例;年龄43~70岁,平均(56.09±6.99)岁;病程(2.18±0.51)个月。
纳入标准:(1)所有患者均为住院患者,血清ANCA阳性;(2)病症明显累及肾脏,行肾活检,病理学检查表现为寡免疫复合物节段坏死性肾炎或是新月体性肾炎;(3)表现为明显的肾功能进行性减退,血清肌酐>266 μmol/L;(4)并发血管炎病理原因所致肺部、皮肤以及关节等器官与组织损伤。排除标准:(1)感染病毒性肝炎;(2)合并其它严重免疫缺陷疾病:(3)合并严重心脑血管疾病;(4)继发性血管炎;(5)已大剂量细胞毒药物使用史。
1.2 方法
1.2.1 治疗方法 (1)常规组患者采用单纯大剂量激素冲击治疗,首先予以注射用甲泼尼龙琥珀酸钠(Pfizer Manufacturing Belgium NV,比利时),0.5 g静脉滴注治疗,1次/d,连续3 d。后改为甲泼尼龙片(Pfizer ltalia Srl,比利时),口服起始剂量0.8-1.0 mg·kg-1·d-1,服用30 d,剂量逐减至每日10 mg,同时采用环磷酰胺(江苏恒瑞医药股份有限公司)0.6 g静脉滴注辅助治疗,15 d/次。(2)PE组患者采用激素冲击配合PE联合治疗,PE治疗使用血浆分离器为德国Fresenius公司生产的Plasmaflux Kabi,进行肝素抗凝,行PE治疗时,置换液选用2 000 mL新鲜冰冻血浆及人血白蛋白等,速率维持在50~60 mL/min,同时加以抗敏处理。PE治疗每周2~3次,置换量为每次2 000~3 000 mL,PE组15例患者共行65次PE治疗。在进行PE治疗同时接受激素冲击治疗,治疗方式同常规组患者。两组患者均接受为期6个月治疗后进行效果评价。
1.2.2 指标测定 间接免疫荧光法测定血清ANCA值,脲酶速率法测定血清BUN值,Jaffe’s初始速率法测定血清Scr值,酶联免疫吸附法(ELISA)测定血清中循环内皮细胞(CECs)、血管性假血友病因子(vWF)、E选择素(ES)和血管细胞黏附分子1(VCAM-1)水平。各项指标检测均是由同一位临床经验丰富的检验科医师严格按照试剂盒说明书进行。
1.3 统计学分析
2 结果
2.1 一般临床资料比较
两组患者匹配年龄、性别构成、病程、肾小球新月体占比及BVAS评分,均显示差异无统计学意义(P>0.05)。见表1。
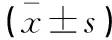
表1 两组AAV患者一般临床资料比较
注:伯明翰血管炎活动评分(birminghan vasculitis activity score,BVAS)
2.2 两组AAV患者治疗前后血清ANCA指标及患者肾功能指标变化比较
两组AAV患者治疗前血清ANCA指标及Scr、BUN值比较,差异无统计学意义(P>0.05)。治疗后,两组患者血清ANCA及肾功能各项水平均有显著变化,且PE组ANCA水平及Scr值下降趋势均较常规组更明显,差异有统计学意义(P<0.05)。见表2。
2.3 两组AAV患者治疗前后CECs个数、vWF、ES及VCAM-1水平比较
两组AAV患者治疗前血清中CECs个数、vWF、ES及VCAM-1水平比较,差异无统计学意义(P>0.05)。治疗后,两组患者CECs个数、vWF、ES及VCAM-1均表现出显著变化,且PE组CECs个数、vWF、ES及VCAM-1值下降趋势均较常规组更明显,差异有统计学意义(P<0.05)。见表3。
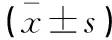
表2 两组AAV患者治疗前后血清ANCA、Scr及BUN值的比较
*P<0.05,与同组治疗前相比。
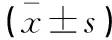
表3 两组AAV患者治疗前后CECs、vWF、ES、VCAM-1水平的比较
*P<0.05,与常规组治疗前相比;#P<0.05,与同组治疗前相比。
2.4 两组AAV患者治疗后不良反应发生情况比较
两组AAV患者治疗后出现的不良反应以感染为主,且PE组发生人数少于常规组,差异无统计学意义(P>0.05)。见表4。
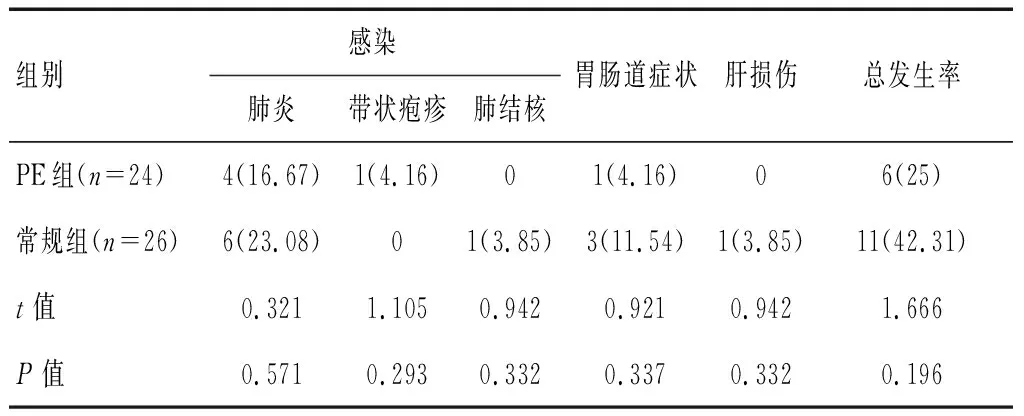
表4 两组AAV患者治疗后不良反应发生情况比较[n(%)]
3 讨论
AAV是以机体产生坏死性炎症为特征的血管炎,属于我国较为少见的血管类炎症疾病,其本质为自身免疫疾病,主要是由于血清ANCA阳性引起全身中小动脉受到损害[9]。AAV发病时累及全身多个部位,其中肾脏受损最严重。在我国,AAV中的MPA约占AAV患者的80%左右,这与欧美国家的发病趋势相反,这些差异可能与遗传或地域环境因素相关[10]。虽然所有年龄段的个体都可能患AAV,但40%是老年人。该疾病若不加以控制,通常是致命的,血管炎活动是最常见的死亡原因。1年内的死亡率约有80%[11]。
目前,激素免疫抑制疗法尤其是糖皮质激素联合每日口服环磷酰胺疗法极大地改善了AAV患者结局,采用此方案治疗可以有效改善约85%患者病情,延长患者生命[12]。但对于肾脏受损严重的患者,激素冲击治疗疗效较为局限。近年来,PE疗法逐渐兴起,通过PE疗法可达到短时间清除机体致病ANCA炎症因子,并缓解肾脏损害,可用于严重急性肾功能衰竭、肺出血或同时合并抗肾小球基底膜(GBM)抗体的患者[13-14]。ANCA是AAV的血清标志物,其可作为病情判定的重要指标。在本研究中,两组AAV患者治疗前血清ANCA指标及Scr、BUN值无明显变化,治疗6个月后,两组患者血清ANCA及肾功能各项水平均有显著变化,且PE组ANCA水平及Scr值下降趋势均较常规组更明显。两组BUN值变化不明显,可能受机体感染或饮食方面影响较大。以上提示了对于肾脏损伤严重的AAV患者,激素联合PE治疗可有更好的疗效,不仅可清除自身致病抗体,还可维持较好的肾功能,该研究结果在白培进等[15]在该方面的相关报道有相似之处。
临床研究[16]发现,AAV患者内皮损伤是疾病发展的显著特征,机体ANCA与内皮细胞活化的相互影响是导致疾病发生的重要诱因。因此,对AAV患者的内皮细胞水平进行检测是反映患者内皮损伤最直接的方式。此外,也可反应AAV活动性。陈樱花[7]等曾研究报道循环内皮细胞损伤标记物与AAV活动性密切相关。血清中CECs、vWF、ES和VCAM-1 4种标记物水平的变化可反映血管内皮细胞的损伤。CECs是内皮损伤后,脱落进入外周血循环的产物,是反应血管损伤的可靠指标。vWF能加速血小板粘附聚集,加重血管内皮损伤程度。ES和VCAM-1均属于粘附分子,在判断内皮损伤中也具有重要作用。本研究显示,两组患者治疗后的CECs个数显著减少,vWF、ES及VCAM-1水平均显著较低,但PE组下降趋势均较常规组更明显,可能与PE可短清除机体致病炎症因子的时间有关。
调查[17]显示,AAV患者死亡的首要原因是感染,尤其是第一年死亡的只要原因。中性粒细胞减少症是诱发AAV患者感染的危险因素,而中性粒细胞减少多与大剂量CTX的使用有关[18]。本研究通过随访比较两组患者治疗6个月后不良反应同样以感染为主,分别为肺炎、带状疱疹及肺结核。PE组发病人数较常规少,但无统计学意义,可能是由于AAV在我国发病人数较少导致纳入样本量不够所致。
总之,激素冲击治疗配合PE对重症AAV患者疗效显著,可有效清除ANCA,降低血管中内皮细胞损伤的标记物水平,且优于单纯激素疗法,安全性良好,值得临床推广应用。

