少肌性肥胖发病机制和诊断标准的研究进展
谢文清,陆明洁,王 苗,李 霞,海向军
(西北民族大学 少数民族体质与健康重点实验室,甘肃 兰州 730030)
少肌症(Sarcopenia)是一种以肌肉质量、肌肉力量以及肌肉功能下降为主要特征的中老年人高发病征[1],而SO是少肌症与肥胖的组合,SO的平均发病率约为5%~10%,且随着年龄增长,发病率增高[2-4].少肌症和肥胖对老年人的健康有着不利影响,SO比单纯少肌症或肥胖症对代谢性疾病[5]和心血管疾病[6]发病率和死亡率影响更大,且对认知障碍[7]有着显著的关联.与SO相关的医学问题远比单纯的肌肉减少症或肥胖症更严重,因此,它被认为是对健康和福祉的重大全球性威胁[8].SO的患病率随着年龄的增长而增加,尤其是80岁以上的老年人SO的患病率显著增加.由于世界人口正在迅速老龄化,到2050年,预计总人口的22%将超过60岁,约5%的人口将超过80岁[9],所以SO在不久的将来为社会带来严重的健康问题.因此了解SO的发病机制和诊断标准可以为其早期筛查、早期诊断和早期治疗提供策略.
1 发病机制
SO的发病机制是复杂的,多因素可以相互作用,包括与年龄相关的体成分的改变(内脏脂肪和肌肉脂肪增加、肌肉减少)、全身慢性炎症、胰岛素抵抗(Insulin resistance,IR)、生活方式的改变(饮食、体力活动等),分子机制(瘦素、脂联素、白细胞介素6、白细胞介素10、肌肉生长抑制素)等.但关于这些因素之间关联的因果关系方向的一致观点尚未确定.
1.1 年龄相关的体成分的改变
SO与年龄相关的体成分改变密切相关.衰老伴随着生理和身体成分的变化,肌肉和脂肪组织进行重新分布,老年人倾向于增加脂肪量,并有可能发展成肥胖症.随着年龄的增长脂肪量逐渐增加,大约在60~75岁之间达到高峰;肌肉质量和肌力从30岁左右开始下降,60岁以后下降速度明显加快;内脏脂肪和肌内脂肪含量增加,而其他部位的皮下脂肪含量下降[10,11].随着体脂含量的增加,肌肉质量逐渐减少,进而减少了基础能量消耗,这可能与激素变化、体力活动减少、饮食变化有关,肌肉质量的减少又能反过来加剧脂肪组织的增加[12],脂肪组织倾向于在腹部积聚.这一现象可能与慢性亚临床炎症有关,而慢性亚临床炎症又加重了SO[13].脂肪细胞也浸润肌肉组织,降低收缩效率和肌肉的力量.这可能会导致体力活动水平的下降,从而导致神经肌肉功能障碍.
1.2 慢性炎症
SO患者被认为处于高度炎症状态,会增加患慢性疾病和氧化应激的风险,进而损害胰岛素敏感性和生长激素分泌,然后导致肌肉丧失和随之而来的少肌症的发生和进展[14].肥胖是导致全身低级别炎症的主要原因,尤其是内脏脂肪,内脏脂肪分泌多种不同的促炎细胞因子,如白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)和C-反应蛋白(CRP)等,这些促炎细胞因子与SO的发生有关[9].在肥胖脂肪组织中,脂肪细胞发生肥大、增生和活化,导致促炎巨噬细胞和其他免疫细胞的积累以及各种脂肪因子的产生失调,这些细胞与衰老细胞、免疫细胞释放的细胞因子和趋化因子一起产生局部促炎状态.慢性炎症也有可能导致合成物抵抗,导致一些心血管和代谢并发症,如胰岛素抵抗[15].炎症细胞因子不仅在肌肉内动态平衡中起着关键作用,而且在以蛋白质代谢改变为特征的临床发病机制中也起着关键作用.TNF-α、IL-1和IL-6等促炎细胞因子的增加造成肌肉崩溃,导致蛋白质分解增加[16].对4984名老年人的调查研究表明[17],与单纯少肌症和肥胖相比,SO患者体内与炎症相关的因子水平明显增高,少肌症和肥胖的结合与全身炎症密切相关.全身慢性炎症被认为是SO发病的最重要的因素.
1.3 胰岛素抵抗(IR)
IR与脂肪增生和肌肉质量减少有关,IR通常在脂肪过多的情况下发生,导致胰腺细胞分泌胰岛素的代偿性增加和高胰岛素血症.引起IR的主要机制之一是脂肪代谢次级产物在心肌细胞中的积累,肥胖患者和衰老期间由于脂质毒性和线粒体功能受损,活性氧水平升高,进一步促进了IR的发展[18].因此,氧化和抗氧化化合物之间的不平衡导致c-jun N-末端激酶(JNK)、I-B激酶(IKK)和p38-丝裂原活化蛋白激酶(p38-MAPK)等应激途径的激活,从而导致胰岛素受体及其底物失活[19].此外,活性氧还抑制线粒体功能,从而造成脂质毒性和IR的恶性循环.IR在肥胖的人可能促进肌肉分解代谢,并导致肌肉质量损失或肌肉减少,因为胰岛素是一个强大的合成信号,提供蛋白质代谢[20].同时,肌肉的流失减少了胰岛素反应靶组织的质量,从而加重了IR,促进了肌肉萎缩和肥胖[7].同时慢性炎症也可以导致IR的发生,进而与慢性炎症协同促进肌肉质量的减少和脂肪质量的增加[21].Park SW[22]等学者研究证明,IR是肌肉力量下降及老年糖尿病病人表现出腿部肌肉力量和质量的丧失加速的一个独立相关因素.
1.4 生活方式的改变
与SO发病有关的生活方式的改变主要有饮食和缺乏体力运动,其关系如图1所示.饮食中主要有营养不良、维生素D缺乏、蛋白质摄入不足以及肠道微生态的改变.有研究表明,个体、宏观和微观营养素的摄入与SO之间存在潜在的联系[23].慢性营养不良可能通过诱导高血糖、低胰岛素水平和低蛋白质合成来促进SO的发展,因此,增加膳食纤维、减少简单碳水化合物的摄入和保持良好的蛋白质摄入量可能有助于预防SO[24].慢性微量营养素不足也可能通过多种机制导致SO,包括低度慢性易燃和氧化效应,因此,摄入足够的微量营养素,如钙(Ca)、铁(Fe)和维生素C,可能有助于预防SO[24].而维生素D被认为对肌肉纤维的蛋白质合成和肌肉收缩性调节具有重要作用,低维生素D导致肌肉合成代谢减少,并与胰岛素分泌减少、肌原纤维降解以及随后的肌肉蛋白翻转有关[25].肠道微生态的改变主要通过肠道菌群影响脂肪代谢、肠道细菌代谢产生胆汁酸、肠道细菌移位以及肠道细菌影响维生素合成等作用引起少肌症和SO的发生与发展[26,27].低水平的体育活动主要与老年人久坐的生活方式有关,在很大程度上促进肥胖的发展,而且还可能进一步加重肌肉强度的降低[28].生活方式的改变虽然不同于慢性炎症和IR对SO发病的作用机制强,但却可以通过多种途径来影响慢性炎症和IR,进而起到协同的作用.
1.5 分子机制
除了促炎症因子(IL-6、IL-1、TNF-α)等分子通过慢性炎症引起SO外,其他分子如脂联素、瘦素、肌肉生长抑素、生长激素、性激素(睾酮和雌激素)、胰岛素、糖皮质激素等分子也与SO 密切相关.脂联素来源于许多脂肪组织的释放,脂联素通过促进骨骼肌和脂肪组织中葡萄糖的摄取而增加胰岛素敏感性,并促进脂肪酸的氧化[29].此外脂联素可减少骨骼肌中Ⅰ型氧化型肌纤维的形成,这些作用是通过激活腺苷酸活化蛋白激酶(AMP-activated protein kinases,AMPK)信号通路来实现的[30].运动导致的体重下降与血浆脂联素浓度和脂肪质量之间存在着强烈的负相关关系,而瘦素水平的变化则相反.瘦素可引起肌细胞核内肌肉萎缩相关转录因子的表达增加,使肌肉质量、肌肉力量和肌肉功能下降[31].肌肉生长抑素是骨骼肌生长的负调节因子,这种抑制作用的机制包括激活素II型受体A和B,加速Smad 2和Smad 3磷酸化,上调参与减少骨骼肌前体细胞增殖和分化的基因以及增强成熟肌纤维的蛋白质降解途径,肌肉生长抑素还可通过TNF在skele-tal肌肉细胞中产生活性氧,从而诱导氧化应激[32].除此之外,还有很多与肥胖有关的分子也会参与SO的发病,这些分子通过协同或拮抗作用直接或间接影响肌肉减少和脂肪的增加.

图1 饮食和身体活动减少与SO的关系
2 诊断标准
2.1 少肌症的诊断标准
目前 sarcopenia 暂无统一的诊断标准,流行病学调查常用的诊断标准有:Baumgartner 诊断标准、欧洲老年人 Sarcopenia 工作组诊断标准(European Working Group on Sarcopenia in Older People,EWGSOP)、国际 Sarcopenia 工作组诊断标准(International Working Group on Sarcopenia,IWGS)、亚洲 Sarcopenia 工作组诊断标准(Asian Working Group for Sarcopenia,)、美国国立卫生研究院 Sarcopenia 项目组诊断标准(the Foundation for the National Institutes of Health Sarcopenia Project,FNIHSP)等[33].以上诊断标准除了Baumgartner 诊断标准仅对肌肉质量进行评估外,其余的诊断标准都对肌肉质量、肌肉力量(握力)和肌肉功能(步速)进行了综合的评估.肌肉质量可用双能X线吸收仪(dual X ray absorptiometry,DXA)或生物电阻抗法(bioelectrical impedance analysis,BIA)进行测量,除FNIHSP外,其余诊断标准采用相对四肢骨骼肌量法(Relative appendicular skeletal muscle,RASM)进行评估,RASM为四肢肌肉组织和身高的平方的比值,低于同性别健康年轻人对照均值两个标准差以下,即为低肌肉质量[34,35].FNIHSP对肌肉质量的评估为肢体瘦体重(Appendicular lean mass,ALM)与体重指数(Body Mass Index,BMI)的比率[36].肌肉力量采用握力,肌肉功能采用步速进行评估,且各诊断标准的方法相同,各诊断标准的对比见表1.
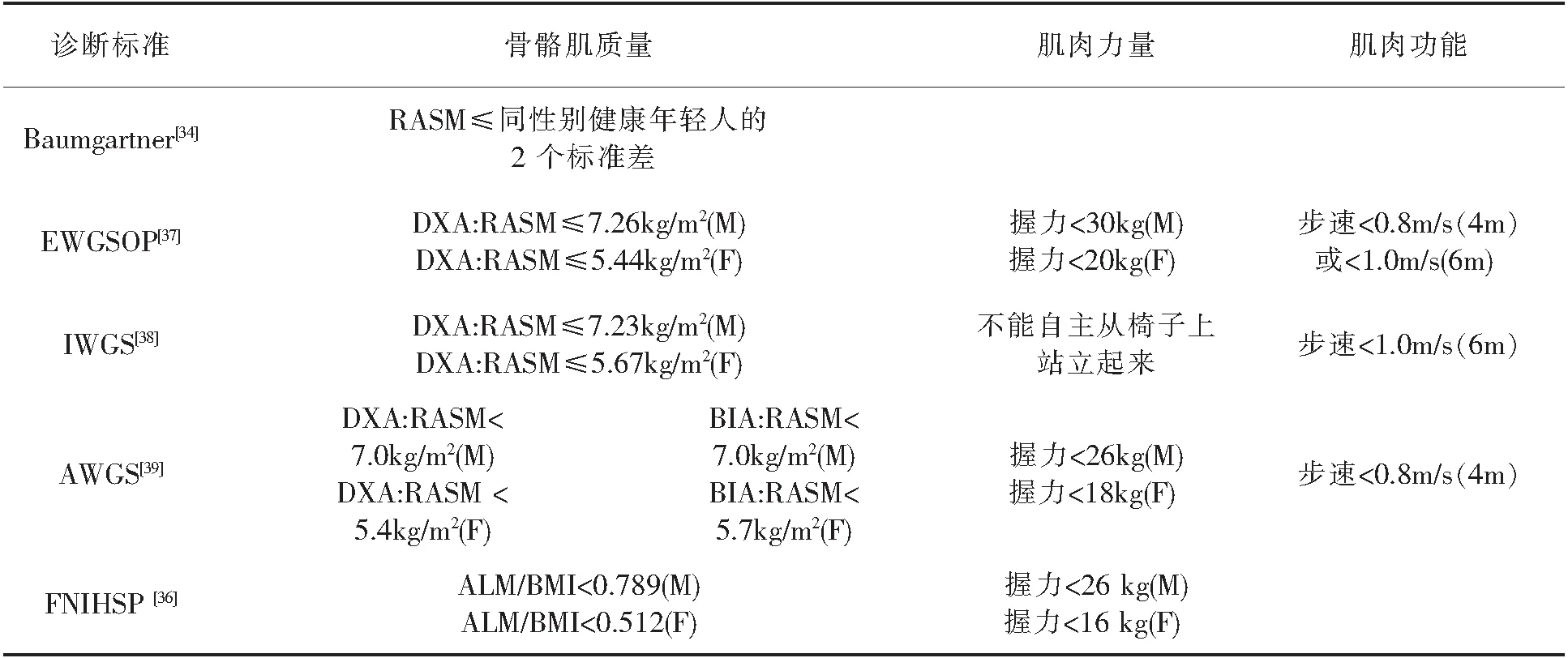
表1 各sarcopenia诊断标准对比
2.2 肥胖的诊断标准
肥胖常用的诊断标准有三种: 1)《中国成人超重和肥胖症预防控制指南》的肥胖判定标准,BMI≥28kg/m2; 2)WHO 推荐的使用体脂率判定肥胖,男性体脂率≥25%,女性体脂率≥35%; 3)体脂肪百分比超过研究人群第60个百分位以上.与BMI相比,体脂率百分比是用来评价肥胖的更精准的重要指标[40,41],尤其是针对不同研究对象所得出的针对本研究对象的体脂率切点,对于诊断该研究人群的肥胖患病水平更加准确,因此目前采用体脂肪百分比超过本研究人群第60个百分位以上作为肥胖的诊断标准.
2.3 少肌性肥胖的诊断标准
少肌性肥胖的诊断标准为少肌症的诊断标准与肥胖诊断标准的结合,但采用不同的组合方式、不同的诊断标准所得的SO的患病率差别较大,即使患病率大致相同,其重叠率也非常低[42].因此针对不同的人群,应当选取适合本研究对象的SO诊断标准.
综上,SO是一个多方面的医学病症,其预后不良,可导致不同的健康后果.随着人口老龄化问题的加剧,SO引起社会的广泛关注.SO的发病机制复杂,其中以慢性炎症和IR为主,不同的发病机制之间可以相互作用.SO的诊断标准需要统一,以便在各个研究中使用,使SO的流行程度与其所带来的健康结果之间的关联一致.

