蔬菜灰霉病菌抗嘧霉胺突变菌株抗性水平的测定
余正军 范晓培 田喜庆 王清文 张勇
摘 要:在室内通过对蔬菜灰霉病菌抗嘧霉胺突变菌株的抗性水平进行测定,进一步了解抗性突变菌株对嘧霉胺的敏感性;结果表明,蔬菜灰霉病菌在受到药剂的选择压力、紫外线照射的共作用下,使其细胞内的遗传物质和蛋白质的结构产生了变化,从而导致亲本敏感菌株变成了抗性突变体。
关键词:灰霉病菌;嘧霉胺;抗性突变体;抗性水平
嘧霉胺作为一种比较新型的杀菌剂,在很长的一段时间内都是作为主要防治蔬菜灰霉病害的杀菌剂,但由于常年在农作物上大量施用嘧霉胺,抗药性与残留问题也随之而来,从而影响到其在市场上的开发前景和施用年限。因此,通过测定灰霉病菌对嘧霉胺的抗药性,用以推测其抗性水平,这对于指导实践意义重大。本研究在前期研究结果的基础上,在室内通过对蔬菜灰霉病菌抗嘧霉胺突变菌株的抗性水平进行测定,进一步了解抗性突变菌株对嘧霉胺的敏感性。
一、材料与方法
1.试验材料
(1)材料
供试菌株TG30由山西农业大学农药学研究人员从蔬菜保护地上分离得到。
供试杀菌剂:96.1%嘧霉胺原药,由山东双星农药厂提供。
PDA培养基:马铃薯200g、葡萄糖20g、琼脂20g、蒸馏水1000mL
含药培养基:96.1%嘧霉胺原药用丙酮配成10?g/mL的母液,然后把母液放在4℃的冰箱中贮藏。使用时以无菌水进行稀释,以10%药液量加入融化的PDA培养基中(冷却至45℃~50℃)充分摇匀,制成含最终所需药量的PDA平板,
(2)仪器
主要仪器:HD-29型净化操作台(哈尔滨东联电子技术开发有限公司),SPX型智能生化培养箱(宁波江南仪器厂),DHG-9140型电热恒温干燥箱(上海精宏实验设备有限公司),高压蒸汽灭菌锅(上海审安医疗器械厂),A205型万分之一电子天平(德国),微波炉(青岛海尔集团)。
2.试验方法
采用FAO推荐的菌落直径法,在含系列浓度梯度药剂的PDA平板上测定各抗性突变菌株对嘧霉胺的敏感性,按照抗性倍数的大小进行判定:抗性倍数小5时为敏感菌株,在5-10之间时为低抗菌株,在10-40之间时为中抗菌株,大于40时为高抗菌株。
抗性倍数 = 抗性菌株EC50值 / 敏感基线值
二、结果与分析
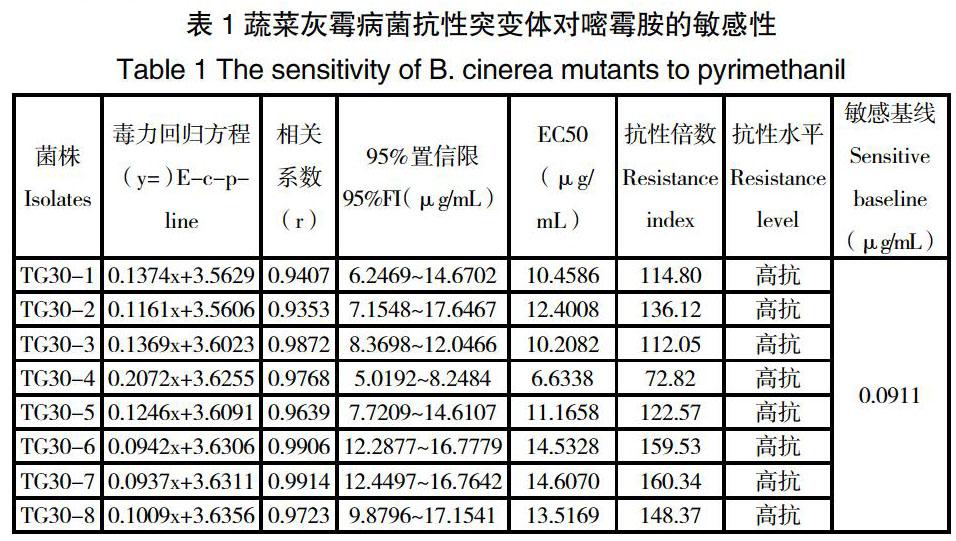
蔬菜灰霉菌株TG30在室内经过紫外诱导、药剂驯化、紫外药剂联合诱导3种方法进行诱导后,成功诱导出8株抗性突变,采用菌丝生长速率法对这8株抗性突变体的抗性水平进行了测定;由表1可知:经过紫外和药剂的联合诱导使亲本敏感菌株的EC50值达到了6.6338-14.5328μg/mL,而親本敏感菌株TG30的EC50值才为0.0958μg/mL,与亲本敏感菌株相比,突变菌株的抗性倍数超过了40倍,达到了一个高抗的水平。这一结果说明,蔬菜灰霉病菌在受到药剂的选择压力、紫外线照射的共作用下,使其细胞内的遗传物质和蛋白质的结构产生了变化,从而导致亲本敏感菌株变成了抗性突变体。
三、 小结与讨论
蔬菜灰霉病菌抗药性的监测是抗药性治理的基础,对抗药性情况及时作出预测,就能够科学合理的指导使用农药。本文通过测定抗嘧霉胺突变体的抗性水平,发现其达到高抗的水平,因此在自然条件下很可能产生高抗性的抗嘧霉胺突变体。
本实验是在室内对灰霉病菌进行的抗性诱导,有很大的局限性,试验所处的条件与自然条件有一定的差别,以此作为判断田间抗药性发生的标准并不完全可靠。例如,在实验室很容易诱导获得吗啉类杀菌剂的抗药性突变体,但是田间多年广泛使用吗啉类杀菌剂却仍然没有出现抗药性问题。因此,不能仅仅依靠是否容易诱得抗药性菌以及诱到得到的抗药性菌的抗药性倍数去评价病原菌产生抗药性风险的大小,还需进一步测定抗药性菌株适合度以及抗药性菌株遗传稳定性来验证。
参考文献:
[1]Rosslenbroich H J,Stuebler D.Botrytis cinerea-history of chemical control and novel fungicides for its management[J].Crop Protection,2000,19:557-561.
[2]贾晓华.番茄灰霉病菌和油菜菌核病菌对嘧霉胺的敏感性基线及番茄灰霉病菌抗药性研究[D] .南京农业大学,2004.
[3]赵善欢.植物化学保护[M].中国农业出版社,1999.147.
[4]余正军,刘慧平.山西省蔬菜灰霉病菌对嘧霉胺的抗性监测[J].山西农业大学学报(自然科学版),2012,32(1).
[5]Borck M K. Studies on the mode of action of benomyl in Xeurospo.ra crassa. Ph.D Thesis, Lousiana State University, 1973, 171.
[6]Falandre L D, Daboussi M J, Leroux P. Inheritance of resistance to fenpropimorph and terbinafine, two sterol biosynthesis inhibitors, in Nectra haematococca〔J〕. Phytopathol, 1991, 81: 1432-1438.
[7]Staub T. Fungicide Resistance: Practical Experience with Anti-resistance Strategies and the role of Integrated use〔J〕. Anu Rev Phytopathol, 1991, 29: 401-442.
[8]Waard M A, Banga M, Ellis S W. Characterization of the sensitivity of Erysiphe graminis f.sp. tritici to morpholines〔J〕. Pestici. Sci., 1992, 34: 365-377.

