猪胰脏中胰蛋白酶提取条件优化
岳晓禹,范露露,蔡青和,李长滨,杨盛茹
(河南牧业经济学院食品与生物工程学院,河南郑州450046)
在悠长的农业历史和独特的饮食文化的影响下,中国人对猪肉有种特殊的喜好,也使得中国成为世界第一的生猪养殖和消费大国[1]。肉制品消费的数量庞大,导致大量不可食用的胰脏造成浪费,胰脏中含有的酶容易自溶,直接导致了环境的污染。胰脏含有多种可以利用的酶资源,从其中提取这些酶,不仅可以废物利用而且保护环境。
猪胰脏中最重要的酶之一就是胰蛋白酶,具有很高的经济价值。从动物胰脏中提取的胰蛋白酶属于中外药典收录的助消化药。胰蛋白酶是一种碱性蛋白酶[2],属于水解酶的一种[3]。前体无活性,受肠激酶的刺激被激活。不同来源的胰蛋白酶相对分子质量不同,但大都在24 000 Da左右,等电点为10.8,最适pH值为7.6~8.0[4]。胰蛋白酶一般存在于高等动物胰液和低等动物胃液中[5],作用特性单一[6],只专一作用于精氨酸和赖氨酸参与形成的肽键,促进丝氨酸残基中蛋白质的断裂,在动物的消化系统中被发现,通常用于消化细胞间的软组织[7]。胰蛋白酶在各种行业中仍然有很大的需求[8-9]。临床上应用于外科炎症、溃疡、脓胸、血胸、创伤性损伤等。除了其的临床意义外,在牛奶工业、蛋白质组学和各种食品加工工序中也有着极高的应用,特别是在动物细胞组织培养实验室有着极其广泛的应用[10]。
国内外专家学者对提取胰蛋白酶方面有不少的研究,早些时候提取胰蛋白酶大都采用低溶度有机溶剂(如25%乙醇、10%丙酮、7.5%异丙醇等)提取,通过氯化钙和胰酶粉进行激活,最后用高浓度有机溶剂沉淀的方法。但近些年来提取胰蛋白酶的工艺有了很大的改变,因为有机溶剂的毒性和对人体的危害,各位专家学者开始使用非有机溶剂对胰蛋白酶进行提取,在激活剂和保护剂的选择上也有了很多的改变。如周红航等[11]采用蒸馏水提取,氯化钙和胰酶粉激活,根据胰蛋白酶各方面的性质用聚乙二醇/硫酸铵双水相体系对胰蛋白酶进行纯化,最后酶活达到了1780U/mL;刘亮亮等[12]在2010年研究了胰蛋白酶提取工艺,采用Tris-HCl缓冲液为提取剂,氯化钙和胰蛋白酶粉为激活剂,盐析方法进行提纯,最终酶比活力达到6600BAEE/mg,该方法虽然具有很高的提取效率,但要消耗大量的有机溶剂;余武英等[13]在2011年也采用蒸馏水提取,氯化钙和胰酶粉激活,用聚乙二醇使胰蛋白酶得到沉淀分离,最终酶活力达到1 600 U/mL以上,比盐析法提取率高,操作简单;丁凌霄等[14]在2013年用乙酸酸化水提取,盐析法粗提,氯化钙和胰蛋白酶激活,亲和层析分离纯化胰蛋白酶,酶活达到256 U/mL;李明生等[15]在2017年用蒸馏水提取,通过对激活条件的优化研究出当氯化钙浓度为0.2 mol/L为最佳激活条件,经二乙氨乙基(diethylaminoethyl,DEAE)-琼脂糖凝胶FF纯化后其酶活力为3980U/mg,酶活得到显著提高。
本试验对胰蛋白酶制备进行研究,以期减少有机溶剂在提取过程中的使用,相对提高胰蛋白酶的活力,打破有机溶剂消耗量大的问题,减少有机溶剂对环境和人体的危害。
1 材料与方法
1.1 材料与试剂
冷冻猪胰脏、猪十二指肠、胆囊:某公司提供;Tris-HCl缓冲液、三羟甲基氨基甲烷:合肥博美生物科技有限责任公司;干酪素:国药集团化学试剂有限公司;酪氨酸对照品:德国Sigma公司;NaCl、Na2HPO4:天津市永大化学试剂有限公司;KH2PO4:北京西陇化工股份有限公司;试验所用试剂均为分析纯。
1.2 仪器与设备
PY-790绞肉机:中山市鹏宇电器有限公司;IS139FD-V2 pH计:上海仪迈仪器科技有限公司;UV759CRT紫外可见分光光度计:上海佑科仪器仪表有限公司。
1.3 方法
1.3.1 猪胰脏中胰蛋白酶提取工艺试验流程及操作要点
冷冻猪胰脏打浆→提取→激活→浓缩→胰蛋白酶
操作要点:
冷冻猪胰脏打浆:实验先用剪刀去除大块脂肪、结缔组织,再用绞肉机来破碎胰脏。
提取:取10 g胰浆,按200 mL/100 g比例加入20 mL提取剂(预冷至4℃)进行提取,使胰蛋白酶细胞充分溶解在溶液中。胰蛋白酶的活性在4℃时比较稳定[16],所以整个操作过程在4℃条件下进行。
激活:在上述溶液中加入激活剂激活胰蛋白酶,在此过程中为了减少蛋白酶的降解失活加入1%氯化钠和1%甘油作为保护剂,调节pH为8.0,充分搅拌,4℃条件下激活18 h,两层纱布过滤,得到滤液,滤渣再次提取,合并两次提取液。
浓缩:用截留分子质量为10 000 Da的透析袋对胰蛋白酶液进行浓缩,把透析袋剪成约10 cm的小段,用蒸馏水煮沸10~15 min左右,透析袋的一端用夹子夹到位,取10 mL胰蛋白酶液从透析袋另一端倒入,最后用夹子夹到位。把处理好的装有胰蛋白酶液的透析袋放入干净的烧杯中,倒入配好的聚乙二醇(聚乙二醇∶蒸馏水=30∶100),倒入的聚乙二醇的量以正好浸入透析袋为准,最后在4℃条件下进行浓缩。烧杯中的聚乙二醇1~2h换一次,5~6h换一次,最后放置过夜,制成胰蛋白酶。
1.3.2 胰蛋白酶活力测定
按《中国药典》2015年版第二部进行测定[17]。测定过程稍有改动,因为测定的胰蛋白酶液是液体,所以药典中用氯化钙溶液溶解定容胰蛋白酶粉的过程省略,其余步骤和药典都相同。
胰蛋白酶活力定义:每分钟水解酪蛋白生成三氯醋酸不沉淀物在波长275 nm处与1 μmol酪氨酸相当的酶量,为1个胰蛋白酶活力,U/mL。
1.3.3 胰蛋白酶提取工艺优化单因素试验
分别考察不同提取剂(0.15 mo1/L氯化钠、蒸馏水、磷酸盐缓冲液(pH6.8)、0.05 mo1/L Tris-HCl缓冲液),激活剂(0.06%CaCl2+猪十二指肠(猪胰脏∶十二指肠=8∶1,下同),0.2%CaCl2+1%胆汁,0.2%CaCl2+1%胰酶粉,0.2%CaCl2+猪十二指肠),提取pH值(2、4、6、8、10、12、14),提取时间(2 h、4 h、6 h、8 h、10 h、12 h、14 h、16 h、18 h、20 h、22 h、24 h)对胰蛋白酶酶活的影响。
1.3.4 胰蛋白酶提取工艺优化正交试验
在单因素试验的基础上,设计L9(34)正交试验确定最优方案。

表1 猪胰脏中胰蛋白酶提取条件优化正交试验因素与水平Table 1 Factors and levels of orthogonal test for optimization of extraction conditions of trypsin in pig pancreas
2 结果与分析
2.1 单因素试验结果
2.1.1 提取剂种类对胰蛋白酶酶活的影响
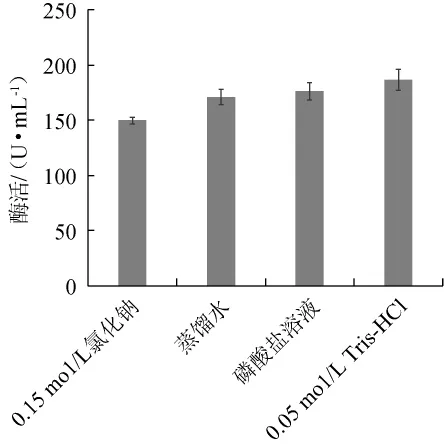
图1 提取剂种类对胰蛋白酶酶活的影响Fig.1 Effect of types of extraction enzymatic activity of trypsin
由图1可知,当提取剂为0.15 mol/L NaCl时,胰蛋白酶酶活较低,为150 U/mL;当提取剂分别为蒸馏水、磷酸盐溶液、0.05 mol/L Tris-HCl时,胰蛋白酶酶活分别为171 U/mL、176 U/mL、187 U/mL,没有显著差异(P>0.05)。但是因为Tris-HCl是有机溶剂,大量使用会造成浪费和环境污染,所以不宜使用,因此选择蒸馏水、磷酸盐缓冲液、0.15 mol/L Tris-HCl进行后续试验。
2.1.2 激活剂种类对胰蛋白酶酶活的影响
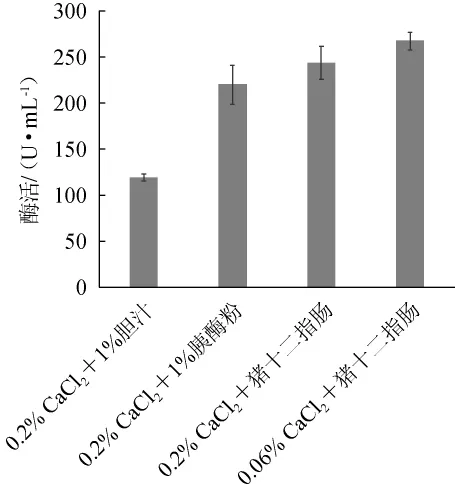
图2 激活剂种类对胰蛋白酶酶活的影响Fig.2 Effect of activation agents types on enzymatic activity of trypsin
由图2可知,当激活剂为0.2%CaCl2+1%胆汁时,蛋白酶酶活为120 U/mL;当激活剂分别为0.2%CaCl2+1%胰酶粉、0.2%CaCl2+猪十二指肠、0.06%CaCl2+猪十二指肠时,酶活分别为221 U/mL、244 U/mL、268 U/mL,没有显著差异(P>0.05),因此选择0.2%CaCl2+1%胰酶粉、0.2%CaCl2+猪十二指肠、0.06%CaCl2+猪十二指肠进行后续试验。
2.1.3 提取pH值对胰蛋白酶酶活的影响
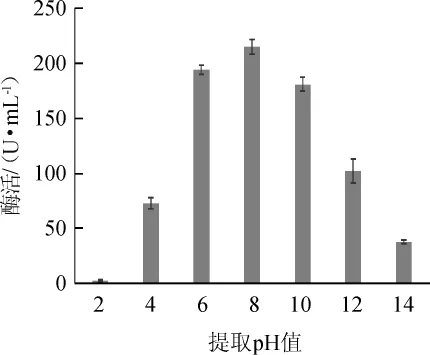
图3 提取pH值对胰蛋白酶酶活的影响Fig.3 Effect of extraction pH on enzymatic activity of trypsin
由图3可知,胰蛋白酶酶活随着pH值的升高呈先升高后降低的趋势。在pH2~8范围内,酶活力差异显著(P<0.05),在pH=8时酶活达到最高,为215 U/mL,pH值由8升至14时,酶活力急剧下降,差异显著(P<0.05)。酸性或碱性过强都会导致胰蛋白酶失活。因此选择pH值8为最佳提取pH值。
2.1.4 提取时间对胰蛋白酶酶活的影响
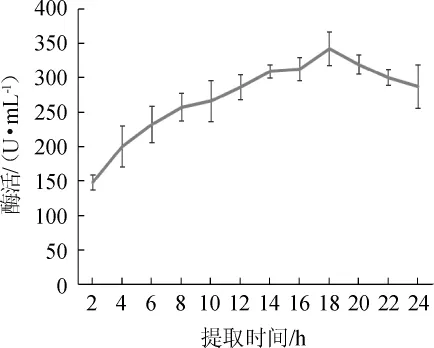
图4 激活时间对胰蛋白酶酶活的影响Fig.4 Effect of activation time on enzymatic activity of trypsin
由图4可知,随着激活时间的延长,胰蛋白酶酶活呈先升高后降低的趋势,在2~18 h范围内,胰蛋白酶活力急剧增加,差异显著(P<0.05),在18 h时酶活达到最高,为342 U/mL,在18~22 h范围内酶活慢慢下降与最高值没有显著差异(P>0.05),因此选择最佳激活时间为18 h。选择最佳激活时间不仅可以充分激活胰蛋白酶,还可以避免激活后胰蛋白酶本身的降解,这是把握激活时间的关键[19]。
2.2 正交试验结果
由表2可知,对酶活影响主次因素为提取pH值>提取时间>激活剂>提取剂。猪胰脏蛋白酶提取最优方案为A3B1C1D2,即提取剂为0.15 mo1/L氯化钠,激活剂为0.06%的CaCl2和猪十二指肠,提取pH值为6,提取时间为18h。上述得出的最优方案是不是真正的最优方案还需要进一步验证,将优方案A3B1C1D2与正交表中最好的第6号试验A2B3C1D2作对比试验,得出酶活为424 U/mL,比第6号试验结果高,所以A3B1C1D2为最优方案。
2.3 胰蛋白酶的浓缩

表3 透析前后酶活的变化Table 3 Changes of enzyme activity before and after dialysis
由表3可知,透析24 h后的酶活是药典要求酶活(每1 g胰酶中含胰蛋白酶活力≥600单位)的4.19倍。选择透析袋和聚乙二醇吸水相结合的方式对胰蛋白酶进行浓缩,此方法浓缩效果好,操作简单,经济成本低。
3 结论
胰蛋白酶制备的最佳提取剂为0.15 mo1/L氯化钠,激活剂为0.06%的CaCl2和猪十二指肠,提取pH值为6,提取时间18 h,经透析袋浓缩之后酶活达到2 512 U/mL,是药典要求酶活的4.19倍。本实验提取胰蛋白酶方法简单,通过透析对胰蛋白酶液进行简单的浓缩之后酶活显著提高,经济成本低,应用价值高。通过研究发现,提取出来的成品仍存在其他大分子酶,与其他优秀的研究者提取出的蛋白酶酶活相比还是有很大差距,在寻求提取胰蛋白酶更加经济的方式基础上,酶活仍存在很大的进步空间。期望在以后的学习和工作中能有机会进一步探讨胰蛋白酶的提纯进而提高酶活。

