气煤恒温氧化动力学特性研究
肖 旸,郭 涛,赵婧昱,李青蔚,吕慧菲
(1.西安科技大学 安全科学与工程学院,陕西 西安710054;2.陕西省煤火灾害防治重点实验室,陕西 西安710054)
我国是煤炭生产大国,煤炭自燃火灾十分严重[1-2]。煤自燃的发生和发展是一个极其复杂的动态物理化学变化过程,是氧化反应的自发产生、热量逐渐积聚并最终引起燃烧的过程[3]。国内外学者对煤自燃进行的多方面的研究,目前普遍被学者所接受的煤自燃机理是煤氧复合作用学说,认为煤自燃是煤与氧之间长期的物理和化学复合作用的结果[4],煤与氧从开始接触到最后发生化学反应,在整个反应过程中伴随着氧含量减少以及反应气态产物增加,伴随有吸热和放热发生,并且在煤温越大的情况下氧气浓度越大放热强度越大[5],因此氧气浓度的改变是影响煤自燃的一大因素,成为国内外学者关注的问题之一。朱红青等[6]采用热重分析研究了贫氧浓度条件下,煤样质量变化情况以及活化能的变化情况,发现升温速率越大活化能越小;邓军等[7]采用热重试验分析了气煤在变氧浓度条件下煤样自燃特性及动力学分析,得出在低温阶段氧浓度对表观活化能的影响不大;金永飞等[8]对煤的高温贫氧燃烧特性进行了模拟试验,揭示了贫氧条件下煤自燃过程的温度变化情况和耗氧规律等;Perdochova 等[9]研究煤变氧浓度条件下氧浓度对气体产物的影响;Qi 等[10]通过对煤自燃过程中特征温度的阶段划分,分析氧浓度的变化对煤样的影响。
目前,同步热分析技术已被普遍应用,采用此技术可以精确记录和分析煤氧化分解反应过程中煤的质量变化即反应过程中的TG 曲线,放(吸)热速率的变化即反应过程中的DSC 曲线;同时也可以通过TG 曲线的一阶微分得出煤样在反应过程中的质量变化速率即DTG 曲线,对DSC 曲线进行积分计算得出煤样在反应过程中的放(吸)热量的变化情况,此外,通过对煤样TG-DTG 曲线进行分析可以获得煤自燃的动力学参数[11]。
采用同步热分析技术对气煤进行分析,在不同供氧浓度的条件下,升至不同温度后进行恒温并进行分析,研究煤样在各阶段质量损失变化。通过研究煤氧化过程中的失重(TG)和失重速率(DTG)以及放热速率(DSC),恒温阶段质量变化情况分析,并对吸氧增重阶段和恒温阶段活化能进行计算分析。
1 实验部分
1.1 实验样品的制备
实验选取兖矿集团兴隆庄煤矿3#煤层气煤作为研究煤样,煤样工业分析数据见表1。将采集的块煤进行破碎,筛分出粒径为160~180 目(80~96 μm)的煤样,并置于广口磨沙瓶中,并充氮气保护。
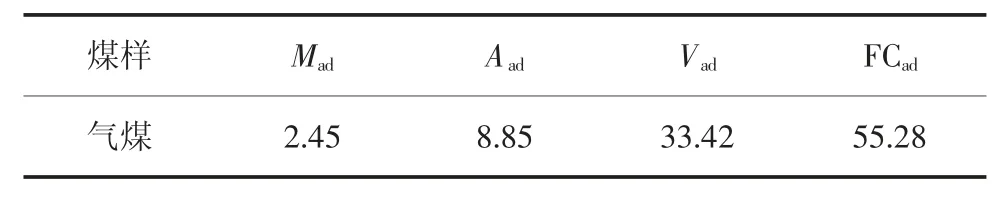
表1 煤样工业分析 %
1.2 实验设备及原理
实验采用德国耐驰公司的STA449F3 同步热分析仪,测试温度范围为0~1 000℃,采用水循环冷却天平和炉体。此设备主要由支架、炉体、水循环和计算机控制系统组成。支架上布置有高精度的热天平,天平两端分别放置样品坩埚和参比坩埚,实验过程中通过实时测量样品在升温过程中的重量变化,对温度(时间)与质量作图后即可得到TG 曲线;此外,样品坩埚与参比坩埚下两侧连有热电偶,实时监测样品坩埚和参比坩埚之间的温差,并将其转换为热流信号差,通过对时间与热流率作图后得到DSC 曲线;通过对TG 曲线进行微分可以得到DTG曲线,即根据TG 曲线计算得出样品的质量变化率。
1.3 实验条件
称取适量的煤样(约10 mg)放入实验仪器,分别通入含氧体积分数分别为5%、21%的气体,并且采用5℃/min 的升温速率进行实验,控制温度由室温分别升温至200、300、400 °C,通气量恒定保持在100 mL/min,升温结束后进行恒温90 min。
2 热重分析
2.1 升温阶段质量变化规律
实验升温至400℃之后装置恒温90 min,因此400℃之后的氧化燃烧反应不做研究,同时选取升温至400℃的曲线进行分析。气煤在氧气浓度为5%和21%时升温至400℃的TG 和DTG 曲线图如图1。煤样升温过程的阶段划分见表2,煤样升温过程中5%和21%氧浓度下各阶段质量变化情况见表3。

图1 氧浓度5%和21%的TG、DTG 曲线图
由图1 和表2、表3 进行分析得出,TG 曲线中,氧气浓度为5%和21%的条件下,煤样由常温至46.4℃均处于吸附增重阶段,质量增长均为1.3%,此阶段主要是以物理吸附为主,煤样氧化方式不具有选择性,由于温度过低煤氧复合强度较弱,氧气的物理吸附量大于煤氧化学反应产生气体的逸出量导致质量的缓慢增加,可以看出在此阶段氧浓度的变化对煤样影响不大;当温度由46.4℃升至103.1℃时,煤样在氧气浓度为5%和21%的情况下均处于水分蒸发阶段,由于水分受热蒸发,质量开始缓慢下降,当氧气浓度为5%时质量损失0.95%,氧气浓度为21%时质量损失0.94%,主要是因为在此阶段煤样水分的蒸发量高于气体吸附量导致了质量的减少,并且随着氧浓度的增大,质量损失量减少,在此阶段前期会有较小的吸氧增重反应,从而使得氧浓度越大质量损失量越少;当氧气浓度为5%时,温度由103.1℃升温至294.9℃时煤样处于吸氧增重阶段,此阶段主要以化学吸附为主,质量增长1.51%,而氧气浓度为21%时,吸氧增重阶段为103.1℃升温至290.9℃,质量增长2.87%,随着温度的上升,氧浓度越大反应越快,当氧浓度增大时,质量增加量变大,主要是因为此阶段内氧气的化学吸附量大于煤氧化学反应产生气体的逸出量导致质量开始增大,从而使得氧浓度越大质量增长越多;在氧浓度为5%时,温度由294.9℃升至400℃处于氧化/热解阶段,质量损失3.07%,氧气浓度为21%时,温度由290.9℃升至400℃处于氧化/热解阶段,质量损失6.96%,这一阶段主要以化学反应为主,氧气的化学吸附量小于煤氧化学反应产生气体的逸出量导致质量开始减少,并且随着氧浓度的增大反应越剧烈,产生的气体量越大,质量损失明显。通过上述分析得出煤样在低温氧化过程的主要是以气体吸附阶段、水分蒸发阶段、吸氧增重阶段和氧化/热解阶段为主,实验结果也表明氧气直接影响了气煤的低温热反应,并且在此过程中对煤样的质量变化起到了重要作用。

表2 煤样升温过程各阶段温度范围划分

表3 氧浓度5%和21%下各阶段质量变化量
氧浓度的改变不仅会影响煤样的质量变化量,同时也会影响煤样质量变化速率。由常温升至189.7℃时,煤中活性分子较少,对氧的需求量不大,即使是在氧浓度为5%时也相对充足,在此阶段阶段内,氧浓度为5%和21%条件下煤样质量变化速率差异较小;由189.7℃升至400℃时,煤样活性分子较多,对氧的需求量相对较大,在此阶段内,氧浓度为5%和21%条件下煤样质量变化速率差异较大。
2.2 升温阶段放热量变化情况
煤样在升温过程中,在前期阶段的热量变化情况是相同的,因此选用400℃的DSC 曲线进行放热量的计算。气煤在氧气浓度为5%和21%时升温阶段DSC 曲线对比图如图2。

图2 氧浓度5%和21%,400℃DSC 曲线图
由图2 进行积分可以计算出,煤样在不同氧浓度情况下升温阶段热量变化情况(表4)。

表4 煤样升温阶段热量变化情况
由上述分析发现,煤样在升温过程中,在吸附阶段和水分蒸发阶段,氧浓度的改变对煤样吸热量的影响不大;但随着温度的升高,在吸氧增重阶段和氧化/热解阶段,煤样中活性基团增多,氧气供给越充足,煤中的官能团越能较快的与氧反应并放出热量。因此,氧浓度为21%比氧浓度为5%时反应越剧烈放出的热量越多。
2.3 恒温阶段质量变化规律
主要选取气煤在2 种不同氧浓度情况下,200、300、400℃在恒温阶段的质量变化规律。不同氧气浓度、不同恒定温度下的失重曲线如图3。煤样在不同条件下,恒温阶段质量变化率见表5。
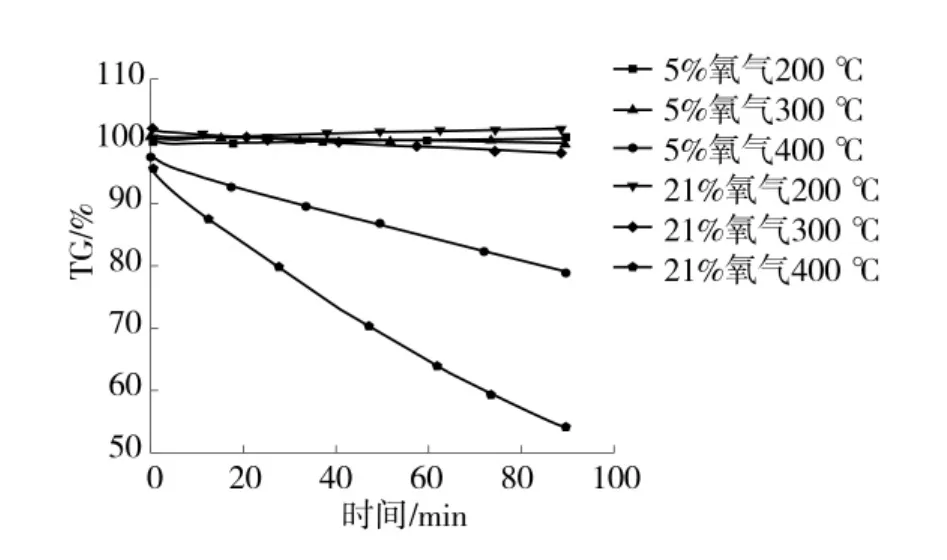
图3 氧浓度5%和21%的恒温失重曲线

表5 不同条件下恒温阶段煤样质量变化率
通过表5 可以得出,在200℃时质量有少量的增加,主要是因为煤样达到200℃时正处于吸氧增重的初始阶段主要以煤对氧的化学吸附为主,从而造成了质量的少量增加,氧气浓度为21%时,质量变化量越大。在300℃和400℃恒温氧化时煤的质量逐渐降低,特别是温度在400℃,氧浓度为21%时,质量损失量越多;从图1 中可以看出,该阶段处于氧化/热解失重阶段,主要是由于煤样在受热后其结构中相应的化学键会发生断裂,例如脂肪侧链,含氧官能团,以及低分子化学键的裂解,同时产生大量新的活性位点,氧气浓度越高煤样发生反应越剧烈,当温度保持恒定后反应所产生的物质会继续受热发生反应。
2.4 恒温阶段放热量变化情况分析
气煤在氧气浓度为5%和21%时恒温阶段DSC曲线对比图如图4~图6。

图4 氧浓度5%和21%,200℃DSC 曲线图

图5 氧浓度5%和21%,300℃DSC 曲线图

图6 氧浓度5%和21%,400℃DSC 曲线图
由图4~图6 可以对不同氧浓度和温度条件下DSC 曲线进行积分,求得的恒温阶段热量变化情况见表6。

表6 煤样恒温阶段热量变化情况
由表6 可以看出,恒温氧化时,在同一温度下,氧浓度为21%时比氧浓度为5%时放热量大,主要是由于温度和氧浓度的增大煤样越容易进行反应并放出热量,造成了放热量的增大;同时结合图3 可以看出,恒温过程中煤样仍在较长一段时期内发生反应,并放出较大的热量。
3 活化能计算
活化能代表反应物的分子由初始稳定状态变为活化分子所需吸收的能量[12]。活化能比着火温度更能从本质上描述煤的着火性能,选取吸氧增重阶段和恒温阶段进行活化能的计算。
煤氧化动力学的研究主要在建立反应过程中的速率方程的基础上,通过测试反应过程中的物理量变化,计算反应动力学参数,主要包括反应速率、指前因子、活化能和反应级数等[13]。活化能的计算基本可分为积分法和微分法。微分法需要使用试样反应过程的值,但值一般精度较低。活化能可以作为划分煤自燃倾向性的重要指标[14],因此采用Coats-Redfern[15]积分法计算煤样在吸氧增重阶段的活化能,如式(1):

式中:G(α)为煤氧化反应机理函数模型积分函数;T 为热力学温度,K;A 为指前因子,K/s;E 为活化能,kJ/mol;R 为气体普适常数,取8.314 J/(mol·K);β 为升温速率,℃/min。
根据热重曲线求得转化率α 如式(2):

式中:W0为增(失)重开始质量,mg;Wt为t 时刻的质量,mg;W∞为增(失)重终止时的质量,mg。
煤与氧气反应为化学一级反应[16-17],选取n=1,反应机理积分函数G(α)=-ln(1- α)。将次反应机理积分函数代入式(1)计算得出并以此对1/T 进行做图,然后对曲线进行线性拟合,其中斜率为-E/R,可计算出活化能Ea。升温阶段ln|G(α)/T2|与1/T 关系曲线图如图7。

图7 氧浓度5%和21%,ln|G(a)/T2|与1/T 关系曲线
选取传统的lnln 法[18-19]计算恒温阶段的活化能。
由质量作用定律,反应动力学方程为:

式中:f(a)为反应机理函数;k 为反应速率常数;反应机理函数f(a)取:f(a)=(1-a)n,因为煤与氧气反应为化学一级反应,反应能级n=1;t 为时间。
根据Avrami-Erofeev 公式可得:

通过方程(4)中的ln[-ln(1-a)]对lnt 作图,通过截距求得lnk。在通过式(5)中的lnk 对1/T 的直线关系,利用斜率即可求出恒温阶段的活化能Ea。恒温阶段lnk 与1/T 关系曲线图如图8。
根据所得数据计算得出不同条件下煤样活化能的变化情况,采用Coats-Redfern 和lnln 动力学计算方法计算出的对应表观活化能Ea见表7。
通过表7 可以看出,煤样在吸氧增重阶段和恒温阶段,氧浓度为21%的活化能较氧浓度为5%的活化能大,这是由于氧浓度为21%时,煤分子内更多被激活的活性基团与氧分子进行反应[20],这些活性基团要被激活需要更多的能量,导致了煤样的活化能随之增大。
4 结 论
1)在持续升温过程中,吸附增重阶段和水分蒸发阶段氧浓度的改变对质量变化影响较小;在吸氧增重和氧化/热解阶段,氧浓度为21%较氧浓度为5%时煤样质量变化更为明显;煤样由常温升至189.7℃时,氧浓度为5%和21%条件下煤样质量变化速率差异较小;煤样由189.7℃升至400℃时,氧浓度为5%和21%条件下煤样质量变化速率差异较大。此外,在吸附增重阶段和水分蒸发阶段,煤样有一定的吸热过程,氧浓度为21%的条件下,煤样放热量较高。
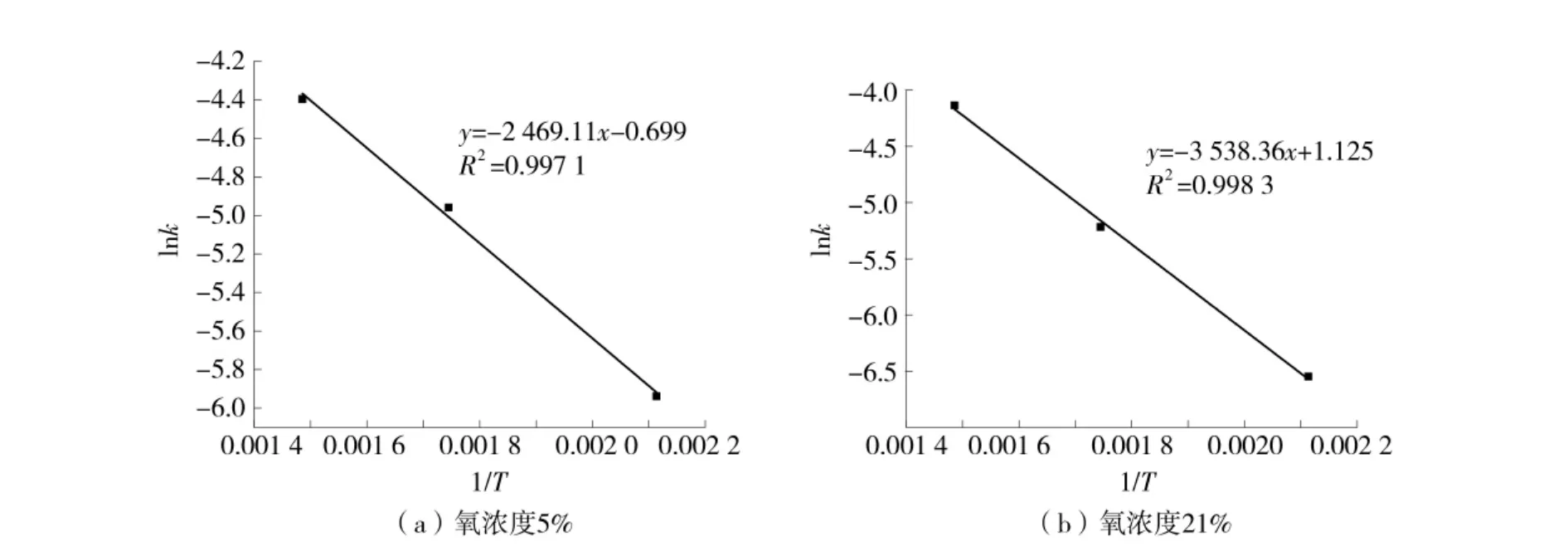
图8 氧浓度5%和21%,lnk 与1/T 关系曲线

表7 不同条件下煤样表观活化能Ea
2)气煤在200℃和300℃恒温氧化时,煤样反应较为平稳,对质量变化影响较小,质量变化量在3.82%之内;400℃恒温氧化时,煤样发生剧烈的化学反应,致使质量急剧减少,在氧浓度为21%的条件下煤样质量变化较大,变化量达到40.43%;此外,随着恒温温度的升高,氧浓度为21%时煤样放热量较氧浓度为5%时的放热量大。
3)基于Coats-Redfern 和lnln 法,分别在低温阶段对氧浓度为5%和21%条件下,煤样在吸氧增重阶段和恒温阶段进行了活化能计算,得出煤样在5%氧浓度下更容易发生氧化反应。

