联苯代谢对微生物的生长胁迫及分裂抑制
杨秀清,刘亚妮
联苯代谢对微生物的生长胁迫及分裂抑制
杨秀清*,刘亚妮
(山西大学生物技术研究所,化学生物学与分子工程教育部重点实验室,山西 太原 030006)
以联苯/多氯联苯降解菌株R04(sp. R04)和几种模式微生物为研究对象,利用高效液相色谱、荧光显微镜、扫描电子显微镜等分析微生物在联苯及其代谢物培养条件下细胞分裂和形态的变化.结果表明联苯及其代谢产物对红球菌R04和几种模式微生物细胞的分裂有抑制作用,并对部分微生物形态有影响.与前体-联苯及其代谢产物2-羟基-6-酮基-6-苯基-2,4-己二烯酸相比, 2,3-二羟基联苯对G+、G-细菌,或是酵母细胞分裂都有较强的抑制和形态的改变. 2,3-二羟基联苯导致. R04和缺陷型. R04细胞形成不完整隔膜的比例增加;造成96.4%的大肠杆菌BL21细胞表面凹陷,胞质内容物流失,菌体体积缩小;导致枯草芽孢杆菌89.6%的细胞体积明显缩小;导致金黄色葡萄球菌基本没有细胞能形成完整的分裂隔膜;导致红酵母细胞能进行出芽生殖的比例从64.2%降低到19.3%,但对其细胞形态无明显改变.联苯代谢物2,3-二羟基联苯对红球菌R04及其它微生物细胞分裂和增殖的抑制作用比其前体-联苯强,建议在研究环境化合物与微生物互作时,应考虑环境化合物代谢的毒性效应.
联苯代谢;红球菌R04;细胞分裂;环境化合物
芳香烃及其衍生物是一类较为常见的环境化合物,其中包括联苯和多氯联苯(PCBs)[1],其理化性质极为稳定,并被广泛应用于工业生产[2].然而联苯和PCBs都有很强的毒性,能够长期稳定的存在于环境中,对人类健康及生态环境具有很大的危害性[3-5].红球菌R04(sp. R04)是一株可以有效降解联苯/PCBs的革兰氏阳性细菌[6],和伯克霍尔德氏菌、假单胞菌、红球菌RHA1等具有相同的联苯/PCBs的代谢酶系.在联苯/PCBs代谢过程中,联苯首先被联苯双加氧酶氧化为2,3-二氢二羟基联苯,继而在2,3-二氢二羟基联苯脱氢酶作用下形成2,3-二羟基联苯(DHBP);DHBP在第二个双加氧酶作用下产生黄色的开环产物2-羟基-6-酮基-6-苯基-2,4-己二烯酸(HOPDA),该产物被水解为苯甲酸;最后通过粘糠酸途径被降解[7-9].
当有机体接触联苯、PCBs等环境化合物时,这些化合物对有机体的生长发育会造成一定程度的影响.例如PCBs会改变伯克氏菌的比表面,引起细胞轻微的质壁分离[10],同时会抑制芽孢杆菌属,假单胞菌属,微球菌属和沙雷氏菌属细菌的生长[11].联苯和PCBs等化合物不仅能够抑制细菌细胞的生长,而且对动植物也产生毒副作用.有研究报道曾吃过被PCBs污染的鱼类的女性分娩的儿童记忆力、注意力以及智商下降,表明这些化合物对发育中的胎儿大脑有强烈的副作用[12],而且Berg等[13]研究发现,PCBs、二苯并呋喃(PCDFs)使鸬鹚的繁殖率降低,后代重量减轻.同时还发现高含量的PCBs可使绦柳叶片白化,茎秆次生结构受到抑制,根细胞内含物减少,根系细胞受到不同程度的破坏[14].
本课题组前期对红球菌R04降解联苯/PCBs的能力做了大量研究,发现卤代联苯环上不同取代元素以及取代元素的数量、位置对其降解产生较大影响[15];同时发现联苯/PCBs代谢过程中,. R04的分裂方式没有受到影响[16],但联苯/PCBs会导致. R04细胞不能形成完整的分裂隔膜,进而导致分裂受阻,细胞呈现丝状化[17].目前国内外的研究主要集中于环境化合物本身对微生物生长和分裂的影响,很少有学者研究环境化合物中间代谢物对微生物的分裂、增殖和发育是否产生影响,本文中. R04代谢联苯/PCBs过程中会形成多种中间代谢物,究竟是哪种代谢物或是联苯影响了. R04的生长和分裂尚不清楚.因此,本文分别用联苯及其代谢物DHBP和HOPDA培养. R04、代谢酶缺陷型. R04,通过显微和超显微观察细胞来确定影响. R04生长和分裂的物质.其次,选择大肠杆菌BL21、枯草芽孢杆菌WB600、金黄色葡萄球菌、红酵母来探究联苯及其代谢物对其它微生物细胞生长和分裂的影响,为探讨环境化合物代谢与微生物的互作研究奠定基础.
1 材料和方法
1.1 菌株、培养基和生长条件
实验所用的红球菌R04、代谢酶缺陷型红球菌R04(联苯双加氧酶缺失的菌株命名为. R04△A,2,3-二羟基联苯-1,2双加氧酶缺失的菌株命名为. R04△C,2-羟基-6-酮基-6-苯基-2,4-己二烯酸水解酶缺失的菌株命名为. R04△D)、大肠杆菌BL21、枯草芽孢杆菌WB600、金黄色葡萄球菌、红酵母均由本实验室保存.所用培养基为基础矿物培养基、LB液体培养基和YPD培养基.
培养基配方具体如下,基础矿物培养基(1L): KH2PO4,2.93g;K2HPO4·3H2O,5.87g;MgSO4·7H2O,0.3g;FeSO4·7H2O,0.01g;NaCl,0.2g;(NH4)2SO4,5g;NiSO4·7H2O, 0.006g;CaCl2,0.03g;丁二酸钠,1g;微量元素盐溶液200µL.微量元素溶液(1L):Na3-Citrate·2H2O,0.18g; FeSO4·7H2O,0.034g;CoCl2·6H2O,0.005g;Na2MoO4·2H2O,0.005g;CuSO4·5H2O,0.004g;MnCl2·4H2O,0.002g;ZnCl2, 0.003g;H3BO3,0.002g.分别在基础矿物培养基中加入葡萄糖、联苯及其代谢物作为碳源.LB液体培养基(1L):胰蛋白胨10g,酵母膏5g,氯化钠5g,加水定容至1L.YPD液体培养基(1L):胰蛋白胨20g,酵母膏10g,葡萄糖20g,加水定容至1L.
红球菌R04分别接种于基础矿物培养基和LB液体培养基中,30℃,200r/min恒温震荡培养;大肠杆菌BL21、枯草芽孢杆菌WB600、金黄色葡萄球菌接种于LB液体培养基中37℃,200r/min恒温震荡培养;红酵母接种于YPD液体培养基中30℃, 200r/min恒温震荡培养.
1.2 主要试剂和仪器
联苯购于军事医学科学院试剂站,戊二醛购于上海生工生物工程有限公司,DHBP购于日本Wako和光纯药工业株式会社,细胞膜染料FM1-43购于北京海德生物技术有限公司,其他化学试剂购于太原市津海有限公司;恒温震荡培养箱2HWY-200D购于上海智城分析仪器制造有限公司,日立UV- 2010分光光度计购于Hitachi Instruments公司,高效液相色谱仪Waters 2487购于美国Waters公司,Delta Vision Deconvolution microscope购于美国Delta Vision公司,日立扫描电子显微镜SU1510购于Hitachi Instruments公司.
1.3 红球菌R04细胞的共代谢
1.3.1 生物量测定及代谢分析,分别在10mmol/L联苯中添加0,2,4和6mmol/L葡萄糖共同培养. R04野生型,每隔4h取培养液测定OD600值.取培养液加入等体积色谱级甲醇,混匀后离心取上清即为总代谢物.另取培养液通过无菌纱布过滤除去联苯颗粒后离心收集菌体,用磷酸缓冲液PBS(20mmol/L, pH 8.0)洗涤菌体,然后用等体积色谱级甲醇抽提,离心取上清即为胞内代谢物.
将上述制备的待测样品经高效液相色谱仪分析[18],上样量为10µL,采用外标法定量.该检测过程使用C18色谱柱,流动相使用体积比9:1的甲醇与水混合液,流动相以1.0mL/min的速度洗脱,在254nm波长条件下检测.
分别在基础矿物培养基中添加联苯,DHBP, HOPDA培养R04△A,R04△C,R04△D,并添加1/3葡萄糖(3.3mmol/L)提供碳源和能源维持细胞的生长,每隔4h取样测定OD600值,绘制生长曲线.
1.3.2 数据统计分析,胞外代谢物等于总代谢物减去胞内代谢物.生物量测定及代谢测定实验均重复3次,以3次重复平均值作为最后结果.
1.4 荧光显微镜观察
将10mmol/L的葡萄糖,联苯,DHBP和HOPDA作为碳源培养红球菌R04、代谢酶缺陷型红球菌R04(培养时添加3.3mmol/L葡萄糖维持细胞生长)、大肠杆菌BL21、枯草芽孢杆菌WB600、金黄色葡萄球菌、红酵母,培养至指数前期取适量菌液,8000r/ min离心5min收集菌体,PBS洗涤菌体2次;重悬后加入膜染料FM1-43(终浓度为0.1 µg/mL)避光染色5min;离心弃上清,PBS洗涤菌体2次,然后用适量PBS悬浮菌体.取上述染色菌液15µL制片,通过Delta Vision去卷积荧光显微镜观察.
1.5 扫描电子显微镜观察
6种微生物细胞培养至指数前期的方法同1.4,然后取适量菌液用2.5%戊二醛前固定,1%锇酸后固定,乙醇逐级脱水,制片后置于60℃恒温箱干燥,镀膜,扫描电子显微镜下观察细胞形态.
2 结果分析
2.1 红球菌R04联苯代谢分析
2.1.1 联苯培养下红球菌R04的代谢分析,为了研究在葡萄糖存在的情况下,红球菌R04是否还会降解联苯,本文用联苯和不同浓度葡萄糖共同培养. R04,结果显示:添加葡萄糖后,. R04生长速率加快,但不会显著提高其生物量(图1a).添加葡萄糖并不会影响细胞对联苯的代谢,4种培养条件下细胞外联苯浓度均降低,细胞内联苯浓度呈现波动但整体为下降趋势,且葡萄糖浓度对联苯代谢速率影响不大(图1b和c).表明葡萄糖存在时. R04仍会降解联苯,该条件可以用于后续实验.
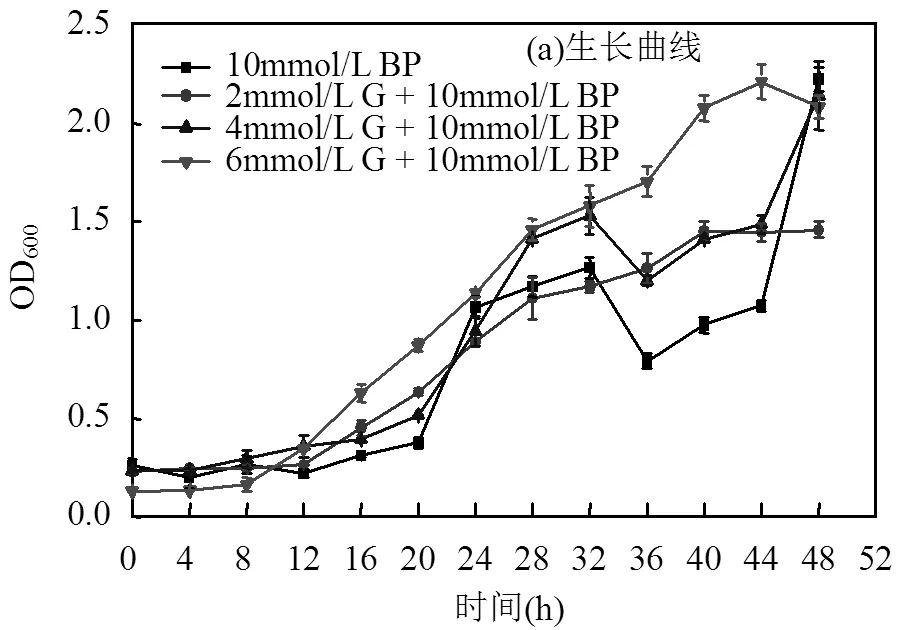
G为葡萄糖,BP为联苯
2.1.2 联苯及其代谢物培养下代谢酶缺陷型红球菌R04的生长,代谢酶缺陷型红球菌R04不能利用联苯及其代谢物产生能量供其生长,所以需要添加额外的碳源.本文用1/3葡萄糖和相应代谢物共同培养缺陷型. R04,发现细胞都可以生长,但是. R04△C细胞的生长量明显低于. R04△A和. R04△D(图2),说明联苯代谢物DHBP对. R04△C的生长产生抑制作用.
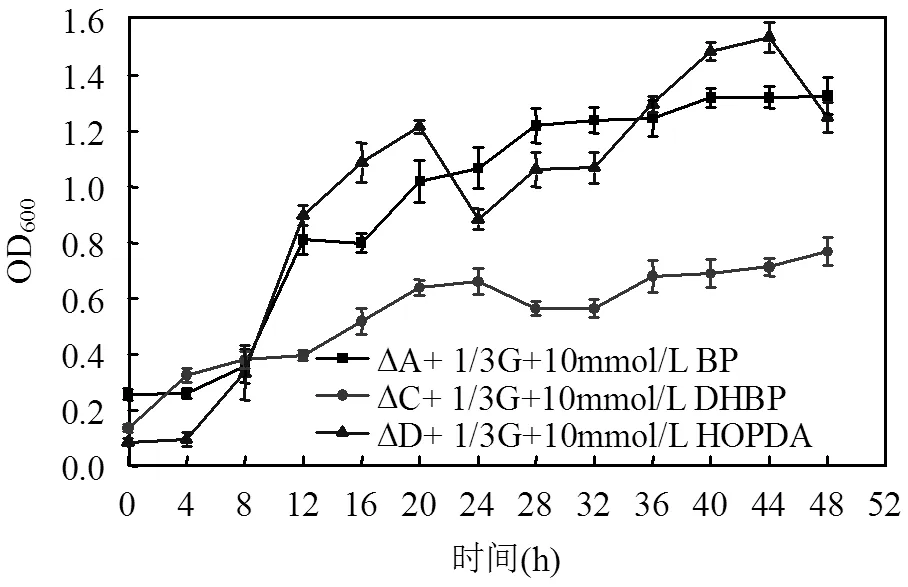
图2 缺陷型红球菌R04生长曲线
2.2 联苯及其代谢物对红球菌R04分裂的抑制
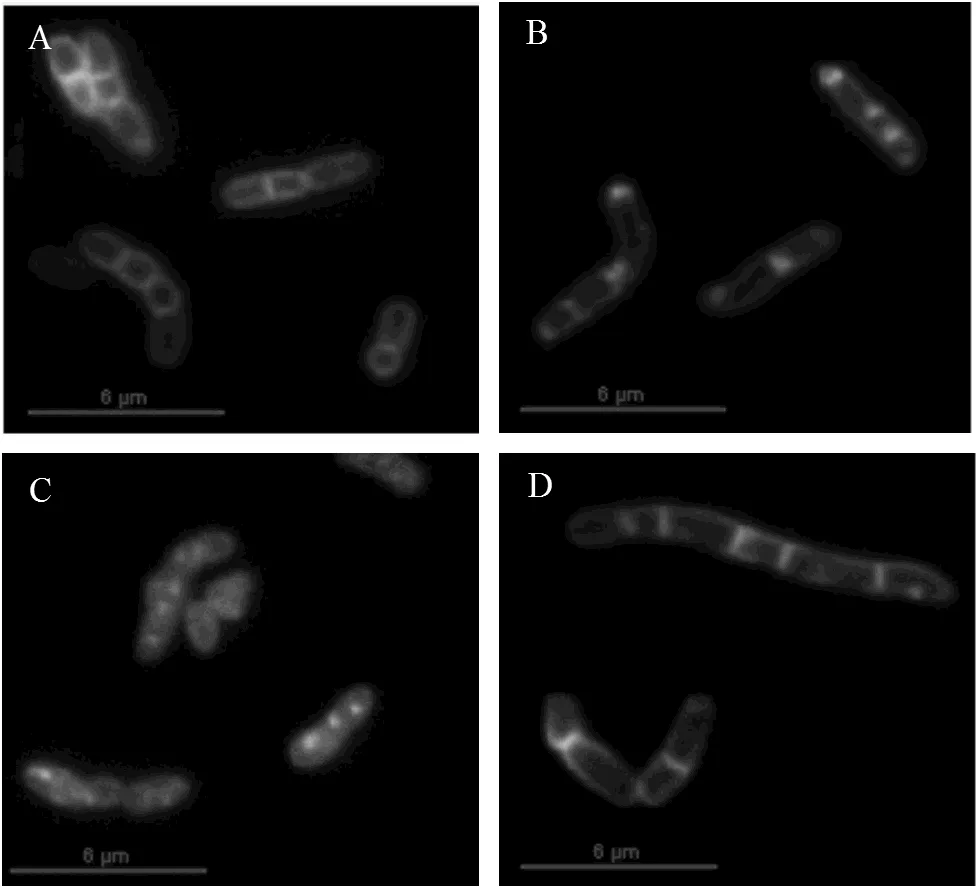
图3 红球菌R04荧光显微镜图
A-D, exponential phaseR04 wild type cultured with glucose, biphenyl, DHBP and HOPDA in basic mineral medium, respectively.
分别用10mmol/L的葡萄糖,联苯,DHBP和HOPDA为碳源的基础矿物培养基培养红球菌R04,取指数前期细胞经FM1-43染色后进行荧光显微镜观察,如图3所示.在葡萄糖和HOPDA为碳源培养条件下,可以观察到. R04细胞膜清晰,形成完整的分裂隔膜(图3A和D);联苯培养的. R04细胞分裂隔膜不完整,细胞质中有荧光斑点形成(图3B);而DHBP培养的. R04细胞边界模糊,细胞膜荧光强度基本与细胞质相同,大量荧光斑点聚集在细胞质中,看不到完整的分裂隔膜(图3C).SEM结果显示,联苯培养的细胞(图4B)端部或一侧出现肿胀小结,图中红色箭头指示细胞出现肿胀小结的位置;而生长于葡萄糖中的细胞(图4A)正常分裂.. R04在代谢联苯的过程中会生成代谢物DHBP,所以推测DHBP影响了. R04细胞分裂隔膜的形成,进而影响细胞的正常分裂.
A and B exponential phaseR04wild type cultured with glucose and BP, respectively
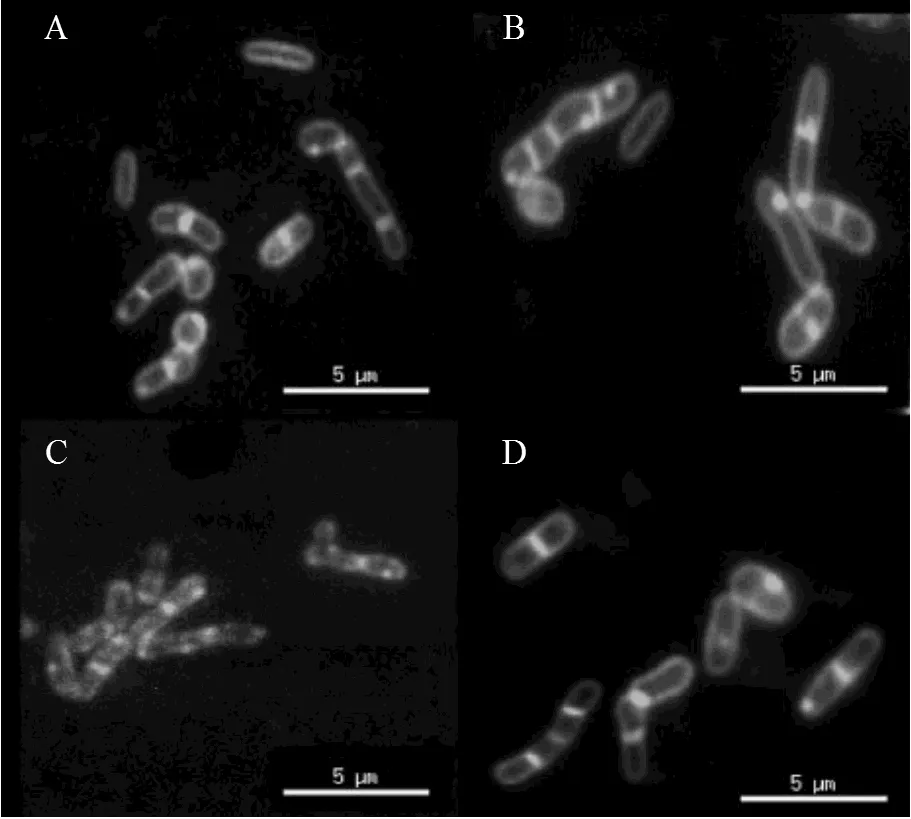
图5 红球菌R04荧光显微镜图
A-D, exponential phaseR04 wild type cultured with glucose, biphenyl, DHBP and HOPDA in LB medium, respectively
分别用含10mmol/L的葡萄糖,联苯,DHBP和HOPDA的LB培养基培养红球菌R04,取指数前期细胞经FM1-43染色后进行荧光显微镜观察,如图5所示.在LB和HOPDA(图5A和D)培养条件下,可以观察到. R04细胞膜清晰完整,能形成完整的分裂隔膜,而添加联苯(图5B)后,细胞质中有荧光斑点产生;而DHBP处理后的. R04细胞(图5C)膜荧光强度着色不均,无法形成完整的分裂隔膜.所以推测无论在基础培养基中还是LB培养基中,添加联苯代谢物DHBP都会影响. R04细胞的分裂.
2.3 联苯及其代谢物对代谢酶缺陷型R. R04分裂的抑制
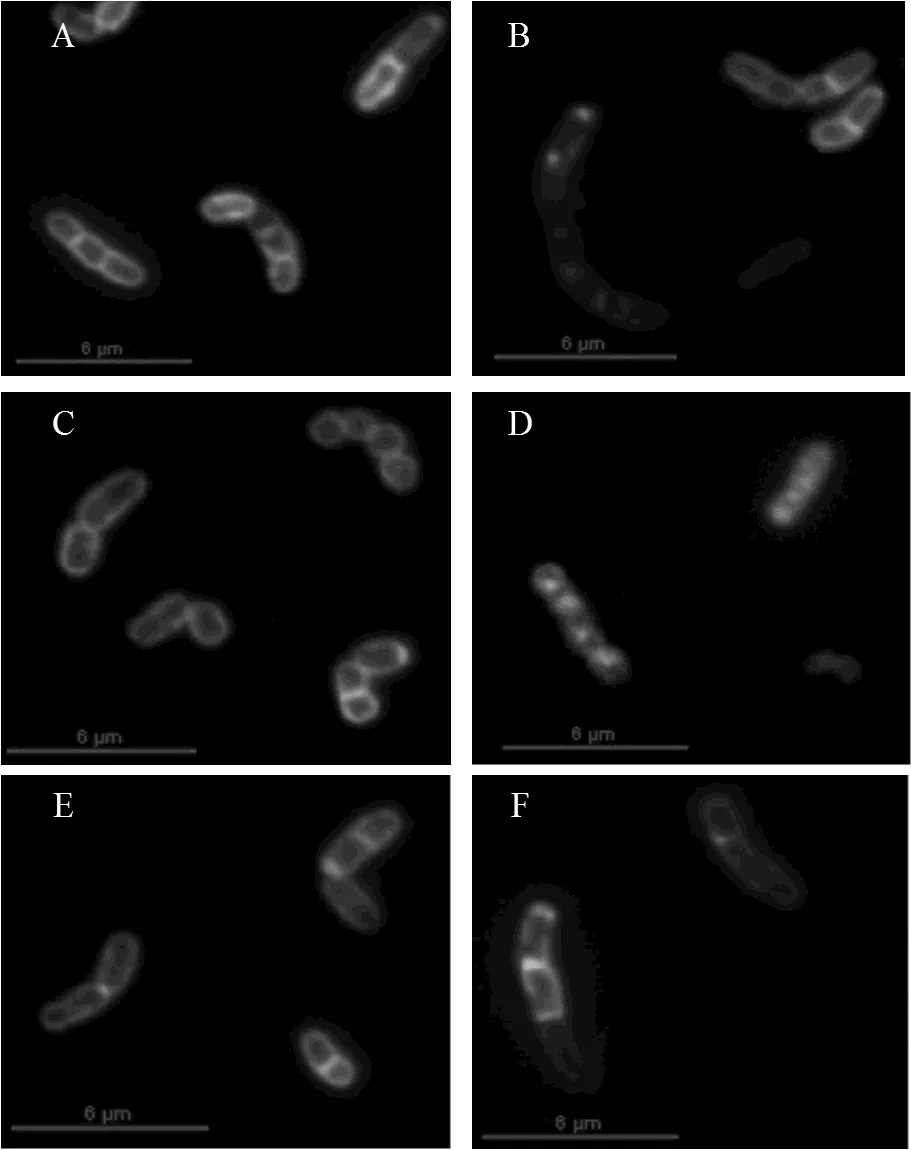
图6 缺陷型红球菌R04荧光显微镜图
A and B, exponential phase. R04 △A cells cultured with glucose and biphenyl. C and D, exponential phase. R04 △C cells cultured with glucose and DHBP. E and F, exponential phase. R04△D cells cultured with glucose and HOPDA
为了进一步研究是哪种物质影响了红球菌R04细胞分裂隔膜的形成,本文用相应的代谢物培养红球菌R04缺陷型(同时加入葡萄糖保持细胞生长),取指数前期细胞经FM1-43染色后进行荧光显微镜观察.由图6可看出,用联苯培养. R04△A(图6B)和用HOPDA培养. R04△D(图6F)与用葡萄糖培养相比(图6A和E),. R04△A和. R04△D细胞分裂隔膜清晰可见,能进行正常分裂.而DHBP培养. R04△C(图6D)与葡萄糖培养(图6C)相比差别很大,细胞边界模糊不清,细胞膜与细胞质着色程度相同,看不到清晰完整的分裂隔膜,细胞质中有荧光斑点形成.经过SEM观察得出,葡萄糖培养的. R04△A(图7A)和HOPDA培养的. R04△D(图7D)细胞表现正常;当用联苯培养. R04△A(图7B)时,有个别细胞端部或一侧出现肿胀小结,而用DHBP培养. R04△C(图7C)时,出现肿胀小结的细胞数量增多,图中红色箭头指示细胞出现肿胀小结的位置.结果表明DHBP为主要影响. R04细胞分裂隔膜形成的物质,进而影响细胞的正常分裂.

A and B, exponential phase. R04△A cultured with glucose and biphenyl. C, exponential phase. R04△C cultured glucose and DHBP. D, exponential phase. R04△D cultured glucose and HOPDA. E, partial enlarged view of C
为了进一步研究DHBP对. R04△C的影响,我们选取0.01、0.03、0.05、0.1、0.3、0.5、1mmol/L DHBP去处理. R04△C细胞,并添加1/3葡萄糖维持. R04△C的生长,取指数前期细胞经FM1-43染色后进行荧光显微镜观察,结果如图8所示:在葡萄糖培养条件下细胞分裂隔膜完整,清晰可见(图8A);在0.01mmol/L DHBP作用下细胞内开始出现粘附的荧光斑点(图8B),随着DHBP浓度的增大,荧光斑点增多,细胞丝状化明显,说明低浓度DHBP也导致细胞不能形成完整的分裂隔膜,影响细胞的正常分裂.
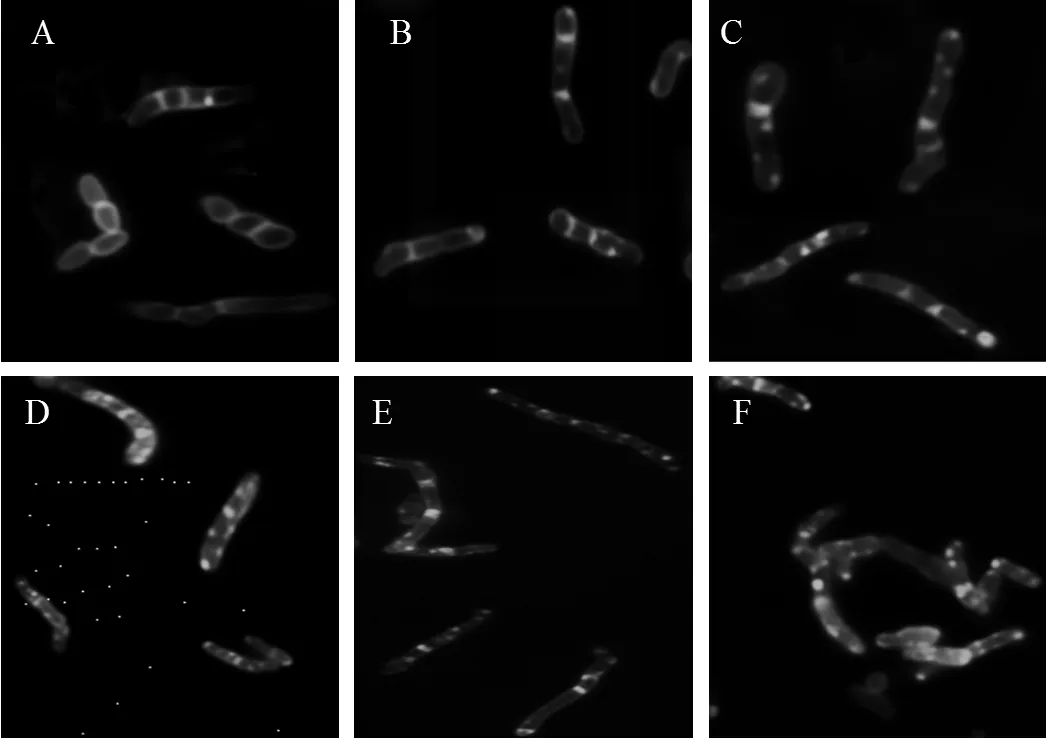
图8 R. R04△C荧光显微镜图
A, exponential phase. R04△C cultured with glucose. B~F,exponential phase. R04△C cultured with glucose and 0.01、0.03、0.05、0.1、0.3mmol/L DHBP, respectively
2.4 联苯及其代谢物对其它微生物细胞分裂的影响
2.4.1 联苯及其代谢物对大肠杆菌BL21分裂的影响,选择革兰氏阴性细菌的代表大肠杆菌作为研究对象,分别在LB液体培养基中添加10mmol/L联苯,DHBP和HOPDA培养大肠杆菌,取指数前期细胞经FM1-43染色后进行荧光显微镜观察.如图9所示,在所有培养条件下大肠杆菌细胞膜着色明显,能看到清晰并完整的分裂隔膜,但DHBP培养的细胞(图9C)体积明显小于其它3种情况.通过SEM图可看出,生长于LB和联苯培养基中的大肠杆菌(图9E和F)形态完整,为短杆状,能明显看出二分裂的生殖方式;经DHBP处理后,细胞(图9G)生长受到严重阻滞,细胞发生凹陷,胞质内容物流失,但细胞膜相对完整,这种结果的产生机制目前尚不清楚,需要进行更深入的研究.
2.4.2 联苯及其代谢物对枯草芽孢杆菌WB600分裂的影响,选择革兰氏阳性细菌枯草芽孢杆菌WB600作为研究对象,分别在LB液体培养基中添加10mmol/L联苯,DHBP培养枯草芽孢杆菌,取指数前期细胞经FM1-43染色后进行荧光显微镜观察,如图10所示.对照组中的枯草芽孢杆菌(图10A)分裂正常,能形成完整的分裂隔膜;用联苯处理后枯草芽孢杆菌(图10B)部分细胞发生丝状化,比正常细胞长约2~3倍;而用DHBP处理后细胞(图10C)体积明显缩小,生长缓慢,而且不能形成完整的分裂隔膜.通过SEM图10也证明了这一结论.
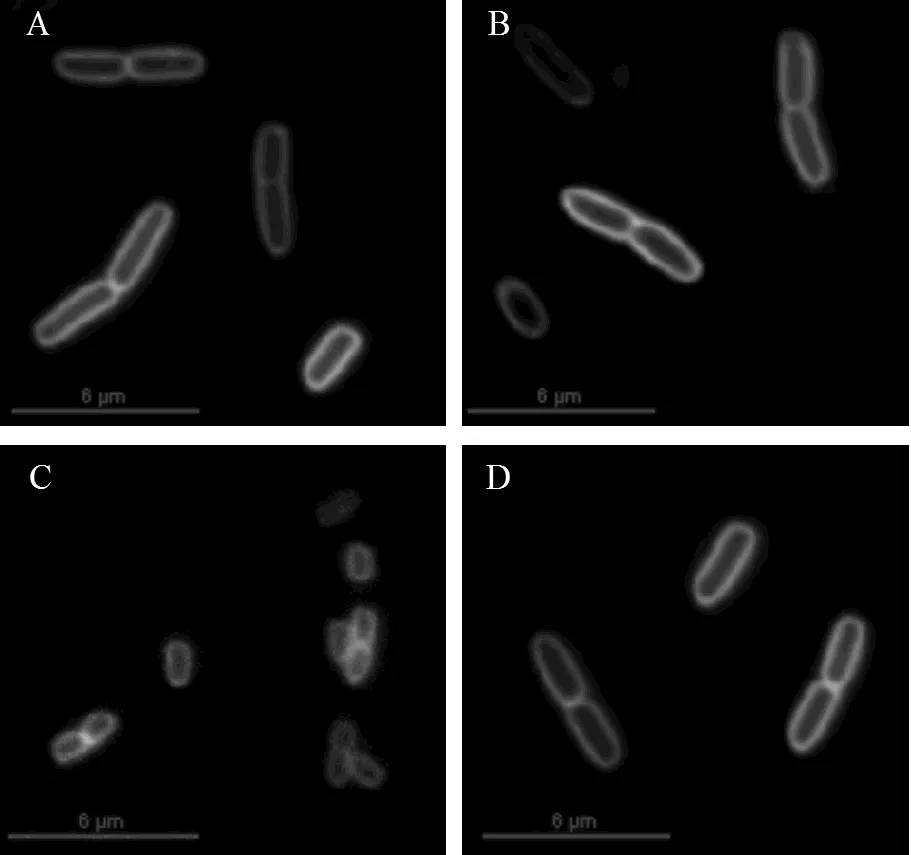
E-G: Scanning electron micrograph ofBL21, exponential phase cells cultured with LB, biphenyl, DHBP, respectively
2.4.3 联苯及其代谢物对金黄色葡萄球菌分裂的影响,选择金黄色葡萄球菌作为研究对象,分别在LB液体培养基中添加10mmol/L联苯,DHBP培养金黄色葡萄球菌,取指数前期细胞经FM1-43染色后进行荧光显微镜观察如图11所示.对照组(图11A)和联苯培养的金黄色葡萄球菌(图11B)细胞膜着色明显,形成完整分裂隔膜的细胞较多,而用DHBP处理后的细胞(图11C)几乎不能形成分裂隔膜,表明DHBP影响金黄色葡萄球菌的生长和分裂.SEM图结果显示:用DHBP处理过的金黄色葡萄球菌(图11F)有些细胞从球状变成了不规则的哑铃状;对照组(图11D)和联苯(图11E)处理的金黄色葡萄球菌能形成完整的分裂隔膜,细胞能正常分裂.图11D和E红色箭头指示的椭球状细胞表示能形成完整分裂隔膜,即将进行细胞分裂.
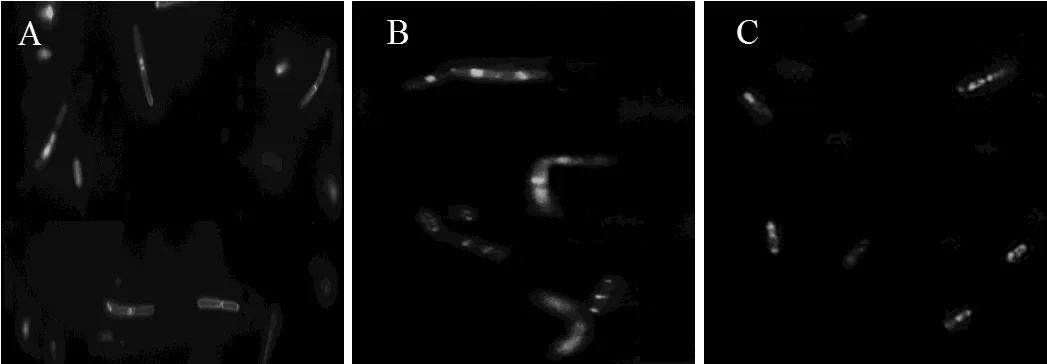
D-F: Scanning electron micrograph ofWB600, exponential phase cells cultured with LB, biphenyl, and DHBP, respectively
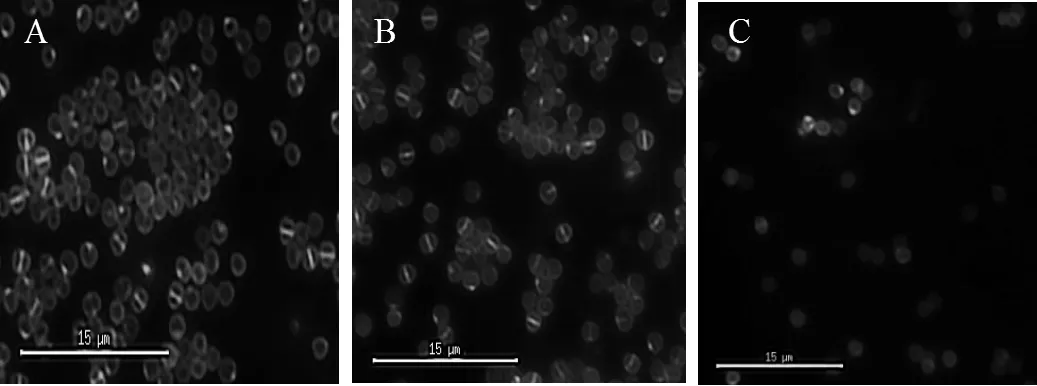
D-F: Scanning electron micrograph of, exponential phase cellswith LB, biphenyl, and DHBP, respectively
2.4.4 联苯及其代谢物对红酵母分裂的影响,选择红酵母作为真菌研究对象,分别在YPD液体培养基中添加10mmol/L联苯,DHBP培养红酵母,取指数前期细胞制片后进行荧光显微镜观察.结果显示对照组中红酵母(图12A)出芽生殖的细胞较多,而用DHBP处理过的红酵母(图12C)出芽生殖的比例明显降低,大部分以单个细胞形式存在,生长于联苯中的细胞(图12B)多以3~4个细胞的聚集状态形式存在.通过SEM图也观察到这一现象.我们通过统计200个红酵母细胞来说明DHBP对细胞出芽率的影响,统计结果显示:对照组中出芽生殖的细胞比例为64.2%,而未出芽的细胞比例为35.8%;实验组DHBP处理过的细胞出芽生殖比例降低为19.3%,未出芽的细胞比例为80.7%,说明DHBP影响了红酵母的生长和繁殖.
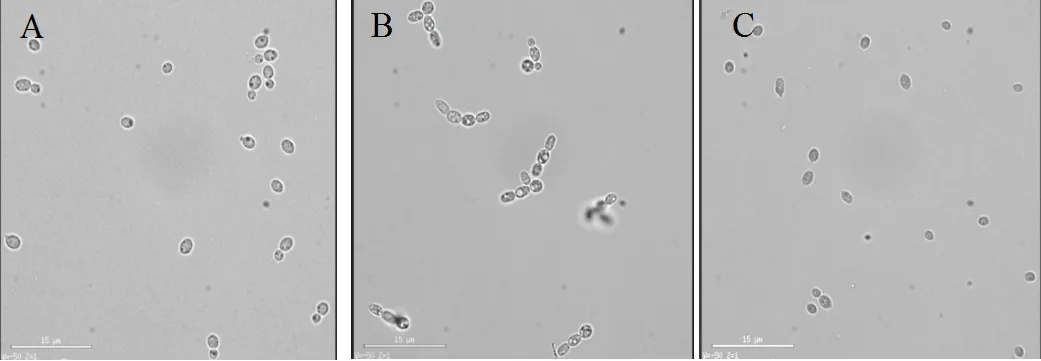
D-F: Scanning electron micrograph of, exponential phase cells cultured with YPD, biphenyl, and DHBP, respectively

表1 DHBP对不同微生物细胞形态和分裂的影响
注:+越多,表示DHBP对细胞影响越大.
综上结果可以看出,DHBP对不同微生物细胞影响不同,如表1和表2所示DHBP对大肠杆菌BL21影响作用最大,导致96.4%的细胞表面凹陷,胞质内容物流失,菌体体积缩小;对. R04和枯草芽孢杆菌WB600细胞影响次之,导致. R04和缺陷型. R04细胞形成不完整隔膜的比例增加,导致枯草芽孢杆菌89.6%的细胞体积明显缩小,同时无法形成完整的分裂隔膜;对金黄色葡萄球菌、红酵母影响作用最小,导致金黄色葡萄球菌基本没有细胞形成完整的分裂隔膜;导致红酵母细胞能进行出芽生殖的比例从64.2%降低到19.3%,但对其细胞形态无明显改变.
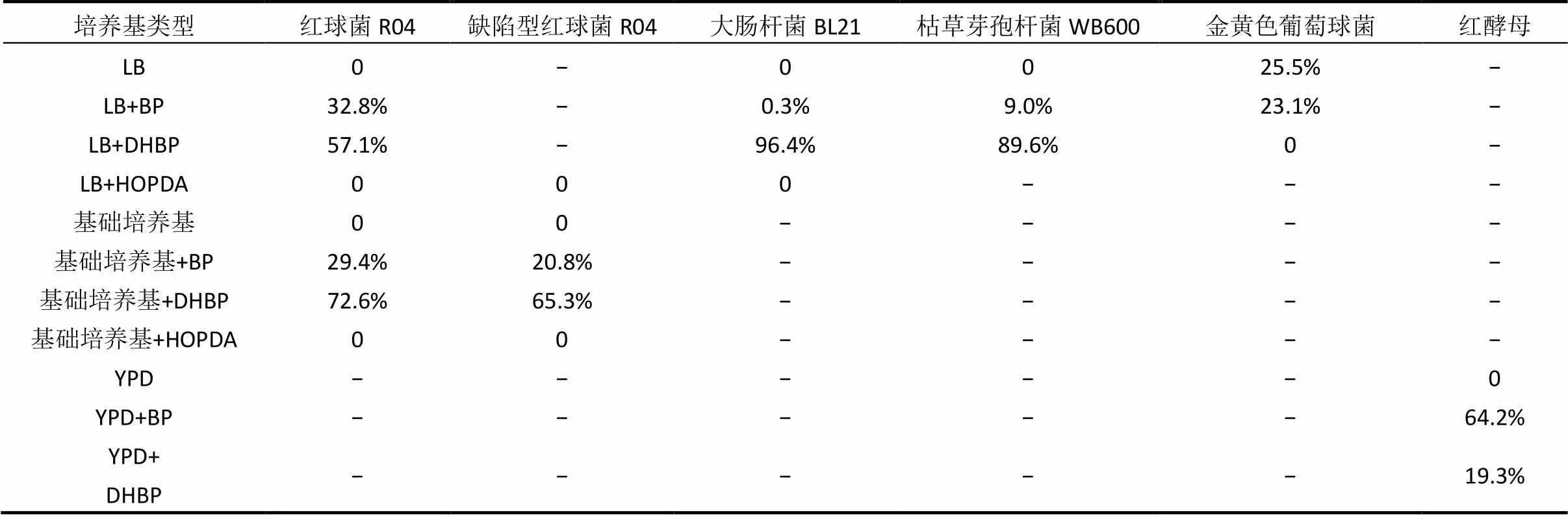
表2 联苯及其代谢物对不同微生物细胞形态和分裂的影响
注:对金黄色葡萄球菌的影响统计结果表示的是能形成完整分裂隔膜的细胞数与总细胞数的比例;对红酵母的影响统计结果表示的是能进行出芽生殖的细胞数与总细胞数的比例;对其他微生物细胞的影响统计结果均表示异常细胞数与总细胞数的比例.
3 讨论
目前,国内外学者对芳香化合物的降解主要研究前体物质对微生物的影响,很少有人研究代谢物对微生物细胞生长和分裂的影响,Yamada等[19]研究报道当向培养物中加入2-羟基联苯或3-羟基联苯后,MV1184,PpY101和PA01细胞的分裂受到抑制,导致细菌细胞丝状化; Mizukami-Murata等[20]研究表明低取代氯PCBs能够抑制PC12细胞神经元的伸长;Subramanian等[21]也发现,虽然母体多氯联苯和高取代氯的OH-PCBs表现出较低或不可检测的毒性,但低取代氯的OH-PCBs显著抑制了拟南芥的发芽率和植物生长.这些研究仅仅是证明了联苯/PCBs的某种衍生物对有机体的影响,没有完整的分析联苯/PCBs一系列的代谢物对有机体的影响.本文为了确定联苯培养红球菌R04过程中具体是哪种代谢物影响了红球菌R04细胞的分裂和形态,分别用联苯及其代谢物DHBP和HOPDA培养R04、相应代谢酶缺陷型R04,通过荧光显微镜、扫描电子显微镜观察细胞的分裂情况和形态变化.结果发现与其它代谢物培养相比,DHBP培养的R04和缺陷型细胞膜边界模糊,看不到清晰完整的细胞分裂隔膜,只观察到细胞质中粘附的荧光斑点,扫描电子显微镜观察到DHBP培养的细胞在分裂过程中细胞一侧或端部形成肿胀的小结,影响了R04的正常分裂.其次本文还用联苯及其代谢物作用了其它的微生物细胞:大肠杆菌BL21、枯草芽孢杆菌WB600、金黄色葡萄球菌、红酵母,结果显示与对照组、联苯、HOPDA条件培养下的细胞相比,DHBP处理过的细胞发生不同程度的异常变化,导致细胞无法正常分裂,可见DHBP是主要影响细胞形态和分裂隔膜形成的物质.当在基础矿物培养基和LB培养基中添加联苯及其代谢物时细胞表现出类似的分裂情况,结果显示代谢物DHBP的毒害作用大于联苯和HOPDA,联苯培养下细胞质中有荧光斑点产生,推测是由于红球菌R04将联苯代谢为DHBP的结果,其联苯自身的毒害性小于DHBP.
从化学结构式来看,联苯代谢物DHBP苯环上有两个相邻的羟基,而HOPDA苯环上含有一个羟基和一个羧基.Wang等[22]研究结果表示,影响取代芳烃化合物毒性的主要影响因素是分子量,分子量越大,化合物越稳定,化合物的脂溶性越好,毒性越强.同时,苯环上羟基的引入可增强与生物体内受体碱性基团的结合能力,导致活性和毒性的增高[23].许多研究也认为氢键结合是毒物与受体之间的主要作用方式之一,化合物毒性越大,在结构中可以发现更多的氢键供体和受体[24].本文研究的DHBP和HOPDA苯环上的取代基可能参与氢键的生成,因此推测DHBP造成细胞分裂过程中的异常行为可能与其苯环上两个羟基的存在以及氢键结合的能力有很大相关关系.
芬顿氧化技术作为一种具有高效、廉价、选择性小等特点的高级氧化技术应用于环境污染处理领域[25],特别是对于难以氧化的芳香类化合物及一些杂环类化合物,能够很好的降解.本研究用DHBP处理细胞时,基础矿物培养基、LB培养基、YPD培养基中都避免不了含有亚铁离子,培养过程中与DHBP苯环上所带有的羟基基团发生芬顿反应,培养基与菌体颜色最终变为黑色,其过程氧化掉一部分2,3-羟基联苯,所以推测能够进入细胞内并对细胞产生毒害作用的2,3-羟基联苯的量是微小的,但微量的DHBP仍导致使细胞无法形成完整的分裂隔膜,影响细胞的正常分裂.同时为了验证低浓度的DHBP能抑制细胞的分裂和生长,在0~1mmol/L DHBP之间选取适合浓度去处理. R04DC细胞,发现0.01mmol/L DHBP作用下细胞内开始出现粘附的荧光斑点,随着DHBP浓度的增大,荧光斑点增多,而且培养基和菌体不会变黑色,说明低浓度的DHBP确实对细胞有毒害作用.所以推测当用10mmol/L的DHBP处理细胞时培养基和菌体颜色变黑的原因有可能是DHBP的浓度太高所致的.
根据革兰氏染色法原理将细菌分为革兰氏阳性菌和革兰氏阴性菌,革兰氏阳性细菌的细胞壁厚,肽聚糖含量丰富,而革兰氏阴性细菌的细胞壁肽聚糖层薄,交联松散,但其脂类含量高.细菌细胞壁结构的显著不同,导致这两类细菌在染色性、抗原性、毒性、对某些药物的敏感性等方面存在很大差异[26].本研究中用DHBP处理革兰氏阳性细菌:红球菌R04、枯草芽孢杆菌WB600、金黄色葡萄球菌时,使红球菌细胞无法形成完整的分裂隔膜,在荧光显微镜下观察到一些粘附的荧光斑点,扫描电子显微镜下也观察到细胞一侧或端部出现肿胀的小结,导致细胞分裂异常;用DHBP处理枯草芽孢杆菌和金黄色葡萄球菌时导致枯草芽孢杆菌细胞体积明显缩小,导致金黄色葡萄球菌形成分裂隔膜的细胞减少,扫描电子显微镜下观察到有些细胞形状变为哑铃状.而用DHBP处理阴性菌大肠杆菌BL21时,大肠杆菌生长阻滞,细胞体积缩小,分裂受到抑制,扫描电子显微镜下观察到大肠杆菌细胞表面凹陷,胞质内容物流失.可以说明DHBP对革兰氏阴性细菌的影响比对阳性细菌的影响作用大.有研究结果显示,加入1g/L山梨酸钾后革兰氏阴性菌的菌数可减少近102~103.5CFU/mL,而革兰氏阳性菌的菌数只能减少近10CFU/mL,说明山梨酸钾对革兰氏阴性菌的抑菌效果比革兰氏阳性菌要高2倍以上.山梨酸钾具有亲脂性,革兰氏阴性菌的细胞壁脂类物质含量较高,因此山梨酸钾分子易通过;革兰氏阳性菌的细胞壁则含有大量肽聚糖,不易通过[27]. Rundegren等[28]研究中,G-细菌经6.4mmol/L Delmopinol处理后,其胞壁超微结构及细胞外形均出现很明显的改变,大量囊泡和膜连接物质被释放出细胞外,而经同样方法处理的G+细菌胞壁则无明显变化,10min后仅部分细胞周围有球形小颗粒出现.2,3-二羟基联苯不溶于水,易溶于醇、丙酮等有机溶剂,具有亲脂性,所以我们推测革兰氏阳性菌和革兰氏阴性菌细胞壁的结构不同可能是造成2,3-二羟基联苯对两类细菌影响差异的主要原因.然而联苯及其中间代谢物影响细胞生长分裂的分子机制还有待进一步研 究.
4 结论
4.1 添加葡萄糖不会影响红球菌R04对联苯的代谢,培养过程中细胞外联苯浓度均降低,细胞内联苯浓度呈现波动但整体为下降趋势.
4.2 2,3-二羟基联苯对红球菌R04及其它几种模式菌株都具有较强的抑制作用,影响细胞的正常形态和分裂增殖,导致红球菌R04端部肿胀,大肠杆菌BL21细胞内陷,胞质内容物流失,导致枯草芽孢杆菌WB600体积缩小,金黄色葡萄球菌无法形成正常的分裂隔膜,并导致酵母的出芽生殖比例从64.2%降低到19.3%,表明2,3-二羟基联苯对革兰氏阴性菌的毒性效应大于革兰氏阳性菌.
[1] 皮文清,曲媛媛,张 强,等.异生型化合物生物降解及调控机理研究进展 [J]. 环境科学与技术, 2010,33(4):72-76.Pi W Q, Qu Y Y, Zhang Q, et al. Advance on Regulation and Metabolic Pathway in Bacterial Degradation of Xenobiotics [J]. Environmental Science & Technology, 2010,33(4):72-76.
[2] Safe S. Polychlorinated biphenyls (PCBs), dibenzo-p-dioxins (PCDDs), dibenzofurans (PCDFs), and related compounds: environmental and mechanistic considerations which support the development of toxic equivalency factors (TEFs) [J]. Crc Critical Reviews in Toxicology, 1990,21(1):51-88.
[3] Akahane M, Matsumoto S, Kanagawa Y, et al. Long-Term Health Effects of PCBs and Related Compounds: A Comparative Analysis of Patients Suffering from Yusho and the General Population [J]. Archives of Environmental Contamination and Toxicology, 2018,74(2):203-217.
[4] Weber R, Herold C, Hollert H, et al. Life cycle of PCBs and contamination of the environment and of food products from animal origin [J]. Environmental Science and Pollution Research, 2018,25(1):16325-16343.
[5] 徐 莉,滕 应,张雪莲,等.多氯联苯污染土壤的植物-微生物联合田间原位修复 [J]. 中国环境科学, 2008,28(7):646-650.Xu L, Teng Y, Zhang X L, et al. Combined remediation of PCBs polluted soil by plant and microorganism in a field trial [J]. China Environmental Science, 2008,28(7):646-650.
[6] Yang Xiuqing, Sun Yan, Qian Shijun. Biodegradation of sevenpolychlorinated biphenyls by a newly isolated aerobic bacterium(sp. R04) [J]. J. Ind. Microbiol. Biotechnol., 2004,31(9):415-420.
[7] Hayase N, Taira K, Furukawa K. Pseudomonas putida KF715bphABCD operon encoding biphenyl and polychlorinated biphenyl degradation: cloning, analysis, and expression in soil bacteria [J]. Journal of Bacteriology, 1990,172(2):1160-1164.
[8] 孙 艳,钞亚鹏,钱世钧.嗜吡啶红球菌R04的联苯降解途径的研究 [J]. 微生物学报, 2003,43(5):653-658. Sun Yan, Chao Y P, Qian S J. Study on the Degradation Pathway of Biphenyl byR04 [J]. Acta Microbiologica Sinica, 2003,43(5):653-658.
[9] Bhowmik S, Horsman G P, Bolin J T, et al. The molecular basis for inhibition of BphD, a C-C bond hydrolase involved in polychlorinated biphenyls degradation: large 3-substituents prevent tautomerization [J]. Journal of Biological Chemistry, 2007,282(50):36377-36385.
[10] Parnell J J, Park J, Denef V, et al. Coping with polychlorinated biphenyl (PCB) toxicity: physiological and genome-wide responses of Burkholderiaxenovorans LB400 to PCB-mediated stress [J]. Applied and Environmental Microbiology, 2006,72(10):6607-6614.
[11] Bourquin A W, Cassidy S. Effect of polychlorinated biphenyl formulations on the growth of estuarine bacteria [J]. Applied Microbiology, 1975,29(1):125-127.
[12] Joseph L J, Sandra W J. Intellectual Impairment in Children Exposed to Polychlorinated Biphenyls in Utero [J]. New England Journal of Medicine, 1996,335(11):783-789.
[13] Berg M V D, Craane B L H J, Sinnige T, et al. Biochemical and toxic effects of polychlorinated biphenyls (PCBs), dibenzo-P-dioxins (PCDDs) and dibenzofurans (PCDFs) in the cormorant (phalacrocorax carbo) after in ovo exposure [J]. Environmental Toxicology & Chemistry, 2010,13(5):803-816.
[14] 李 叶,张 爽,李玉灵,等.多氯联苯暴露对绦柳初生根及显微结构的影响 [J]. 北方园艺, 2016,(24):55-60.Li Y, Zhang S, Li Y L, et al. Effects of Polychlorinated Biphenyls(PCBs) on the Initial Roots and Microstructure of Salix matsudana f.pendula Schneid [J]. Northern Horticulture, 2016,(24):55-60.
[15] 杨秀清,郑 媛,李鹏丽,等.红球菌-R04生物降解多卤代联苯的影响因素研究 [J]. 中国环境科学, 2010,30(5):694-698. Yang X Q, Zheng Y, Li PL, et al. Influencing factor for the biodegradation of polyhalogenated biphenyls bysp. R04 [J]. China Environmental Science, 2010,30(5):694-698.
[16] 杨秀清,商慧慧.红球菌R04细胞的不对称分裂及其在联苯胁迫下的分裂抑制 [J]. 微生物学报, 2018,58(5):893-906. Yang X Q, Shang H H. Asymmetric cell division of Rhodococcus sp. R04 and its division inhibition under biphenyl stress [J]. Acta Microbiologica Sinica, 2018,58(5):893-906.
[17] 曹星星,杨秀清.联苯/多氯联苯对红球菌R04细胞形态及隔膜的影响 [J]. 山西大学学报(自然科学版), 2016,39(2):287-294.Cao X X, Yang X Q. The effect of biphenyl/polychlorinated biphenyl on cell morphology and septum ofsp. R04 [J].Journal of Shanxi University(Natural Science Edition), 2016,39(2):287-294.
[18] Hayteas D L, Duffield D A. The determination by HPLC of PCB and p,p′ -DDE residues in marine mammals stranded on the Oregon Coast [J]. Marine Pollution Bulletin, 1997,34(10):844-848.
[19] Yamada T, Shimomura Y, Hiraoka Y, et al. Oxidative stress by biphenyl metabolites induces inhibition of bacterial cell separation [J]. Applied Microbiology & Biotechnology, 2006,73(2):452-457.
[20] Mizukami-Murata S, Fujita K, Nakano T. Effect of lower chlorinated hydroxylated-polychlorobiphenyls on development of PC12cells [J]. Environmental Science & Pollution Research, 2017,25(17):1-12.
[21] Subramanian S, Schnoor J L, Aken B V. Effects of Polychlorinated Biphenyls (PCBs) and Their Hydroxylated Metabolites (OH-PCBs) on Arabidopsis thaliana [J]. Environmental Science & Technology, 2017, 51(12):7263-7270.
[22] Wang L, Li F. Study on the Quantitative Structure-activity Relationship of Acute Toxicities of Substituted Aromatic Compounds to Daphnia magna [J]. Journal of Anhui Agricultural Sciences, 2010, 38(23):12542-12544.
[23] 陈景文,廖宜勇,赵元慧,等.取代氮杂环类化合物对大型蚤(Daphnia magna Straus)的定量结构-活性关系研究 [J].农药, 1996,35(5):21-24.Chen J W, Liao Y Y, Zhao Y H, et al. Study on quantitative structure- activity relationship of substituted nitrogen heterocyclic compounds to Daphnia magna Straus [J]. Pesticide , 1996,35(5):21-24.
[24] Struck S, Schmidt U, Gruening B, et al. Toxicity versus potency: elucidation of toxicity properties discriminating between toxins, drugs, and natural compounds [J]. Genome informatics, 2008,20(20):231-242.
[25] Albert J O. Nitrogenremoval in constructed wetlands treating nitrified meat processing effluent [J]. Water Science and Technology, 1995,32(3):137-147.
[26] 徐文玉.细菌细胞壁的教学方案 [J]. 微生物学通报, 1985,12(5): 44-48.Xu W Y. Teaching program of bacterial cell wall [J]. Acta Mcrobiologica Sinica, 1985,12(5):44-48.
[27] 滕 菲,郭桂萍,赵 勇,等.革兰氏阳性菌和阴性菌对山梨酸钾的耐受差异性 [J]. 食品与生物技术学报, 2012,31(4):417-422.Teng F, Guo G P, Zhao Y, et al. Study of the Tolerance Difference between Gram Positive and Gram Negative Bacteria to Potassium Sorbate [J]. Food Science and Biotechnology, 2012,31(4):417-422.
[28] Rundegren J, T Sjödin, Petersson L, et al. Delmopinol interactions with cell walls of gram-negative and gram-positive oral bacteria [J]. Oral Microbiology & Immunology, 1995,10(2):102-109.
致谢:感谢导师杨秀清老师以及师姐商慧慧提供的帮助与支持,在此表示由衷感谢.
Growth stress and division inhibition of biphenyl metabolism on microorganisms.
YANG Xiu-qing*, LIU Ya-ni
(Instiute of Biotechnology, Key Laboratory of Chemical Biology and Molecular Engineering of Ministry of Education, Shanxi University, Taiyuan 030006, China)., 2019,39(9):3941~3950
The biphenyl/polychlorinated biphenyl degrading strain R04 (sp. R04) and several model microorganisms were used as the research objects. Cell division and morphological changes of biphenyl/polychlorinated biphenyl degrading strain R04 were analyzed by high performance liquid chromatography, fluorescence microscopy and scanning electron microscopy under the conditions of biphenyl and its metabolites culture. The results showed that the division ofsp. R04 and several model microbial cells were inhibited under biphenyl and its metabolites culture conditions, and some microbial cells morphology were affected. Compared with the precursor-biphenyl and its metabolite 2-hydroxy-6-keto-6-phenyl-2, 4-hexadienoic acid, 2,3-dihydroxybenzene has stronger inhibition and morphological change on G+, G-bacteria orcell division. The proportion of.R04 cells and defective.R04 cells forming incomplete septum was increased under the condition of 2,3-dihydroxybenzene culture. It caused that 96.4% ofBL21 cells surface was dented, cytoplasmic content was lost and bacterial body volume was shrunk. It caused that 89.6% ofcells was shrunk significantly. The phenomenon thathas almost no cells to form a complete septum was caused. The percentage ofcells that could germinate and reproduce was decreased from 64.2% to 19.3%, but there was no significant change in cell morphology. Biphenyl metabolite 2,3-dihydroxybiphenyl has strongly inhibitory effect on cell division and proliferation ofsp. R04 and other microorganisms than its precursor-biphenyl, and it is suggested that the toxic effect of environmental compounds metabolism should be considered when the interaction between environmental compounds and microorganisms.
biphenyl metabolism;sp. R04;cell division;environmental compounds
X703.5
A
1000-6923(2019)09-3941-10
杨秀清(1975-),男,山西代县人,副教授,博士,主要从事微生物生物转化与生物催化研究.发表论文50余篇.
2019-02-21
山西省自然科学基金资助项目(2014011030-3);山西省煤层气联合研究基金资助项目(2015012002);山西省煤基重点科技攻关项目(MQ2014-03)
* 责任作者, 副教授, xiuqyang@sxu.edu.cn

