婴儿型糖原贮积症Ⅱ型酶替代治疗三例并文献复习
徐玲玲,巴宏军,李素萍,梁玉坚,黄雪琼,张丽丹,裴瑜馨,黄慧敏,张成,唐雯*
糖原贮积症Ⅱ型(GSD Ⅱ)也称Pompe病,发病率约为1∶40 000[1],是一种罕见的常染色体隐性遗传溶酶体贮积症。由于溶酶体内酸性α-葡糖苷酶(GAA)缺乏导致糖原在骨骼肌、心肌和平滑肌等组织细胞内聚积,引起进行性组织构架混乱、肌肉萎缩、功能缺失。根据发病年龄,GSD Ⅱ可分为婴儿型和晚发型;婴儿型又可分为经典及非经典两类。经典类婴儿型GSD Ⅱ进展快,病情最为严重[2],绝大多数患儿约4个月大时表现出肥厚性心肌病、心脏肥大、四肢近端肌肉无力、躯干部肌肉无力致呼吸衰竭,巨舌、肝肿大及肌张力低下所致运动发育迟缓,喂养困难,未及时治疗者多在1岁内死亡[3]。非经典类婴儿型GSD Ⅱ进展相对缓慢。确诊GSD Ⅱ的条件是具备典型的临床表现同时外周血或肌肉组织活检发现GAA活性降低[3]。2006年美国食品药品管理局(FDA)批准重组酶替代治疗GSD Ⅱ后,重组人类GAA替代治疗成为该病主要的治疗方法,治疗越早,疗效越显著[4]。本研究旨在总结婴儿型GSD Ⅱ使用重组人类GAA替代治疗的效果,为临床治疗提供参考。
1 资料与方法
1.1 临床资料 收集2016年3月—2017年12月在中山大学附属第一医院住院确诊的婴儿型GSD Ⅱ患儿3例,均有心肌肥厚和或肌无力表现,外周血GAA活性低于参考范围。
1.2 方法 回顾性收集患者的一般情况、临床表现、实验室检查及诊疗情况等。
患儿1,男,5月龄起发现心室肥厚,12月龄起出现行走无力,反复肺炎,于2016年3月(34月龄)由外院行移动式呼吸机转运入儿科重症监护病房(PICU),开始重组GAA替代治疗时需要有创机械通气,心脏彩超示室间隔厚度12 mm,左心室后壁厚度7.5 mm,呈肥厚性心肌病改变(见图1),肝脏彩超示脂肪肝(见图2),肌肉组织活检示肌纤维大部分呈空泡样变,可见糖原贮积改变(见图3)。
患儿2,男,1月龄起发现心室肥厚,后因肺炎于2016年4月(3月龄)入PICU,入院后第3天出现呼吸衰竭予有创机械通气治疗。患儿生长发育落后,10个月会坐,22个月大时可扶站。
患儿3,男,4月龄时因反应差行心脏彩超发现肥厚性心肌病,5月龄时合并肺炎、呼吸衰竭于2017年1月入PICU。入院后立即予有创机械通气治疗。
本文创新点:
糖原贮积症Ⅱ型为罕见疾病,婴儿型病死率高,重组人类α葡糖苷酶是唯一治疗糖原贮积症Ⅱ型的特效药,目前国内应用的病例极少,国内对重组人类α葡糖苷酶治疗婴儿型糖原贮积症Ⅱ型的报道极少,本文旨在提高临床医生对此疾病的认识不足,了解酶替代治疗的疗效对疾病的益处。希望本文的报道能够引起临床医生对本病的了解,更好地开展临床工作。
本文不足:
由于该病罕见,重组人α葡糖苷酶治疗费用昂贵,因此纳入的病例数少,疗程短,不足以观察重组人α葡糖苷酶的长期疗效。且2例放弃治疗,影响临床疗效的观察。
3例患儿均足月顺产,出生时均无窒息抢救史,均有运动发育迟缓及营养不良,父母均非近亲婚配,母孕期体健,家族中均无类似疾病史。征得家属同意,详细告知患儿家属风险及获益后,签署知情同意书,本研究经本院伦理委员会同意。
1.3 治疗及观察指标 确诊后1~2个月行重组人类GAA替代治疗,患儿1~3分别使用了5、34、4剂。重组人类GAA(Myozyme,生产厂家:赛诺菲健赞公司,批号c6438102)20 mg/kg,1次/2周,配药过程中避免形成泡沫,无菌操作,静脉滴注前备好急救措施,首次治疗常规予地塞米松预防过敏反应,药物配制和静脉滴注全过程避光,单独的静脉通道给药,1 mg·kg-1·h-1静脉滴注 30 min,而后 3 mg·kg-1·h-1静脉滴注30 min,再予5 mg·kg-1·h-1静脉滴注30 min,最后予7 mg·kg-1·h-1静脉滴注至结束,3.5~4.0 h内滴注完毕。静脉滴注72 h内严密监测有无不良反应:皮疹、血压下降、腹痛和腹泻等过敏反应,免疫介导的反应、心悸、胸闷和呼吸困难等急性心肺功能衰竭、静脉滴注反应等。观测患儿生命体征、呼吸情况、肌力、丙氨酸氨基转氨酶(ALT)、天冬氨酸氨基转氨酶(AST)、乳酸脱氢酶(LDH)、肌酸激酶(CK)、胸部X线检查情况,并动态分析,共随访4~17个月。仅患儿1治疗前行肌肉组织活检。
2 结果
3例患儿开始治疗时症状均以四肢肌无力并呼吸困难为主要表现,1例成功撤离呼吸机,2例放弃治疗后死亡。患儿1超声示心室肥厚及脂肪肝,肌肉活检见糖原空泡(见表1)。3例患儿经重组人类GAA替代治疗(4~34剂量),3例肌力均明显好转,ALT下降2例,升高1例;AST下降2例,升高1例;LDH下降1例,升高2例;CK下降2例,升高1例(见表2);3例患儿治疗前胸部X线检查示心影大(见图4);治疗后患儿1、2胸部X线检查示心影缩小,患儿3胸部X线检查示心影变化不明显(见图5)。治疗后心脏彩超示室间隔厚度下降3例;左心室射血分数提升3例(见表3)。
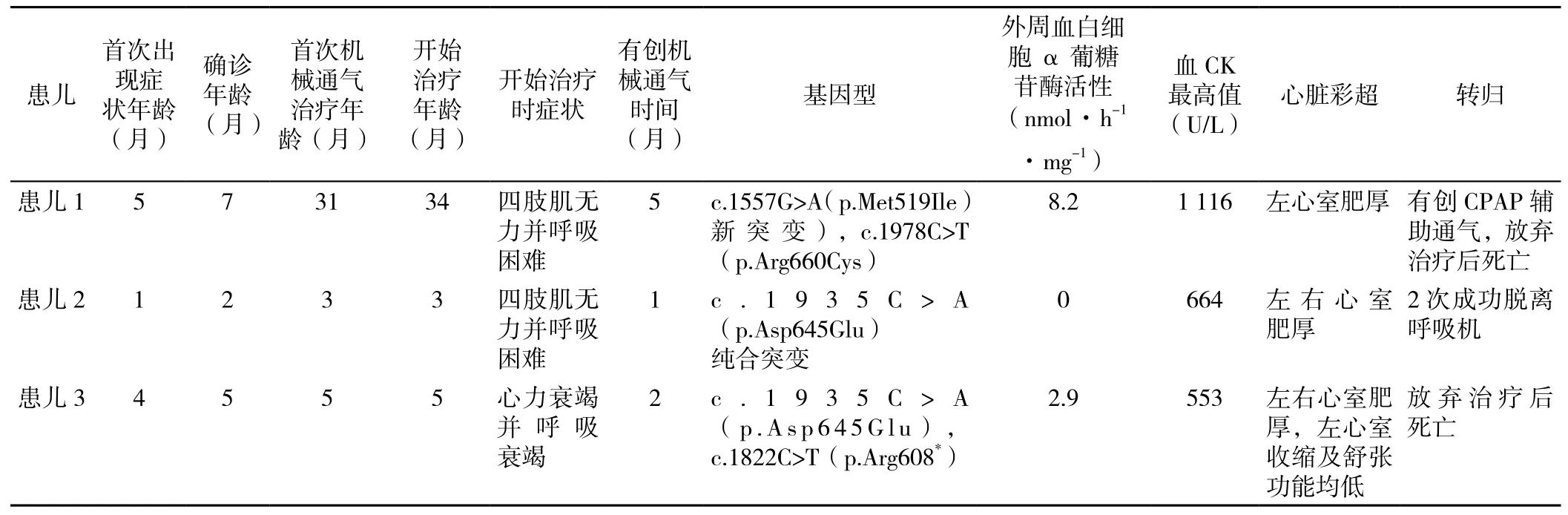
表1 3例患儿临床特征及治疗情况Table 1 Clinical features and ERT of 3 children with GSD Ⅱ
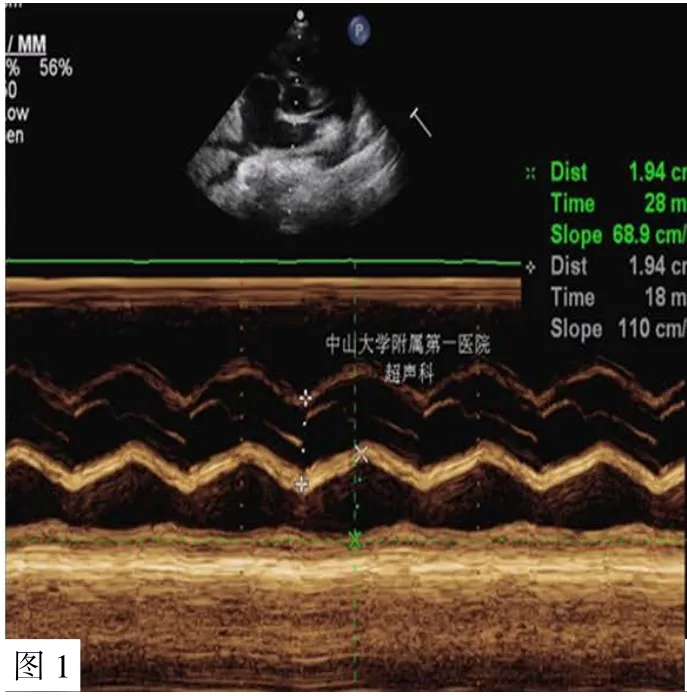
图1 患儿1心脏彩超Figure 1 Children 1 Cardiac Color Doppler Ultrasound
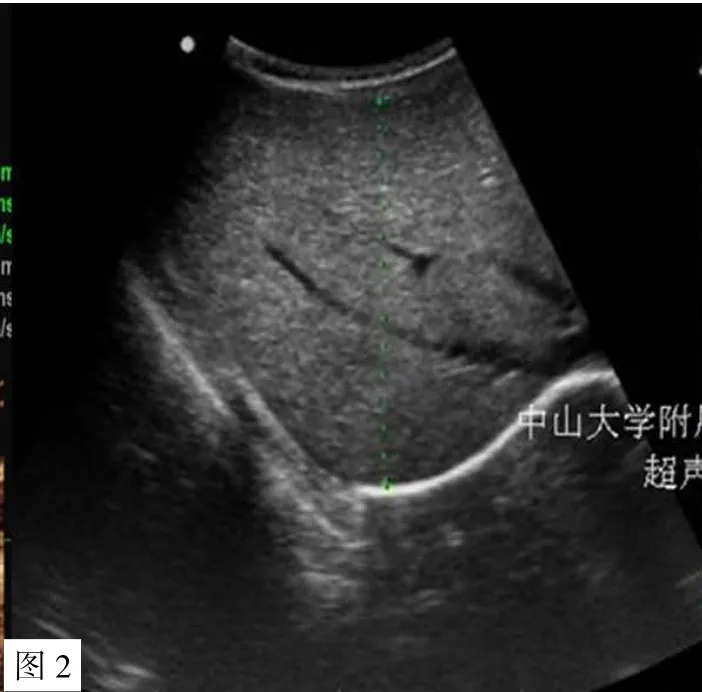
图2 患儿1肝脏彩超Figure 2 Color Doppler Ultrasound of liver in child 1
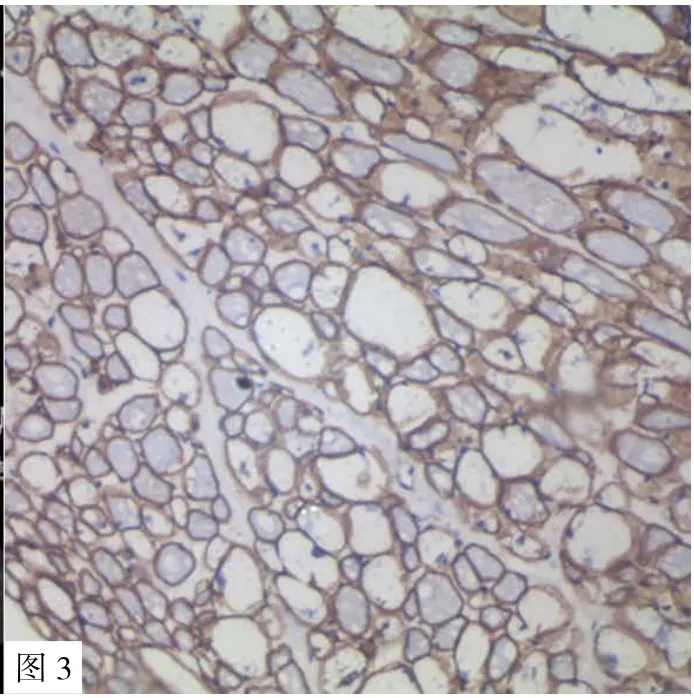
图3 患儿1肌肉组织活检(PAS,×50)Figure 3 Muscle biopsy in patient 1
3 讨论
文献检索:以“glycogen storage disease type Ⅱ或 Pompe或糖原贮积症Ⅱ”和“infantile-onset或early-onset 或早发型或婴儿型”和“Enzyme replacement therapy或酶替代”为关键词,检索中国期刊全文数据库、万方数据知识服务平台、PubMed数据库2009—2019年1月收录的论文,排除研究分析、重复报道及部分信息不全的文献。
文献检索结果:在上述数据库中检索到中文文献5篇,英文文献94篇,阅读标题及摘要筛选出中文文献0篇,英文文献24篇。年均发表2、3篇文献,其中个案报道居多,多为回顾性研究。根据以上文献报道,结合本研究结果总结本病的临床表现、治疗结果分析,讨论如下。
婴儿型GSDⅡ由于GAA缺乏导致糖原累及心脏,导致左心室后壁及室间隔肥厚、左心室流出道梗阻,从而降低左心室收缩功能,这种肥厚性心肌病最终影响心脏收缩、舒张功能,并很快进展为心力衰竭,常合并呼吸衰竭。婴儿型GSDⅡ的典型表现为早期出现心脏肥大[2],一般患儿5个月大时因肺炎或喂养困难等行心脏彩超发现左心室射血分数低于40%[5]。经典类婴儿型GSDⅡ心电图显示PR间期缩短,心室电压和复极化异常明显,临床表现为心律失常,包括室上性心动过速及室性心动过速[6-7]。

图4 3例患儿治疗前胸部X线检查Figure 4 Chest X-ray examination before treatment in 3 children

注:A为患儿1,B为患儿2,C为患儿3
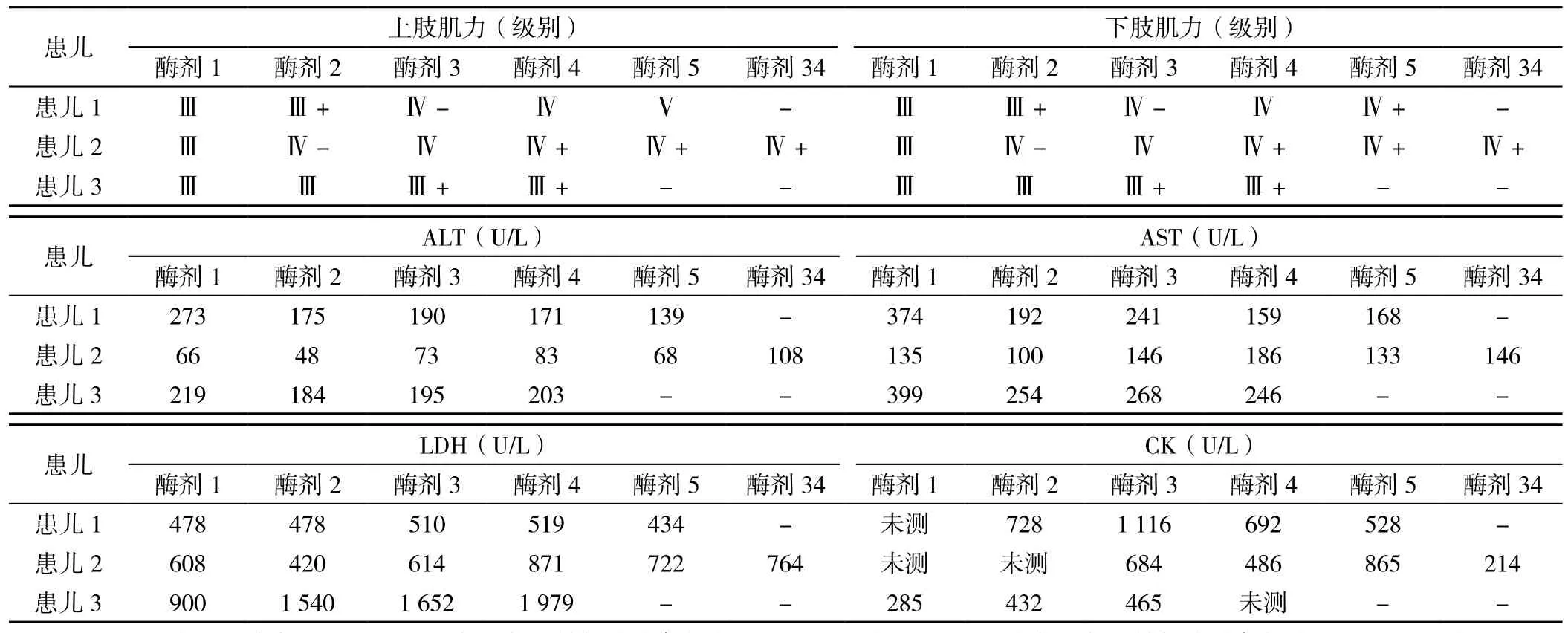
表2 3例患儿治疗后肌力及血生化指标变化Table 2 Changes of muscle strength and blood biochemical parameters in three cases with infantile glycogen storage disease typeⅡ after ERT
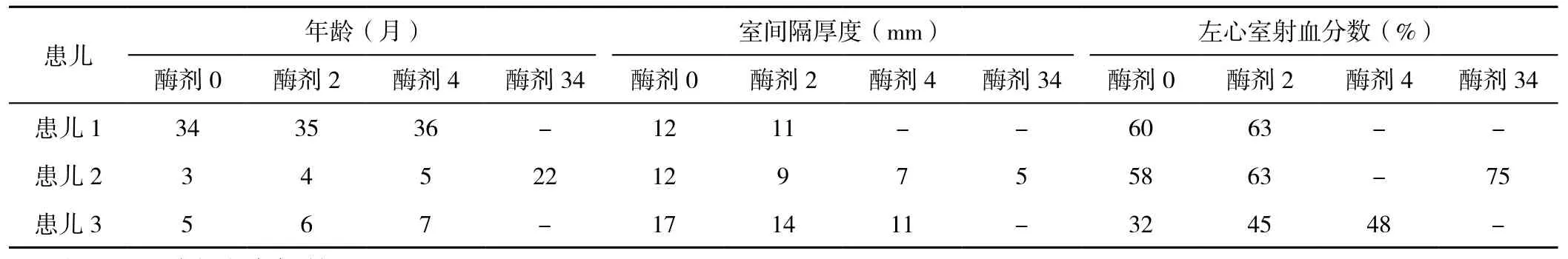
表3 3例患儿治疗后心脏结构及功能的改变Table 3 Cardiac structure and function changes of 3 children with infantile-onset GSD Ⅱ after ERT
婴儿型GSDⅡ可分为经典类和非经典类。经典类婴儿型GSDⅡ得不到及时治疗者多在1岁内死亡,非经典类进展相对缓慢[2]。一项对168例经典类婴儿型GSDⅡ的回顾性研究显示,症状发作的中位年龄是2个月,第1次行呼吸机支持的中位年龄是5.9个月、死亡的中位年龄为8.7个月,12、18个月的生存率分别为25.7%和12.3%[8]。本研究3例患儿发病年龄均在6个月以内,患儿2、3分别在3个月、5个月时需要行第1次呼吸机支持治疗,病情进展快,为经典类婴儿型GSDⅡ;仅患儿1在34月龄时才需要呼吸机支持治疗,对患儿2、3来说,进展相对缓慢,为非经典类婴儿型GSDⅡ。
重组人类GAA替代治疗是GSDⅡ的主要治疗方法。国外使用重组人类GAA替代治疗研究颇多,因GSDⅡ的酶替代制剂重组人类GAA国内上市较晚,国内相关研究较少见。婴儿型GSDⅡ使用重组人类GAA替代治疗治疗效果显著,可显著延长患儿生存期、改善心脏功能、运动功能及呼吸肌功能[9]。
一项开放性试验对18例婴儿型GSDⅡ使用重组人类GAA替代治疗52周的疗效进行观察,发现所有患儿幸存至1岁以上,16例患儿幸存下来纳入3年的延续研究,89%患儿幸存到2岁以上,39%患儿达到36个月龄[10]。未予重组人类GAA替代治疗的患儿18个月的存活率只有12.3%,其中未行呼吸机支持治疗的幸存者仅占6.7%[11]。说明重组人类GAA替代治疗越早,患儿存活率越高。本研究中3例婴儿型GSDⅡ患儿重组人类GAA替代治疗后,患儿2存活至今,34个月大,运动发育较同龄儿童稍落后,余2例因社会及经济因素未能继续治疗,最终死亡。
心脏肌肉对重组人类GAA替代治疗的反应良好,特别是无症状的患者。一项回顾性研究显示11例长期幸存的婴儿型GSDⅡ(5.4~12.0岁)开始接受≤6个月的重组人类GAA替代治疗后,所有患儿心脏指标及其运动能力得到改善[6]。CHEN等[12]研究发现婴儿型GSDⅡ患儿经重组人类GAA替代治疗2个月后,左心室肥大可显著复原,但患儿5个月大时才开始重组人类GAA替代治疗,左心室肥大的情况改善不明显,只是表现为左心室质量指数提升;重组人类GAA替代治疗前2个月左心室射血分数会出现短暂下降,经过6个月治疗后恢复到基线水平[13]。CHEN等[12]研究还发现经过重组人类GAA替代治疗后婴儿型GSDⅡ患儿心电图示短PR间期及高QRS电压也会得到改善;其中4例婴儿型GSDⅡ合并左心室流出道梗阻需要β-受体阻滞剂治疗的患儿,经过重组人类GAA替代治疗1个月后梗阻解除[13]。综上所述婴儿型GSDⅡ重组人类GAA替代治疗越早对心脏肥厚的改善程度越明显。本研究也证实了这一点,患儿1重组人类GAA替代治疗较晚,超过1岁,重组人类GAA替代治疗后胸部X线检查示心影有轻微的减轻;然而患儿2早在3个月大时就开始重组人类GAA替代治疗,治疗1年后发现心影明显缩小,且心脏彩超也显示心脏肥厚的程度明显减轻,提示重组人类GAA替代治疗可以逆转心脏肥厚。重组人类GAA替代治疗后尽管心脏肥厚的情况有所改善,但长期治疗可能会增加心脏传导异常和心律失常的风险[12],因此需要长期监测患儿的心功能,防治心律失常。
婴儿型GSDⅡ因躯干肌肉及心肌受累,常在出现心力衰竭的同时因呼吸肌无力而出现呼吸衰竭,需要行呼吸机支持治疗。早期重组人类GAA替代治疗有利于早期撤离呼吸机。CHAKRAPANI等[14]对20例婴儿型GSDⅡ患儿行重组人类GAA替代治疗结果发现,7例死亡,13例存活;根据是否需要行>2周机械通气治疗分组:12例短期呼吸机治疗组,7例最终撤离呼吸机,5例死亡;8例>2周呼吸机治疗组,6例仍需要长期呼吸机治疗(3例24 h有创呼吸机治疗;2例夜间有创呼吸机治疗,1例无创双相正压通气辅助通气治疗),2例死亡。本研究婴儿型患儿1、2重组人类GAA替代治疗近3个月后四肢肌力明显改善,患儿1呼吸机参数逐步下调可尝试改为无创呼吸机辅助通气,因家长放弃治疗后死亡;患儿2首次予呼吸机支持,经重组人类GAA替代治疗5个月后成功撤离呼吸机。本研究婴儿型GSDⅡ均为需要机械通气治疗撤机困难的患儿,为相对严重的病例,患儿2重组人类GAA替代治疗后成功撤离呼吸机,较国外婴儿型>2周呼吸机治疗组仍不能撤机的效果好;本研究患儿2重组人类GAA替代治疗后2次成功撤离呼吸机与加强翻身拍背吸痰、积极控制感染、加强营养密切相关。本研究所有患儿经重组人类GAA替代治疗后四肢肌力也得到很好地改善。
重组人类GAA替代治疗的GAA属于异体蛋白,治疗过程中会出现静脉滴注不良反应,如皮疹、红斑、心动过速等,但发生率不高,多为个别案例[15]。CHO等[16]对韩国7例婴儿型GSDⅡ中4例患儿进行重组人类GAA替代治疗2年的观察研究发现,使用过程无静脉滴注不良反应。DEROMA等[17]报道了8例GSDⅡ患儿行重组人类GAA静脉滴注过程中1例第2剂出现皮疹。本研究3例患者重组人类GAA替代治疗过程均无静脉滴注不良反应。
综上所述,临床上对婴儿期心脏肥大原因未明的患儿需高度警惕婴儿型GSDⅡ[18]。本研究证实重组人类GAA替代治疗能显著改善患儿心脏功能,甚至逆转心肌肥厚,增加四肢肌肉力量,改善呼吸功能,未见明显的静脉滴注不良反应,提高了患者生存质量,给GSDⅡ患儿带来了福音。但目前对婴儿型GSDⅡ重组人类GAA替代治疗的观察还十分局限,需继续监测患儿长期使用酶替代治疗的情况。

