冬虫夏草对糖尿病对比剂肾病大鼠肾细胞中线粒体凋亡途径的影响*
高巧营,赵 凯
(1. 天津市中西医结合急腹症研究所, 天津 300100; 2. 天津市南开医院心血管内科, 天津 300100)
近年来,随着对比剂的广泛应用,对比剂肾病(contrast-induced nephropathy, CIN)发病率逐年升高,已成为三大医源性急性肾损伤之一[1-2]。CIN是指在排除其他原因的前提下,血管内应用对比剂72 h内发生的肾功能急性损害或肾功能损害加重[3]。糖尿病是发生CIN最常见的危险因素之一[4]。对比剂可直接损伤肾小管,诱导肾细胞凋亡,加剧肾损伤[5]。线粒体Bcl-2家族中的抗凋亡基因B细胞淋巴瘤/白血病-2(b-cell lymphoma/ leukemia-2,Bcl-2)和促凋亡基因Bcl-2相关X蛋白质(Bcl-2 related X protein,Bax)是细胞凋亡内源性途径中最具代表性的调控因子,可激活天冬-半胱氨酸特异性蛋白酶家族(cysteinyl aspartate-specific proteases,caspase)信号通路促进肾细胞凋亡。
目前对CIN有确切防治效果的药物并不多见。冬虫夏草是一种名贵虫草属植物类药用真菌,具有补益肺脾、滋补肾脏之功效,可降低血尿素氮和尿蛋白[6],调节肾组织表皮生长因子表达,促肾小管修复和再生[7]。糖尿病患者给予冬虫夏草干预后行介入诊疗时CIN的发生率明显降低,且患者Scr、BUN、KIM-1指标等都有明显改善[8-9]。目前关于冬虫夏草预防CIN发生的分子机制研究较少。本研究通过建立糖尿病CIN大鼠模型,检测不同剂量冬虫夏草干预后大鼠肾细胞的凋亡情况及Caspase-3、Caspase-9、Bax和Bcl-2表达情况,探讨其对模型大鼠肾细胞中线粒体凋亡途径的影响,分析其预防CIN保护肾损伤的分子机制。
1 材料
1.1 实验动物
清洁级健康雄性SD大鼠50只,8周龄,体质量(250±10)g,购于北京维通利华实验动物技术有限公司(许可证号 SCXK(京)2016-0011)。
1.2 主要试剂与仪器
链脲佐菌素(美国Sigma公司);碘克沙醇注射液(美国GE公司);冬虫夏草原粉(杭州中美华东制药有限公司惠赠)。血清肌酐(serum creatinine,Scr)及尿素氮(blood urine nitrogen,BUN)试剂盒(南京建成科技有限公司);肾损伤因子(kidney injury molecule 1,KIM-1)和中性粒细胞明胶酶相关载脂蛋白(neutrophil gelatinase related apolipoprotein,NGAL)检测试剂盒(上海蓝基生物有限公司);TUNEL 试剂盒(江苏凯基生物技术股份有限公司),动物组织RNA提取试剂盒、荧光定量PCR试剂盒(北京天根生化科技有限公司);Caspase-3抗体、Caspase-9抗体、Bcl-2 抗体、Bax抗体、β-actin(美国Santa Crua生物技术有限公司)。IQ5型荧光定量PCR仪、凝胶成像系统(美国Biorad公司);LEICA DM4000B正置显微镜(德国Leica公司)。
2 方法
2.1 大鼠模型建立及分组
参照文献[10]制备动物模型。SD大鼠适应性喂养1周,造模前大鼠断尾测血糖。随机选取8只大鼠为正常组,其余大鼠禁食12 h后称重,经腹腔单剂量注射链脲佐菌素(60 mg/kg)建立糖尿病模型,72 h及7 d断尾测血糖,以非禁食血糖≥l6.7 mmol/L判定糖尿病大鼠模型是否成功。按随机数字表法将糖尿病成模大鼠40 只分为模型组、低剂量组、中剂量组和高剂量组各10只。饲养9周后,三虫草干预组大鼠给予冬虫夏草原粉(2.0 g/kg、2.5 g/kg、3.0 g/kg)配置的悬液灌胃,正常组和模型组大鼠给予等量生理盐水灌胃,连续7 d。第8天,除正常组以其余大鼠均经尾静脉缓慢注射碘克沙醇(2.0 g iodine/kg)制备CIN模型。于注射碘克沙醇前及24 h后,大鼠经内眦静脉采血1 mL,离心留取上清测定血清Scr。以血清Scr较基线升高超过25%以上为模型成功判定标准[11]。
2.2 实验取材
注射对比剂后将大鼠置于代谢笼中,收集大鼠24 h尿液。10%水合氯醛(300 mg/kg)麻醉大鼠称重,迅速分离双肾。左肾置于10%中性福尔马林中固定,用于病理检测;右肾储存于-80 ℃冰箱,用于氧化应激指标,基因及蛋白测定。
2.3 指标检测
2.3.1 肾功能及肾损伤指标 脲酶法测定血清BUN,苦味酸法测定血清Scr,应用ELISA法检测尿NGAL、KIM-1。
2.3.2 肾匀浆氧化应激指标 每100 mg肾组织加入0.9 mL 0.9%的氯化钠溶液中研磨,制成10%肾组织匀浆,3000 r/min离心15 min,取上清。硝酸还原酶法测定NO,黄嘌呤氧化酶法测SOD,硫代巴比妥酸法测定MDA,比色法测定T-AOC。
2.3.3 Caspase-3、Caspase-9、Bax和Bcl-2 mRNA表达 表1显示,依据试剂盒说明提取大鼠肾组织总RNA,并进行逆转录。所有引物均由上海生工生物技术有限公司合成。反应体系20 μL:模板1 μL,上下游引物(10 μM) 各0.4 μL,2×TransStart Top Green qPCR SuperMix 10 μL,ddH2O 8.2 μL。反应程序为: 94 ℃ 30 s;94 ℃ 5 s,56 ℃ 15 s,72 ℃ 10 s,共43个循环;72 ℃ 10 min延伸后结束。每份样本进行3个复孔测定,结果应用2-△△Ct法[12]进行分析。

表1 引物序列
2.3.4 Caspase-3、Caspase-9、Bax和Bcl-2蛋白表达 将50 mg取肾组织加入500 μL裂解液中进行匀浆,参照试剂盒说明提取总蛋白。应用BCA蛋白测定试剂盒测定总蛋白浓度。将蛋白浓度均一化为2 mg/mL,进行热变性、电泳、转模封闭2 h。单克隆抗体4 ℃孵育过夜后,漂洗4次5 min。二抗室温孵育2 h,化学发光法发光成像,以β-actin为内参。
2.3.5 Tunel细胞凋亡检测 固定的肾组织进行常规脱水、包埋、切片。切片进行脱蜡2次,每次5 min;水合2次,每次5 min。蛋白酶K通透,37℃ 30 min,3% H2O2室温封闭20 min,50 μL TdT酶反应液37℃避光反应60 min。50 μL Streptavidin-HRP工作液进行标记,37℃避光反应30 min。50 μL DAB工作液显色,室温反应1 min。苏木素常规复染。酸化和反蓝后中性树胶封片并观察。
2.3.6 肾组织病理检测 切片按常规方法进行脱蜡,梯度浓度乙醇洗去二甲苯,进行苏木素染色。经酸化和反蓝后,进行伊红染色2 min,水洗30 s。再行脱水、透明,应用中性树胶封片后观察。
2.4 统计学方法

3 结果
3.1 肾功能及肾损伤指标
表2显示,模型组大鼠BUN、Scr、NGAL和KIM-1水平均高于正常组(P<0.05)。给予虫草干预后,低剂量组Scr水平降低(P<0.05),而BUN、NGAL和KIM-1与模型组比较差异无统计学意义(P>0.05);中、高剂量组BUN、Scr、NGAL和KIM-1水平均低于模型组(P<0.05),高剂量组BUN、Scr和NGAL水平均低于低剂量组(P<0.05)。

表2 药物干预后大鼠肾功能及肾损伤指标变化比较
注:BUN:尿素氮;Scr:血清肌酐;NGAL:中性粒细胞明胶酶相关脂质运载蛋白;KIM-1:肾损伤因子-1。与正常组比较:*P<0.05;与模型组比较,△P<0.05;与低剂量组比较:▲P<0.05;与中剂量组比较:#P<0.05
3.2 氧化应激指标
表3显示,与正常组比较,模型组大鼠NO、SOD和T-AOC含量降低,而MDA含量升高(P<0.05)。与模型组比较,3干预组NO含量均升高,MDA含量均降低(P<0.05),中、高剂量组SOD含量升高(P<0.05),高剂量组T-AOC含量亦明显升高(P<0.05)。

表3 给予药物干预后大鼠肾脏NO、NOS、MDA、T-SOD、T-AOC变化比较
注:NO:一氧化氮; MDA:丙二醛;T-SOD:总超氧化物歧化酶;T-AOC:总抗氧能力。与正常组比较:*P<0.05;与模型组比较:△P<0.05;与低剂量组比较:▲P<0.05;与中剂量组比较:#P<0.05
3.3 Caspase-3、Caspase-9、Bax和Bcl-2 基因与蛋白表达

注:1.正常组;2.模型组;3.低剂量组;4.中剂量组;5.高剂量组图1 各组大鼠Caspase-3、Caspase-9、Bax和Bcl-2蛋白电泳图
表4图1显示,与正常组比较,模型组大鼠Caspase-3和Caspase-9表达升高,Bcl-2与Bcl-2/Bax比值均降低(P<0.05)。与模型组比较,低剂量组大鼠Caspase-3和Bax表达降低(P<0.05),而Bcl-2/Bax比值升高(P<0.05);中、高剂量组Caspase-3、9和Bax水平降低(P<0.05),Bcl-2与Bcl-2/Bax比值升高(P<0.05)。
3.4 Tunel细胞凋亡改变
图2显示,正常组大鼠肾组织仅见少量凋亡细胞,模型组大鼠肾组织凋亡细胞(黑色箭头)数量增多。低、中剂量组肾脏凋亡细胞数量有所减少,高剂量组大鼠肾细胞凋亡数量明显减少。
3.5 肾脏病理改变
图3显示,正常组大鼠肾小球、肾小管及肾间质结构基本正常。模型组肾小管管腔扩张或萎缩,可见炎性细胞浸润,大量空泡样变性、变形或局部坏死(黑色箭头所示);肾小球基底膜增厚。低、中剂量组大鼠肾组织的病理变化基本同模型组,高剂量组肾小管结构破坏减少,损伤有所改善。

表4 药物干预后大鼠肾脏Caspase-3、Caspase-9、Bax、Bcl-2基因表达水平比较
注:与正常组比较:*P<0.05;与模型组比较:△P<0.05;与低剂量组比较:▲P<0.05;与中剂量组比较:#P<0.05
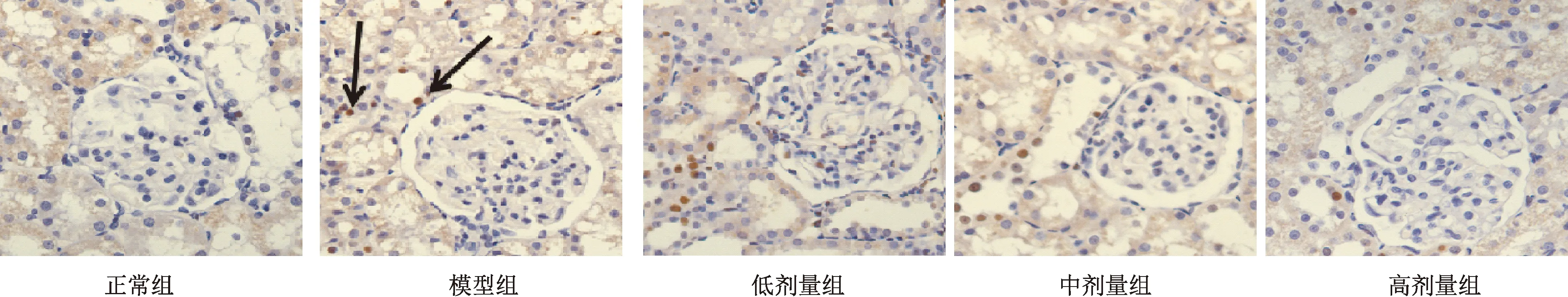
图2 各组大鼠原位肾组织凋亡细胞比较(Tunel ×400)

图3 各组大鼠肾组织病理改变比较(HE染色 ×200)
4 讨论
随着对比剂的临床应用增多,CIN患病率逐年上升。中医根据CIN患者的少尿或无尿等症状,将其归为“癃闭、关格、溺毒”,将对比剂归为“药毒、外邪”[13]。CIN患者多体虚,气虚无力布化津液、无力行血,无力抵御“对比剂”入侵,致使湿瘀毒相互搏结致气血运行逆乱,脏腑功能失调,三焦气化失司,水液输布紊乱,最终出现“癃闭、关格”等症状。冬虫夏草为麦角菌科真菌冬虫夏草菌,其味甘性温,归肾肺二经,有补肺平喘、益肾壮阳、益气生精等功效。邱昌建等[14]研究表明,冬虫夏草可提高SOD和GPX含量,降低MDA含量,起到清除氧自由基、抗氧化损伤的作用。张莉等[15]发现,它可促进糖尿病肾病大鼠肾小管细胞的修复再生,改善肾功能。我们发现,冬虫夏草可预防冠心病稳定型心绞痛及急性冠脉综合征患者介入术后CIN的发生[9]。这些均与冬虫夏草补气、滋补肾脏、改善患者体虚的功效有关。
本研究应用腹腔注射链脲佐菌素及碘克沙醇成功制备糖尿病CIN大鼠模型,结果显示模型组大鼠血清BUN、Scr、NGAL和KIM-1均高于正常组。给予冬虫夏草干预后,上述4个指标有所降低,可见冬虫夏草能够改善糖尿病CIN大鼠的肾功能,减轻肾损伤。CIN发病机制包括肾小管氧化应激损伤,氧自由基及脂质过氧化物生成增多,缩血管物质释放增加加重肾缺血缺氧,肾小管细胞凋亡。SOD是防御内外环境中超氧离子损伤的重要酶,可特异性清除氧自由基,是反映肾脏及机体氧化应激状态的重要指标。本研究模型组大鼠MDA含量升高,NO、SOD和T-AOC含量降低。给予冬虫夏草干预后,3组大鼠MDA含量均降低,高剂量组大鼠NO、SOD和T-AOC指标明显升高。由此可知,冬虫夏草可增加肾组织NO含量,改善肾脏微循环,增加肾血流,减轻肾缺血状态。虫草还可抑制增加SOD和T-AOC含量,增强自由基清除,降低MDA含量,减少脂质过氧化反应,增强抗氧化应激反应。
细胞凋亡信号传递的内源性途径由线粒体途径介导,线粒体Bcl-2家族是其最主要的调控因子,其中抗凋亡基因Bcl-2和促凋亡基因Bax最具代表性。前者能阻遏细胞凋亡,延长细胞寿命,后者主要促进细胞凋亡。Bcl-2/Bax比值增加,细胞趋于存活,比值下降,细胞趋于凋亡。线粒体caspase信号通路的激活在凋亡过程中亦起关键作用。本研究结果显示,模型组大鼠肾脏Caspase-3和Caspase-9 表达水平升高,Bcl-2与Bcl-2/Bax比值降低。这与相关文献结果相似[16]。干预后,低剂量组大鼠Caspase-3和Bax表达降低,Bcl-2/Bax比值升高;中、高剂量组Caspase-3、9和Bax表达降低,Bcl-2与Bcl-2/Bax比值明显升高;高剂量组Bcl-2/Bax比值均高于低、中剂量组。由此推论,冬虫夏草可下调Caspase-3、9和Bax表达水平,上调Bcl-2及Bcl-2 /Bax比值,经线粒体Bcl-2家族传递“保护”信息,抑制caspase-3、9通路的激活,减轻肾细胞凋亡,保护肾脏损伤。这与高剂量大鼠肾凋亡细胞减少和肾小管结构破坏减少相符。
综上所述,冬虫夏草预防糖尿病大鼠CIN发生,可改善肾功能;增强机体抗氧化应激能力,改善肾缺血缺氧;上调Bcl-2 /Bax比值,抑制Caspase-3/9通路的激活,通过调节线粒体凋亡途径重要因子减轻肾细胞凋亡。高剂量冬虫夏草对糖尿病CIN大鼠肾损伤的保护作用更强。

