基于EDTA蚀刻的CdTe/CdS量子点荧光探针检测水环境中痕量镉离子*
王心怡,甘 颖,孙嘉弟,梁 韬,屠佳伟,周书祺,孔留兵,万 浩,王 平
(浙江大学生物传感器国家专业实验室,生物医学工程教育部重点实验室,生仪学院,杭州 310027)
镉是一种毒性极强的重金属,具有较长的生物半衰期(10~20年),易于在生物体内积累,难以降解[1]。国际癌症研究机构(IARC)已将镉定义为人类致癌物[2]。镉也在国内被列为实施排放总量控制的重点监控指标之一。并且过度摄入镉会导致其在肾脏内蓄积影响酶的功能性活动,导致肾功能障碍。除了血压升高外,软骨病,肝脏受损甚至癌症都是镉带来的疾病[3]。我国《生活饮用水卫生标准》中对镉的浓度做了限制,规定镉在饮用水中的浓度低于 5 μg/L。对于非职业暴露人群,最常见的接触源是吸烟和饮食(例如污染的食物和不达标的饮用水)。因此,鉴于其对环境和人类健康的毒性影响,通过对最广泛使用的资源,特别是水环境中的Cd2+的监测是至关重要的。而现有的检测方法如:原子吸收光谱法,电感耦合等离子体质谱法,电化学方法等具有仪器体积大,费用高,操作复杂,不能用于现场快速检测的特征。这些特点使得现场快速,可靠,便携,痕量检测镉离子受到限制。
量子点(QDs)是近些年开发的一类无机荧光团,具有独特的光学性质和电学性能,如较宽并且尺寸可调的激发光谱,较窄且对称的发射光谱,光化学稳定性强,斯托克斯位移大,荧光效率高,合成简单等[4]。由于这些特性,过去十多年量子点被广泛用作荧光纳米传感器,用于检测生物分子、金属离子(如 Cd2+,Cu2+,Pb2+,Ni2+,Hg2+和Ag+等)[5-11]。目前技术比较成熟的是基于Cd2+的量子点,在过去几年中,CdTe量子点在生化荧光传感中很受欢迎。此类量子点在拥有显著优点的同时也有较大的毒性[12]。由于其具有小的尺寸和大的表面积,使得荧光性质极易受周围环境的影响。针对此类问题,采用核壳量子点如CdTe/CdS QDs不仅可以降低量子点的毒性,同时通过包覆有机或者无机壳层也可以大大提高量子点的荧光性能和稳定性[7,13-14]。
在荧光传感器中,荧光“关-开”模式具有降低误判的可能性,比荧光关闭模式更精确[15]。到目前为止,只有少数基于QDs“关-开”模式的荧光传感器用于检测Cd2+被报道,其原理大致分为三种,即“表面钝化”,“化学反应”和“化学蚀刻”。然而,这些传感器对Cd2+的检测限仅达到了11 μg/L~62 μg/L(0.1 μmol/L~0.55 μmol/L)[1,16-19]。根据EPA的标准,需要进一步降低检测限以用于饮用水中Cd2+的定量测定。并且其大多使用单晶体型量子点如CdTe,CdSe,Ag2S QDs等,与核壳型量子点相比具有毒性高,污染环境,荧光性能不稳定等劣势。本文研究了一种极其简便的荧光“关-开”模式的传感器,选择量子产率高,荧光性能强,毒性小的核壳型CdTe/CdS QDs(Em=560 nm),用于高灵敏,高选择性,快速且广泛的检测 Cd2+。其基于EDTA对量子点表面的化学刻蚀,产生特定的Cd2+识别位点,导致荧光猝灭。然后通过引入Cd2+可以识别这些位点并恢复EDTA-QDs体系的荧光。这种荧光“关-开”模式的反应机理如图1所示。

图1 基于EDTA蚀刻的CdTe/CdS量子点检测镉离子的原理图
1 实验部分
1.1 材料和试剂
巯基丙酸(MPA)封端的CdTe/CdS核壳量子点购自星紫(上海)新材料技术开发有限公司;乙二胺四乙酸二钠(EDTA-2Na),氯化钙.无水(CaCl2),氯化钠(NaCl)购自国药集团化学试剂有限公司;三(羟甲基)氨基甲烷(Tris)和其他金属离子标准溶液(如Cd2+、Al3+、Mg2+、Fe2+、Cr3+、Ag+、Cu2+、Hg2+、Pb2+、Zn2+、Mn2+、)均购自Aladdin(阿拉丁);所用试剂均为分析纯,实验用水为二次蒸馏水,由Milli-Q纯水机产生,阻抗≥18.4 MΩ.cm(25 ℃)。
1.2 仪器
卡盒式SpectraMax Paradigm多功能酶标仪(美谷分子仪器(上海)有限公司);PHSJ-4F实验室pH计(上海雷磁仪器厂);超声波清洗机(深圳市洁盟清洗设备有限公司);本研究的所有实验均在室温常压下进行。
1.3 CdTe/CdS量子点表面化学蚀刻实验
为了评估EDTA蚀刻对CdTe/CdS核壳量子点荧光强度的影响,将1 mL 10 mmol/L Tris-HCl缓冲溶液(pH=8.5),200 μL 4 μmol/L的MPA封端的CdTe/CdS量子点和不同量的100 μmol/L EDTA依次加入到2 mL试管,并用Tris-HCl缓冲溶液进一步稀释至体积总体积。
将溶液充分混合后,再放置在黑色避光处反应10 min以测量荧光强度。其中10 mmol/L Tris-HCl(三羟甲基氨基甲烷-盐酸盐)缓冲液的配置方法为称取0.605 7 g的Tris粉末溶解于一定体积的去离子水中,用HCl调节至所需的pH,并将溶液定容至500 mL,得到10 mmol/L的Tris-HCl缓冲液。
1.4 Cd2+检测实验
为了研究Cd2+对EDTA-CdTe/CdS核壳量子点荧光强度的影响,将500 μL 10 mmol/L Tris-HCl缓冲溶液(pH=8.5),100 μL 4 μmol/L的MPA封端的CdTe/CdS量子点和110 μL的100 μmol/L EDTA依次添加到2 mL试管中。
用Tris-HCl缓冲溶液将混合物稀释至试管总体积的二分之一,并放置在黑色避光处反应10 min。然后,加入不同体积的Cd2+标准溶液,用Tris-HCl缓冲溶液将混合物进一步稀释至试管总体积。将溶液充分混合,并放置在黑色避光处反应10 min以测量荧光强度。
2 结果和讨论
2.1 基于EDTA-CdTe/CdS量子点的荧光传感器检测Cd2+的机理表征
Cd2+的引入明显增强了EDTA-CdTe/CdS QDs的荧光强度,这可能是由于在QDs表面上形成Cd-硫醇钝化层。为了进一步证明这一假设,测量了CdTe/CdS QDs与不存在和存在Cd2+的情况下的EDTA-CdTe/CdS QDs的紫外-可见吸收光谱。如图2所示,由于添加了EDTA,CdTe/CdS QDs的特征吸收峰蓝移至更短的波长。在EDTA诱导CdTe/CdS QDs猝灭的荧光发射光谱中发现了类似的蓝移现象(图3)。这些结果表明,EDTA诱导的量子点荧光猝灭是由于量子点周围缺乏Cd-硫醇复合物,这表明量子点与EDTA之间发生了化学蚀刻。

图2 QDs,EDTA-CdTe/CdS QDs,EDTA-CdTe/CdSQDs+Cd2+三种体系的紫外-可见吸收光谱图

图3 EDTA对量子点荧光强度的猝灭效应
此外,在添加Cd2+时,在其吸收光谱(图2)和荧光发射光谱(图7)中均观察到EDTA-CdTe/CdS QDs的轻微红移行为。该现象证实Cd2+的引入重新促使量子点表面的钝化层的形成,使得荧光恢复。
2.2 EDTA诱导的CdTe/CdS量子点的荧光猝灭
图3显示了EDTA对CdTe/CdS QDs 具有明显的荧光猝灭现象。图3(a)为CdTe/CdS量子点在不同浓度EDTA(0 μmol/L,3 μmol/L,6 μmol/L,8 μmol/L,9 μmol/L,10 μmol/L,11 μmol/L,12 μmol/L,14 μmol/L,16 μmol/L,18 μmol/L,20 μmol/L)的存在下的荧光猝灭发射光谱。量子点的浓度选择为0.4 μmol/L,因为过高或过低的量子点浓度会导致灵敏度降低[20]。随着 EDTA 浓度逐渐增大,CdTe/CdS QDs 的荧光发射光谱峰值逐渐减小,当EDTA 浓度增加至14 μmol/L时,QDs的荧光发射强度几乎消失,发射光谱峰值接近0并且保持稳定。同时EDTA浓度的增加也会使得发射光谱伴随有一定程度的蓝移,最佳发射波长从560 nm移动至550 nm。这是由于对于初始的MPA封端的CdTe/CdS QDs来说,有Cd-硫醇配合物作为钝化层消除了量子点表面缺陷,有效的保护了荧光发射。然而,作为广泛使用的金属螯合剂,EDTA能够破坏钝化层并对CdTe/CdS QDs表面进行了化学蚀刻,发生如下的反应方程式:CdTe/CdS @CdMPA+HEDTA3-— CdTe/CdS+MPA+Cd(HEDTA)-+Te2-Cd-MPA 复合物被破坏形成 Cd(HEDTA)-结构,因此QDs的稳定性被破坏,使得CdTe/CdS QDs表面的Cd2+流失而和 EDTA 络合,在QDs表面上形成部分Cd2+空腔。这些空腔被认为是新的表面缺陷,从而导致荧光猝灭。与此同时QDs尺寸减小,导致发射光谱的蓝移。
图3(b)为荧光强度比值I/I0(I和I0指EDTA存在与不存在时CdTe/CdS QDs的荧光强度)与EDTA浓度的关系。随着EDTA浓度逐渐增大,I/I0从1最终下降到0.03左右。图3(b)插图显示当EDTA浓度在6 μmol/L~13 μmol/L范围内时,荧光猝灭效率(1-I/I0)从14%上升至91%,并且荧光强度比值I/I0与EDTA浓度呈现线性相关,相关系数R2=0.987,线性方程为:I/I0=-0.109 6CEDTA+1.539 3。
2.3 实验条件优化
2.3.1 时间的影响
为了得到更好的实验结果,我们探究每一步骤的反应时间。如图4(a)所示CdTe/CdS QDs的荧光强度比I/I0(I和I0分别是t和t0时刻CdTe/CdS QDs的荧光强度)随时间的变化不明显,说明该量子点的稳定性较好,荧光寿命长,受时间影响较小。图4(b)显示了 EDTA(12 μmol/L)蚀刻的CdTe/CdS QDs荧光强度比I/I0(I和I0分别是存在和不存在EDTA时QDs的荧光强度)随蚀刻时间的变化。可以发现 EDTA使得CdTe/CdS QDs的荧光猝灭反应迅速,基本上在最初的1 min内已经完成,在之后的时间内荧光强度比几乎保持不变。因此,选择10 min的总蚀刻时间来制备EDTA-CdTe/CdS QDs荧光探针用于进一步实验是合理的。图4(c)显示了往EDTA(12 μmol/L)蚀刻的CdTe/CdS QDs溶液中加入适量浓度Cd2+(60 μg/L),发生的荧光恢复现象。观察到Cd2+使EDTA-CdTe/CdS QDs体系的荧光恢复效应迅速,基本上在前1 min内发生显著恢复。因此,选择10 min作为Cd2+对 EDTA-CdTe QDs体系的荧光恢复时间,用于进一步的实验是合理的。
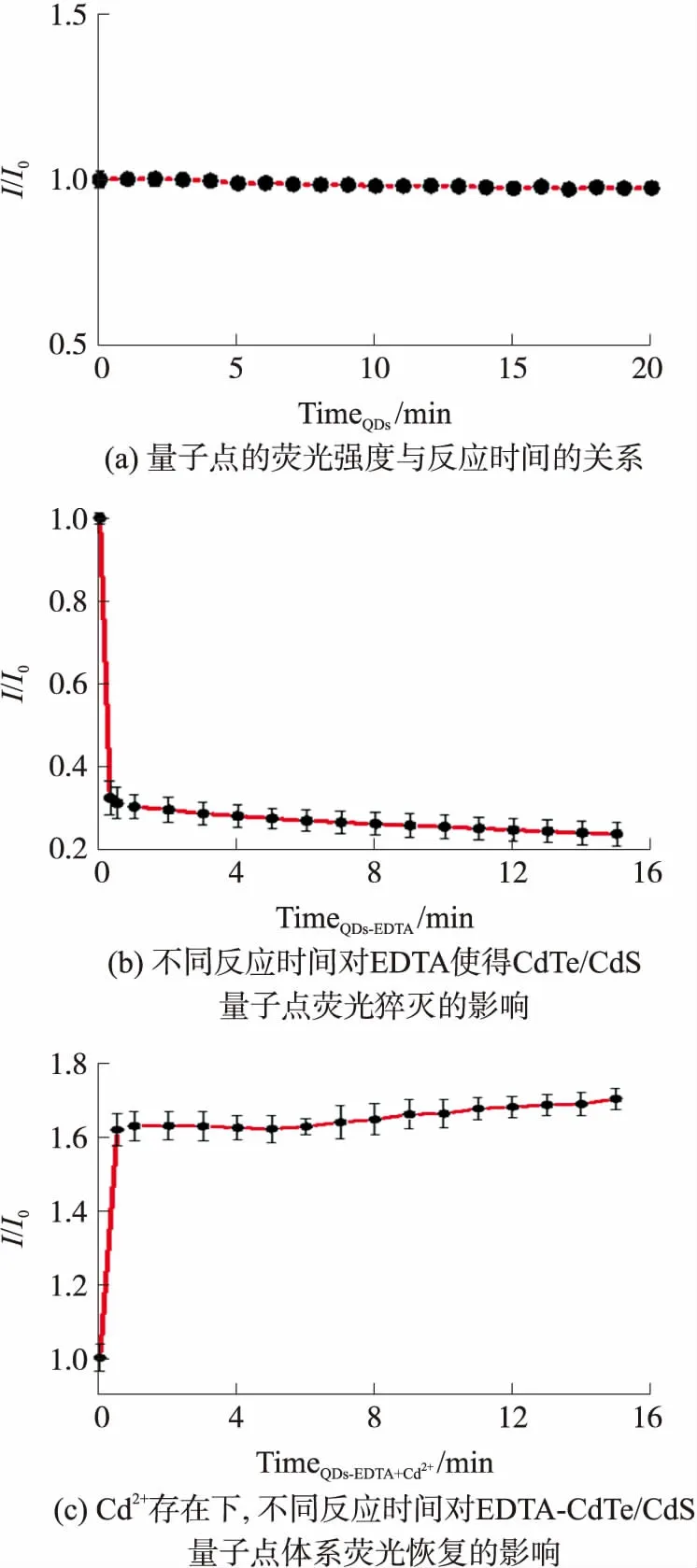
图4 反应时间对该实验的影响
2.3.2 pH的影响
pH是影响Cd2+诱导EDTA-CdTe/CdS QDs体系的荧光恢复灵敏度(荧光特性)的另一个重要因素。本文分别研究了pH值对CdTe/CdS QDs本身和EDTA-CdTe/CdS QDs、EDTA-CdTe/CdS QDs+Cd2+三种体系的影响。用硫醇稳定剂水溶液合成CdTe/CdS量子点得到的信息表明,碱性介质对Cd-MPA复合物的形成是有利的。因此研究7~10.5的pH范围内的荧光强度变化符合Cd2+荧光修复的最佳pH范围。为了保证灵敏度,使用10 mmol/L的Tris-HCl溶液作为缓冲液。
如图5(a)所示,CdTe/CdS QDs在pH值较低的情况下荧光强度较弱,特别是当pH值为7时。这是由于体系的pH值较低时,QDs表面的硫醇基团丧失了作为QDs表面上的钝化层的关键功能,因此QDs具有不稳定性不能保持强荧光[16]。然而当体系的pH值过高时也不利于QDs的荧光强度。因此,CdTe/CdS QDs在pH的值为10时荧光强度最强。
图5(b)说明pH值对EDTA蚀刻的CdTe/CdS QDs的荧光猝灭过程具有强烈影响。这里通过1-I/I0表示猝灭效率,其中I和I0分别是存在和不存在EDTA时CdTe/CdS QD的荧光强度。如图所示,随着pH值的上升,猝灭效率逐渐从77%降至36%,同时QD的荧光强度显示出相反的趋势,逐渐从944,302 a.u.升到5 605,300 a.u.。该结果是由于CdTe/CdS QDs表面的硫醇基团在低pH值(如7或8)下不稳定,即Cd-硫醇络合物易分解[21]。这恰好为EDTA与Cd2+的螯合创造了机会。因此,EDTA-CdTe/CdS QDs体系在pH的值较低的情况下荧光猝灭情况最好。

图5 pH对该实验的影响

基于上述的综合分析,可以发现当pH值等于8.5时,巯基丙酸封端的CdTe/CdS核壳量子点具有更好的稳定性及较高的原始荧光强度,并且EDTA诱导的CdTe/CdS量子点的荧光猝灭效率较高。所有这些因素对于提高Cd2+诱导的EDTA-CdTe/CdS量子点的荧光增强效率是有意义的。因此,在所有后续检测中使用pH为8.5的Tris-HCl缓冲液。
2.3.3 EDTA浓度的影响
一般而言,Cd2+在使得量子点荧光恢复过程中的作用不可避免地基于QDs本身荧光性质和EDTA对QDs的蚀刻程度,本研究选择了高量子产率(≥60%),高光学稳定性的核壳型CdTe/CdS QDs。因此研究EDTA对Cd2+诱导的EDTA-CdTe/CdS QDs体系荧光恢复的影响是必要的。EDTA浓度对EDTA-CdTe/CdS QDs体系的荧光背景和对Cd2+响应的敏感性有显着影响。如图6(a)、6(b)所示,在没有EDTA蚀刻的情况下,CdTe/CdS QDs与不同浓度的Cd2+(10 μg/L~1 000 μg/L)相互作用时,QDs的荧光强度没有显着的变化。这是因为未被蚀刻的CdTe/CdS QDs表面与Cd2+的结合位点比较少,非常容易达到饱和。从图6(c)中可以看出,在各种浓度的EDTA(分别为10 μmol/L,10.5 μmol/L,11 μmol/L,11.5 μmol/L,13 μmol/L,14 μmol/L)存在下,添加的Cd2+可以使EDTA-CdTe/CdS QDs体系产生明显不同的荧光恢复。通过I/I0-1(I和I0分别是存在和不存在Cd2+时QDs的荧光强度)表示荧光恢复效率,较低或较高浓度的EDTA均显示出较低的EDTA-CdTe/CdS QDs荧光恢复效率。例如,当Cd2+浓度固定在200 μg/L时,随着EDTA浓度从10增加到11 μmol/L,恢复效率从1.04增加到2.15。这是因为当EDTA的浓度较低时,不能在QD表面上产生足够的Cd2+空腔。随着EDTA浓度的逐渐增加,量子点表面的Cd2+识别位点的数量也随之增加,进而增加荧光恢复效率。然而,当EDTA浓度从11 μmol/L增加到14 μmol/L,恢复效率从2.15降至0.22。这是因为当EDTA的浓度太高时,过量的EDTA可能在竞争机制中与后添加的Cd2+螯合,这阻碍了添加的Cd2+与QD表面上的Cd2+空腔的重组。并且增加EDTA的浓度也会加速Te2-的氧化。导致QD结构的严重破坏,影响光学性质,降低荧光恢复效率。因此预期使Cd2+识别位点达到最大化的EDTA的临界浓度为11 μmol/L。此时EDTA诱导的量子点荧光猝灭效率为62%。
上述结果一方面表明EDTA浓度对该实验的影响,另一方面以未被EDTA蚀刻过的CdTe/CdS QDs作为对照组说明EDTA-CdTe/CdS QDs荧光探针检测Cd2+的可行性。

图6 EDTA浓度对该实验的影响
2.4 Cd2+诱导的EDTA-CdTe/CdS量子点的荧光增强
Cd2+本身不会影响宽浓度范围的MPA封端的CdTe/CdS QDs的荧光强度(图6)。然而,EDTA-CdTe/CdS QDs的荧光强度随着添加的Cd2+浓度的增加而不断恢复,这是因为EDTA诱导的CdTe/CdS QDs的荧光猝灭归因于作为量子点表面钝化层的Cd-硫醇络合物的部分损失。因此,通过添加Cd2+诱导再次形成Cd-硫醇复合物,恢复这些EDTA蚀刻的CdTe/CdS QDs的荧光强度是有意义的。但是由于EDTA对量子点的化学蚀刻效应是以Te2-的氧化为代价[22]。因此由于氧化导致的部分Te2-的损失使得量子点的完全重建是不可能的,如图2(a)中未蚀刻的CdTe/CdS QDs的荧光强度高于图7(a)插图中恢复后的量子点荧光强度。表明添加Cd2+并不能使量子点的荧光强度完全恢复至初始强度。

图7 Cd2+对EDTA蚀刻的CdTe/CdS QDs的荧光增强效应

2.5 基于EDTA-CdTe/CdS量子点的荧光传感器选择性探究
为了研究这种基于EDTA-CdTe/CdS QDs的荧光传感器的选择性,进行了一系列干扰实验以评估在各种阳离子(如Cd2+、Al3+、Mg2+、Fe2+、Cr3+、Ag+、Cu2+、Hg2+、Pb2+、Zn2+、Mn2+)存在时该传感器对Cd2+的选择性响应。其中Na+、K+、Al3+、Ca2+、Mg2+、Cr3+、Mn2+的浓度为15 μmol/L,Ag+、Fe2+、Cu2+、Hg2+的浓度为6 μmol/L,Zn2+、Pb2+、Cd2+具有相同的浓度为1 μmol/L。从图8中可以看出,即使干扰离子如Na+、K+、Al3+、Ca2+、Mg2+、Cr3+、Mn2+、Fe2+的浓度远高于Cd2+,但其对EDTA-CdTe/CdS QDs体系的荧光强度的影响也可忽略不计。Ag+、Cu2+、Hg2+的添加浓度是Cd2+的6倍,显示出明显的猝灭效应。这是由于配体的竞争在猝灭效应中起主要作用,因为它们对硫醇的S的亲和力比对Cd2的亲和力更强[23]。此外,由于CuTe,Ag(Te)2和HgTe的溶解度低于CdTe,当添加Ag+、Cu2+、Hg2+后很容易在量子点表面形成CuTe,Ag(Te)2和HgTe。这也可能是荧光淬火现象的原因[21],[24]。只有Zn2+和Cd2+导致QDs的荧光恢复效应明显。这归因于类似的机制,即在QDs周围形成表面钝化层Zn-硫醇或Cd-硫醇,导致荧光增强[16]。虽然Zn2+对该体系呈现荧光增强的效应,但对于同等浓度的Zn2+和Cd2+,Zn2+使得该体系的荧光恢复效率为1.52,其恢复程度远弱于Cd2+,即2.54。基于上述结果,本工作提出的荧光探针基本上可以作为高选择性检测Cd2+的荧光传感器。

图8 各种干扰离子对EDTA-CdTe/CdS QDs荧光传感器选择性的影响
2.6 基于EDTA-CdTe/CdS QDs的荧光传感器在实际水样中检测Cd2+
为了评估本文基于EDTA-CdTe/CdS QDs的荧光传感器检测Cd2+的方法的实用性。在自来水中实施一系列实际样品的检测实验。通过有意引入不同浓度水平的Cd2+制备所有样品,获取掺加三种浓度水平(300 μg/L,500 μg/L和700 μg/L)的Cd2+的自来水样品。如表1所示,该传感器测量每个样品的回收率较高并且相对标准偏差(RSD)不超过5%。

表1 自来水中Cd2+的测定结果
通常,许多常见的金属阳离子,如Ca2+,Mg2+,Mn2+和Cu2+,可存在于自来水中。通过传感器确定的水样结果充分证明这些阳离子几乎不会干扰Cd2+的检测。有效地证明了所提出的用于检测Cd2+的荧光传感器是可靠和实用的。
3 结论
本文研究了一种基于EDTA蚀刻的CdTe/CdS量子点的荧光传感器,用于简便,迅速检测水环境中的痕量镉离子。该传感器基于荧光“关-开”模式。随着EDTA的引入,QDs的荧光强度被淬灭。Cd2+的存在使EDTA-CdTe/CdS QDs的荧光强度逐渐恢复。通过优化反应时间、pH值和EDTA浓度等条件,制备的EDTA-CdTe/CdS QDs系统可以作为水样中Cd2+检测的荧光传感器,并且具有两个连续线性响应范围10 μg/L~300 μg/L和300 μg/L~1 000 μg/L,可以满足Cd2+的较大浓度范围的测定。检出限为0.22 μg/L,达到了国家二类水质标准(GB/T 14848-93)对Cd2+的检出限要求。此外,该荧光传感器对其他干扰离子的选择性优于1%,并具有毒性低,响应灵敏,检测线性范围宽(10 μg/L~1 000 μg/L)的特点,在实际样品检测中具有良好的应用前景。

