氟对体外培养LS8细胞增殖、氧化应激与凋亡的作用研究
李珏丹 崔敏

[摘要]目的:观察氟化物对小鼠成釉细胞样细胞(LS8细胞)增殖、氧化应激以及凋亡的影响。方法:取对数生长期的LS8细胞,在培养液中分别加入终浓度为0、0.5、1、2、4和8mM的氟化钠(NaF)溶液,培養24h和48h后,CCK-8检测细胞增殖;倒置显微镜观察细胞形态;生化方法检测细胞丙二醛(MDA)含量及超氧化物歧化酶(SOD)活性;qRT-PCR检测过氧化氢酶(Cat)、谷胱甘肽过氧化物酶1(Gpx-1)和谷胱甘肽S转移酶(Gst)mRNA水平;流式细胞术检测细胞凋亡;Western blotting检测caspase-9和caspase-3蛋白表达改变。结果:过量氟抑制LS8细胞增殖,且随着NaF浓度增加,细胞增殖呈下降趋势;过量氟显著增加LS8细胞内MDA含量,降低SOD活性及Gpx-1、Gst mRNA表达水平;过量氟引起LS8细胞形态改变和细胞凋亡,且伴随着caspase-9,caspase-3表达的显著增加。结论:过量氟抑制LS8细胞增殖,扰乱细胞的氧化与抗氧化平衡并诱发氧化应激,持续的氧化应激最终导致细胞凋亡。
[关键词]氟化物;LS8细胞;增殖;氧化应激;凋亡
[中图分类号]R329.2+8 [文献标志码]A [文章编号]1008-6455(2019)09-0089-04
牙釉质发育期,机体长期摄入过量氟可导致氟牙症发生,引起牙釉质白垩色条纹或斑块,重者伴釉质缺损,严重影响患者的咀嚼功能和颜面美观[1-2]。然而氟牙症缺乏有效治疗手段,因而探究氟牙症发病机制,对于有效控制氟牙症发生具有重要现实意义。釉原蛋白在釉质形成后期未得到充分降解而滞留于釉基质中,影响釉质矿化,导致氟牙症发生[3-4]。釉原蛋白滞留的机制主要包括过量氟对釉基质蛋白、釉基质蛋白酶及成釉细胞的影响等,多数学者认为过量氟可下调成熟成釉细胞中釉基质蛋白酶KLK4表达[3,5-6],对釉基质蛋白酶MMP20及釉基质蛋白的表达无明显影响[3,5,7-8]。目前过量氟对成釉细胞增殖、氧化应激和凋亡的影响报道较少且尚未完全阐明。本研究用不同浓度氟化钠(sodium fluoride,NaF)作用于体外培养的小鼠成釉细胞样细胞(LS8细胞),观察其对细胞增殖、氧化应激和凋亡的影响,为研究氟牙症的发病机制提供科学依据。
1 材料和方法
1.1 实验试剂:LS8细胞由美国南加州大学分子生物学实验室Malcolm L. Snead教授馈赠,高糖DMEM培养基、青霉素、链霉素、胰蛋白酶(Hyclone,美国),胎牛血清(FBS,Gibco,美国),Annexin V-PE/7-AAD(BD Biosciences,美国),RevertAid First Strand cDNA Synthesis Kit反转录试剂盒、BCA蛋白定量试剂盒、Marker(Thermo Fisher Scientific,美国),SYBR?Premix Ex TagTM试剂盒(TaKaRa,日本),RIPA裂解液(Beyotime,中国),caspase-9、caspase-3抗体(Cell Signaling Technology,美国)。
1.2 实验仪器:Thermo Forma二氧化碳培养箱(Thermo Fisher Scientific,美国),自动酶联检测仪(Tecan,奥地利),实时定量PCR仪(Agilent Technologies,美国),微量核酸蛋白定量仪Nano Drop 2000(Thermo Fisher Scientific,美国),凝胶成像分析系统(Gene有限公司,美国)。
1.3 实验方法
1.3.1 LS8细胞培养与传代:用10% FBS、100U/ml青霉素和100mg/ml链霉素的高糖DMEM培养液,在37℃、5% CO2及饱和湿度条件下培养LS8细胞,隔天换新鲜培养基。待细胞融合至培养瓶的80%~90%时胰酶消化,传代培养。
1.3.2 细胞增殖活力检测:用终浓度为0、0.5、1.0、2.0、4.0和8.0mM的NaF溶液孵育96孔板中的LS8细胞(100μl/孔),每组3个复孔。24h和48h后,每孔加入10μl CCK-8溶液继续孵育4h。酶联仪测定各孔的吸光度值,绘制细胞生长曲线。所有实验重复3次。
1.3.3 细胞凋亡检测:终浓度为0、1、2mM的NaF溶液孵育LS8细胞48h后消化,800rpm离心5min,预冷PBS洗涤细胞2次。加入1×Binding Buffer重悬并调节细胞密度1×106/ml,取100μl悬液于流式管内,加入PE Annexin V和7-AAD各5μl混匀后避光、室温15min后,加入400μl 1×Binding Buffer混匀,样品于1h内通过流式细胞仪检测。
1.3.4 细胞氧化应激检测:用终浓度为0、1、2mM的NaF溶液孵育6孔板中的LS8细胞,24h后每孔加入100μl细胞裂解液,1min后每孔再加入300μl PBS把贴壁细胞充分吹打下来,操作过程均在冰浴上进行。制备好的细胞匀浆用于MDA和SOD的测定。
1.3.5 实时定量PCR检测:终浓度为0、1、2mM的NaF溶液孵育LS8细胞24h后Trizol试剂提取总RNA,通过酶标仪检测RNA浓度和纯度。根据反转录试剂盒操作说明对2μg总RNA进行反转录合成cDNA。实时定量PCR仪进行实时荧光定量PCR,PCR反应体系:5μl SYBR Green PCR反应液、0.4μl cDNA模板、1μl PCR引物,加双蒸水至10μl。β-Actin为内参对照,采用2-ΔΔCT法对样本进行相对定量。引物序列见表1。
1.3.6 Western blotting:用终浓度为0、1、2mM NaF培养液培养LS8细胞48h后加入RIPA裂解液,冰上裂解后离心收集上清。BCA法测蛋白浓度,取细胞总蛋白25μg,5μl Marker,进行10% SDS-PAGE电泳。在200mA恒流条件下,转膜1.5h至PVDF膜。用含5%脱脂奶粉的TBST溶液室温封闭PVDF膜2h。后分别加入抗兔caspase-9、caspase-3、β-Actin抗体,4℃孵育过夜,TBST洗膜后用山羊抗兔IgG(H+L)二抗室温孵育1.5h。用TBST洗膜后,将PVDF膜置于凝胶成像分析系统实验盒中,ECL发光液均匀放置于PVDF膜上,调整参数曝光后用图像分析仪处理。
1.3.7 统计学分析:数据用(x?±s)表示,使用SPSS 19.0统计软件,两组数据间的比较采用Student t检验,P<0.05为差异具有统计学意义。
2 結果
2.1 氟化物对LS8细胞增殖活力的影响:染氟24h和48h,随着NaF浓度增加,LS8细胞增殖活力逐渐下降,LS8细胞的存活率呈下降趋势(与0mM比较,P<0.05)。见表2,图1。
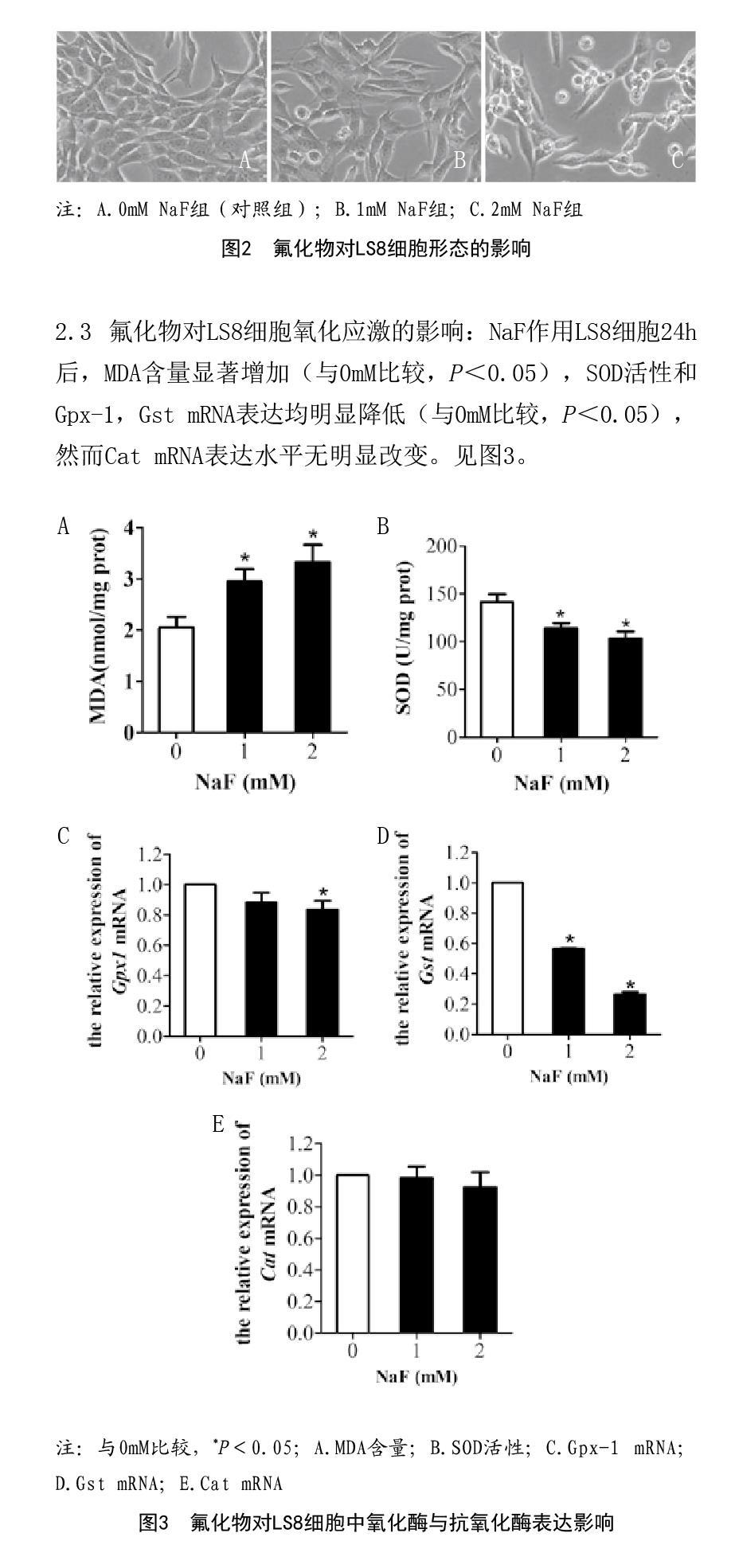
2.2 氟化物对LS8细胞形态的影响:对照组LS8细胞生长状态良好,细胞轮廓清晰,呈典型的上皮细胞形态,多为长梭形或多角形。与对照组相比,1mM NaF组细胞胞体呈现不同程度的皱缩,出现少量细胞凋亡。2mM NaF组细胞胞体明显收缩、变小,细胞形态发生明显改变,细胞数量明显下降,间隙增大,凋亡细胞数目明显增多。见图2。
2.3 氟化物对LS8细胞氧化应激的影响:NaF作用LS8细胞24h后,MDA含量显著增加(与0mM比较,P<0.05),SOD活性和Gpx-1,Gst mRNA表达均明显降低(与0mM比较,P<0.05),然而Cat mRNA表达水平无明显改变。见图3。
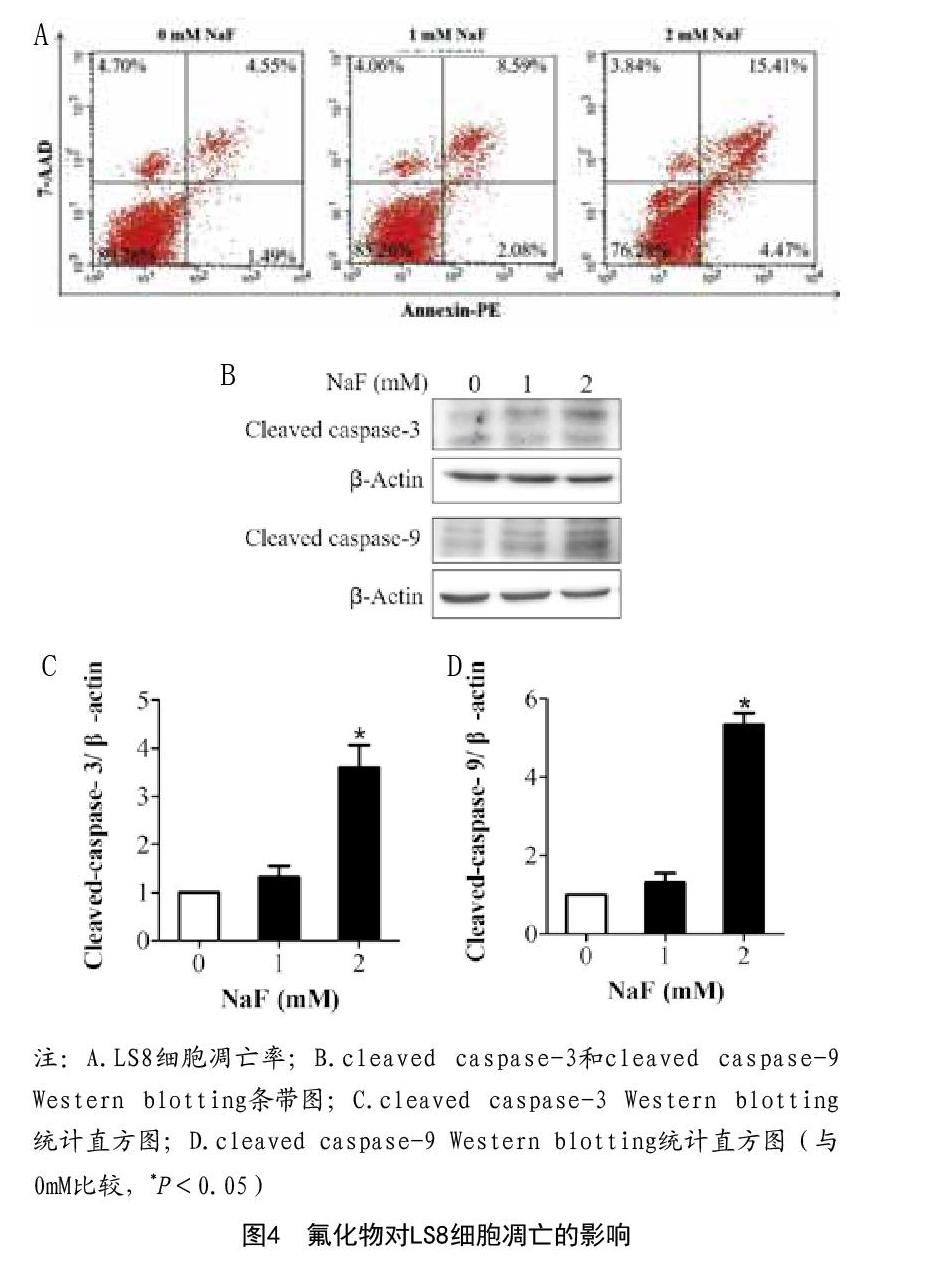
2.4 氟化物对LS8细胞凋亡的影响:Annexin V-PE/7-AAD双染法结果显示:NaF作用LS8细胞48h后,随着NaF浓度增加,LS8细胞凋亡率逐渐增高(与0mM比较,P<0.05)(图4A)。Western blotting检测结果显示:1mM NaF作用LS8细胞48h后,cleaved caspase-9,cleaved caspase-3蛋白表达轻微增加,2mM NaF作用LS8细胞48h后,cleaved caspase-9,cleaved caspase-3蛋白表达均显著增加(与0mM比较,P<0.05)(图4B~D)。
3 讨论
成釉细胞是釉质形成的关键细胞[9]。LS8细胞系是分离自小鼠第一磨牙成釉器上皮并被永生化的细胞系,用于釉质发育和氟牙症发病机制的研究[10-11]。本研究中笔者通过建立体外染氟LS8细胞模型,来观察氟化物对细胞增殖,氧化应激和凋亡的影响。
氟化物可影响成釉细胞增殖活性,但对其具体作用尚具有争议。马林、王琳等[12-14]分别将0、0.4、0.8、1.6、3.2和6.4mM NaF作用于原代培养大鼠成釉细胞和大鼠类成釉细胞系HAT-7 24、48和72h后,发现0.4和0.8mM NaF促进细胞增殖,1.6、3.2和6.4mM NaF则抑制细胞增殖,认为氟化物对成釉细胞增殖具有双重作用。然而Yang,Zhao等[15-16]将0、0.5、1、1.5、2mM NaF作用于小鼠成釉细胞样细胞系LS8 24、48和72h时,发现NaF降低LS8细胞增殖活性。本研究中笔者将0、0.5、1、1.5、2、4、8mM NaF作用于LS8细胞24、48h后发现NaF降低LS8细胞增殖活性,呈剂量和时间依赖关系,与Yang、Zhao等结果一致。推测与马林、王琳等研究结果略有不同的可能原因为选用的细胞系和体外实验条件不同,导致不同细胞系对氟化物耐受力也不完全相同。研究还显示4mM、8mM NaF处理LS8细胞24h和48h后,细胞存活率明显低于50%,因此选用1mM、2mM NaF浓度用于后续实验。
过量氟摄入可干扰氧代谢引起脂质过氧化反应,同时消耗抗氧化物和自由基清除酶类,导致氧化与抗氧化失调进而诱发氧化应激,对机体造成损伤。脂质过氧化产物MDA的含量和抗氧化酶SOD、Gpx,Gst和Cat的活性常被用作评估氧化应激的重要指标[17-18]。本研究显示过量氟使LS8细胞中MDA含量增加,SOD活性及Gpx-1,Gst mRNA水平降低,提示过量氟可促进LS8细胞脂质过氧化,降低抗氧化酶活性,使细胞处于氧化应激状态。结果还显示过量氟对Cat无明显影响,推测可能原因为各抗氧化酶对氟敏感程度不一,也可能与复杂的氧化与抗氧化系统有关。
细胞凋亡通路主要包括caspase-9介导的线粒体途径、caspase-8介导的死亡受体途径及caspase-12介导的内质网应激途径[19]。上述途径最后均通过激活下游caspase-3,引发细胞形态改变,导致细胞凋亡[19]。本文采用Annexin V-PE/7-AAD双染法检测示1mM和2mM NaF作用LS8细胞48h后引起细胞显著凋亡。利用Western blotting发现1mM NaF作用48h时细胞中caspase-9和caspase-3活化蛋白轻微增加,而2mM NaF作用时细胞中caspase-9和caspase-3活化蛋白显著增加,提示过量氟诱导的LS8细胞凋亡很可能与线粒体凋亡途径激活有关。值得注意的是,1mM NaF作用LS8细胞48h后,Annexin V-PE/7-AAD双染法显示细胞凋亡显著增加,但Western blotting示caspase-9和caspase-3蛋白轻微活化,推测可能与Western blotting检测不如Annexin V-PE/7-AAD双染法敏感有关。
综上所述,本实验探究了过量氟对细胞增殖、氧化应激和凋亡的影响,发现过量氟抑制LS8细胞增殖,扰乱细胞氧化与抗氧化平衡并诱发氧化应激,持续的氧化应激最终导致细胞凋亡,而凋亡很可能与线粒体途径激活有关,其具体机制待深入探究。
[参考文献]
[1]Everett ET.Fluoride's effects on the formation of teeth and bones,and the influence of genetics[J].J Dent Res,2011,90(5):552-560.
[2]Nair R,Chuang JC,Lee PS,et al.Adult perceptions of dental fluorosis and select dental conditions-an Asian perspective[J].Community Dent Oral Epidemiol,2016,44(2):135-144.
[3]Suzuki M,Shin M,Simmer JP,et al.Fluoride affects enamel protein content via TGF-beta1-mediated KLK4 inhibition[J].J Dent Res,2014,93(10):1022-1027.
[4]Lyaruu DM,Medina JF,Sarvide S,et al.Barrier formation:potential molecular mechanism of enamel fluorosis[J].J Dent Res,2014,93(1):96-102.
[5]Sharma R,Tsuchiya M,Skobe Z,et al.The acid test of fluoride: how pH modulates toxicity[J].PLoS One,2010,5(5):e10895.
[6]Gao J,Ruan J,Gao L.Excessive fluoride reduces Foxo1 expression in dental epithelial cells of the rat incisor[J].Eur J Oral Sci,2014,122(5):317-323.
[7]Den Besten PK.Effects of fluoride on protein secretion and removal during enamel development in the rat[J].J Dent Res,1986,65(10):1272-1277.
[8]Sharma R,Tye CE,Arun A,et al.Assessment of dental fluorosis in Mmp20 +/- mice[J].J Dent Res,2011,90(6):788-792.
[9]He P,Zhang Y,Kim SO,et al.Ameloblast differentiation in the human developing tooth:effects of extracellular matrices[J].Matrix Biol,2010,29(5):411-419.
[10]Chen LS,Couwenhoven RI,Hsu D,et al.Maintenance of amelogenin gene expression by transformed epithelial cells of mouse enamel organ[J].Arch Oral Biol,1992,37(10):771-778.
[11]Sarkar J,Simanian EJ,Tuggy SY,et al.Comparison of two mouse ameloblast-like cell lines for enamel-specific gene expression[J].Front Physiol,2014,5:277.
[12]馬林,张颖,张凯强,等.不同浓度氟化物对体外培养成釉细胞活性的影响[J].口腔医学,2013,33(10):4.
[13]马林,张颖,钟鸣,等.氟对体外培养大鼠成釉细胞HAT-7细胞活性和对对细胞内Ca2+浓度的影响[J].实用口腔医学杂志,2015,31(1):7-10.
[14]王琳,王峰,谢娜,等.氟对原代培养大鼠成釉细胞增殖、凋亡的影响[J].中华地方病学杂志,2017,36 (7):485-490.
[15]Yang T,Zhang Y,Li Y,et al.High amounts of fluoride induce apoptosis/cell death in matured ameloblast-like LS8 cells by downregulating Bcl-2[J].Arch Oral Biol,2013,58(9):1165-1173.
[16]Zhao L,Li J,Su J,et al.LS8 cell apoptosis induced by NaF through p-ERK and p-JNK-a mechanism study of dental fluorosis[J].Acta Odontol Scand,2016:1-11.
[17]Sifuentes-Franco S,Padilla-Tejeda DE,Carrillo-Ibarra S,et al.Oxidative stress,apoptosis,and mitochondrial function in diabetic nephropathy[J].Int J Endocrinol,2018,2018:1875870.
[18]Sies H.Oxidative stress:a concept in redox biology and medicine[J].Redox Biol,2015,4:180-183.
[19]Elmore S.Apoptosis:a review of programmed cell death[J].Toxicol Pathol,2007,35(4):495-516.
[收稿日期]2019-02-25
本文引用格式:李珏丹,崔敏,许莹,等.氟对体外培养LS8细胞增殖、氧化应激与凋亡的作用研究[J].中国美容医学,2019,28(9):89-92.

