高强度间歇游泳运动对有训练大鼠心肌miRNA的差异表达及相关调控通路分析
胡荣光,赵彦宏,张瑞萍,张安民*,钱帅伟
(1.山西财经大学 体育学院,山西 太原030006;2.鲁东大学 农学院,山东 烟台264025;3.烟台大学 体育学院,山东 烟台264005)
间歇训练特别是高强度间歇运动对人体肌肉、心脏等器官都形成较大刺激,可显著增强心脏泵血功能、引起心脏生理性肥大(Ito et al.,2016),但同时又有引起心肌缺血、心肌纤维化等病理过程的潜在风险(饶志坚 等,2016;王林佳 等,2016)。随着表观遗传学的不断发展,有研究发现,微小核糖核酸(microRNA,miRNA)可通过调控其靶基因表达而参与调节心肌细胞的增殖、分化、凋亡等生理过程(钱帅伟 等,2014)。因此,可从间歇训练诱导miRNA及其靶基因表达变化的视角,研究间歇训练导致心脏重塑的可能调控通路。
miRNA 是一类广泛存在于动植物体内的小分子非编码RNA,长度约为18~25 个核苷酸,主要通过转录后水平的负性调控,实现对基因表达的调节作用(贾明学 等,2013)。已有研究表明,不同运动方式、强度和时间可引起心脏miRNA 的应答,影响基因表达和蛋白质的翻译,进而影响心脏功能,目前已证实有miR-1、miR-21、miR-24、miR-29、miR-133、miR-155、miR-146a、miR-208、miR-350、miR-30c 等参与运动心脏的重塑过程(饶志坚 等,2017a,2017b;王世强 等,2017;翟帅 等,2014;张振辉 等,2012;赵永才,2012),但以往研究结果倾向于对心脏功能的“良性”影响,而对“风险”miRNA 的客观研究和阐释不足。心脏功能的维持是众多呈现空间特异性与高度时效性表达的基因共同参与的结果,不同功能的基因共同组成一个复杂的调控网络,其中必然有许多能够响应间歇训练的miRNA参与对这些基因的调控。那么,除了目前发现的几种miRNA,心脏还有哪些能够响应间歇训练的运动刺激?参与调控的特异性miRNA 及其靶基因分别有什么作用?这些miRNA 调控其靶基因的机制为何?随着运动分子生物学的深入研究,这些问题将是今后研究的焦点问题。本研究旨在鉴定大鼠心脏中响应高强度间歇运动而差异表达的miRNA,并根据miRNA 与其靶基因的表达谱,解释大鼠心脏响应高强度间歇运动的基因表达调控通路。
1 材料与方法
1.1 研究对象与分组
选取健康雄性Wistar 大鼠20 只,随机分为2 组,对照(control check,CK)组10 只,高强度间歇游泳训练(high- intensity intermittent swimming training,HIST)组10 只。室温20℃~25℃,湿度45%~60%,光照时间14 h/天。动物经3 天时间适应环境后开始建模训练。
1.2 训练模型建立
课题组前期研究发现,有训练大鼠对一次高强度间歇运动的应激反应程度虽不如安静大鼠表现强烈,但同样能够反映一次HIST 的应激生理反应,且实验结果的一致性明显好于安静大鼠,数据离散程度更低,可靠性更高,因此,本研究选择有训练大鼠作为实验对象(张瑞萍 等,2011)。
根据Mcardle(1967)、Voltarelli(2002)的理论,参考徐玉林(1999)、严翊(2006)的研究方法,建立大鼠HIST 模型(张瑞萍 等,2011)。游泳条件:塑钢玻璃游泳池,长×宽×高为150×60×70 cm;泳池内水深为大鼠身体长度的2 倍,约60 cm;水温33℃~36℃。适应性游泳3 天,每天1 次,每次持续时间依次为第1 天15 min、第2天20 min、第3 天30 min,剔除不擅游泳者。随后开始正式间歇负重游泳训练,每周连续训练6 天,第7 天休息,共训练6 周。运动强度为尾部负重体重的5%,游泳持续6 min,休息4 min,每天连续进行10 轮;游泳期间观察记录大鼠的运动能力及活动状态,当大鼠浮在水面不运动时用木棒驱赶使其维持运动,当大鼠下沉水下无能力浮上时立刻托起减少负重至3%;训练结束后吹干毛发,放回鼠笼。
为判断模型是否建立成功,在第1 周第1 天训练前、第 1 天每 1 轮次后分别测量大鼠血乳酸(德国 EKF Lactate-Scout 血乳酸仪),依次标记为安静值、变化值1、变化值2、……、变化值10。CK 组不做任何运动,常规饲养,自由活动。
1.3 动物取材
第6 周第6 天HIST 组、CK 组均进行间歇负重游泳训练,结束后即刻进行动物取材。两组大鼠立即同时注射麻醉,并断颈处死,解剖出心脏左心室肌,立即放入液氮中冷冻。最后保存于-80℃冰箱中备用。
1.4 miRNA 分离与文库构建
在液氮中将每只大鼠左心室肌样品研磨成粉末,并用TRIzol 试剂(Invitrogen 公司)提取总RNA,将各RNA 样品按组等量混合成2 个RNA 样品池:HIST 组RNA 样品池与CK 组RNA 样品池。通过15%变性聚丙烯酰胺凝胶电泳从各RNA 样品池中分别分离纯化出16~30 nt 的小RNA(sRNA)。然后用T4 RNA 连接酶在每个小RNA 的5'段和3'端加上接头,用SuperScript Ⅱ反转录酶(Invitrogen 公司)将其合成为cDNA,再经过RT-PCR 扩增获得双链cDNA。经10%变性聚丙烯酰胺凝胶电泳分离、回收及纯化后的cDNA 用于构建sRNA 测序文库。采用NEB Next Ultra small RNA Sample Library Prep Kit for Illumina 试剂盒构建sRNA 测序文库。最后由北京百迈客生物公司在Illumina HiSeq2500 测序仪上进行高通量测序分析。
1.5 高通量测序数据的预处理
在高通量测序原始数据的基础上,对其进行如下过滤处理:1)将低质量序列去掉;2)去除包含未知碱基的reads;3)去除没有3'接头序列的reads;4)剪切掉3'接头序列;5)去除短于18 nt 或长于30 nt 的序列。经过滤处理后,获得长度为18~30 nt 的高质量的clean reads。然后,再通过对Rfam 和GenBank 数据库进行相似性搜索,过滤掉可能是mRNA、rRNA、tRNA、snRNA、snoRNA、srpRNA 和scRNA 等的序列。
1.6 已知miRNA 的鉴定
运用BLAST 程序,将过滤后剩余的sRNA 序列与miRBase 数据库搜索比对,凡是能与数据库中已储存动物物种的已知miRNA 匹配的sRNA 序列,就可以将其看作是一个已知miRNA。
1.7 预测新的候选miRNA
运用Soap 程序将剩余未注释的sRNA 序列与大鼠基因组序列进行比对,挑选出能与大鼠基因组序列完美匹配的sRNA 序列。然后,利用miRNA 预测软件MIREAP 从中预测出新的候选miRNA(novel miRNA)。
1.8 miRNA 差异表达分析
基于sRNA 高通量测序数据,计算出每个miRNA 的表达量。首先将两组大鼠各自miRNA 的表达量进行标准化处理,然后对这两组间的miRNA 进行差异表达分析。使用|log2(FC)|≥1 且错误发现率(FDR)≤0.01 作为差异表达的筛选标准(Jiang et al.,2018),其中,以差异倍数(Fold Change,FC)表示两组间表达量的比值,即HIST 组表达量与CK 组表达量之间的比值。若log2(FC)≥1,则表示miRNA表达上调;若log2(FC)≤-1,则表示miRNA 表达下调。
1.9 miRNA 靶基因预测及功能富集分析
针对差异表达miRNA,运用miRNA 靶基因预测软件miRanda、RNAhybrid 和TargetScan 从NCBI 数据库中大鼠基因对应的cDNA 序列中预测出miRNA 对应的靶基因。这里使用大鼠基因对应的cDNA 序列来自:(ftp://ftp.ncbi.nih.gov/gene/DATA/GENE_INFO/Mammalia/Rattus_norvegicus.gen e_info)。然后,对miRNA 靶基因进行功能注释,对其进行GO 与KEGG 分析,进而预测出miRNA 可能的调控功能。
2 结果与分析
2.1 建模情况
第1 周第1 天测得血乳酸安静值(6.79±1.41 mmol/L),血乳酸变化值随轮次增加逐渐递增且变化值均大于安静值,根据Voltarelli(2002)的理论,符合高强度间歇游泳运动的模型标准,模型建立成功。训练期间第1 周出现第8~10 轮次训练时部分大鼠不能坚持的情况(累计13 鼠·轮次),作减重至3%处理后完成训练,之后训练过程中所有大鼠均能坚持做完负重5%体重的间歇训练,建模达到预期效果。
2.2 miRNA 高通测序数据预处理与分析
经高通量测序,CK 组大鼠获得15 499 132 条测序原始数据(raw reads),HIST 组获得15 803 934 条raw reads。经过滤处理后,各自分别得到13 864 049(CK 组)和14 460 159(HIST 组)条过滤后得到的Reads 数据(clean reads)(表1)。其中,CK 组有8 901 163(64.2%)条reads 被定位(mapped)到大鼠基因组上,HIST 组有8 904 502(61.58%)条reads 被定位到大鼠基因组上。

表1 sRNA 高通测序数据的概括统计Table 1 Summary Statistics of Small RNA Deep Sequencing
对过滤处理后的clean reads 进行长度分布分析,发现90%以上reads 长度集中在20~24 nt 之间,其中长度为22 nt 的read 最多,约占到了总clean reads 的一半(图1)。由此可见,测序得到的sRNA 序列的长度分布趋势与动物中成熟miRNA 的长度分布是一致的。
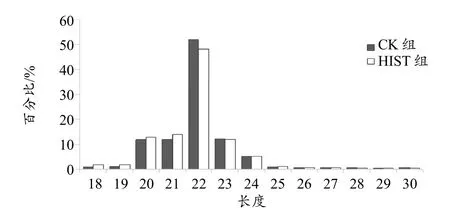
图1 不同长度的cleans reads 分布图Figure 1.The Distribution of Cleans Reads with Different Length

图2 两组大鼠组间共有及特有sRNA 的种类、数量韦恩图Figure 2.Wayne Diagram of Common and Specific Reads of Uniq_sRNA and Total_sRNA between Groups
两组大鼠中共有和特有的sRNA 种类(uniq_sRNA)和数量(total_sRNA)(图2)。两组共有的uniq_sRNA 是15.48%,共有的total_sRNA 是97.02%,这说明,二者共有的sRNA 表达量很高。
在clean reads(sRNA)中,通过数据库搜索比对,去除非miRNA 的序列(如mRNA,rRNA,tRNA,snRNA,snoRNA,srpRNA,scRNA,repeat-associated elements 等)后,CK 组与HIST 组分别得到了13 135 777 条和13 429 514条未被注释的序列(表2)。
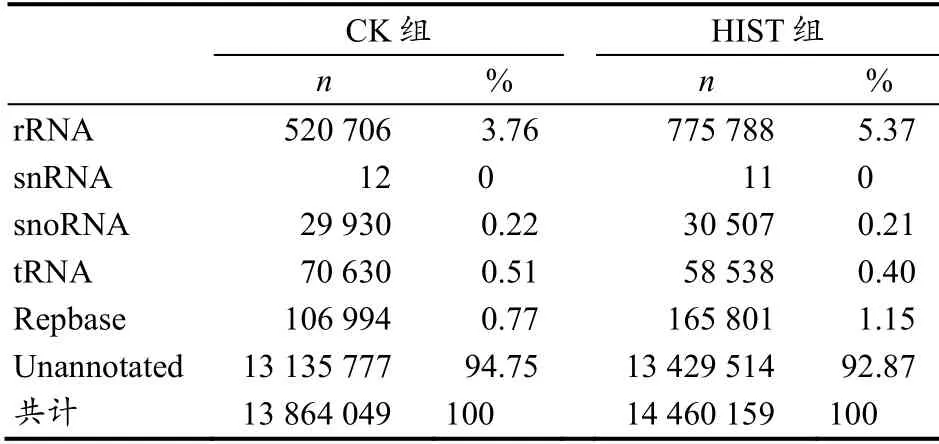
表2 两组大鼠文库中各种sRNA 的分布Table 2 Classification/Annotation of Small RNAs in Two Groups' Libraries
2.3 大鼠心脏已知miRNA 识别与新miRNA 预测
所有样品共鉴定出868 个miRNA,其中,已知miRNA 531 个,新预测miRNA337 个(表3)。
2.3.1 已知miRNA 的识别
通过比对miRBase 数据,两组大鼠共找出531 个已知miRNA,CK 组找到495 个已知miRNA,HIST 组找到498个已知miRNA。其中,两组共有的已知miRNA 有462个,CK 组特有的为33 个,HIST 组特有的为36 个。两组中表达最多的10 个已知miRNA 信息如表4所示。

表3 两组大鼠miRNA 概括统计Table 3 Summary Statistics of miRNAs in Two Groups' Libraries/n
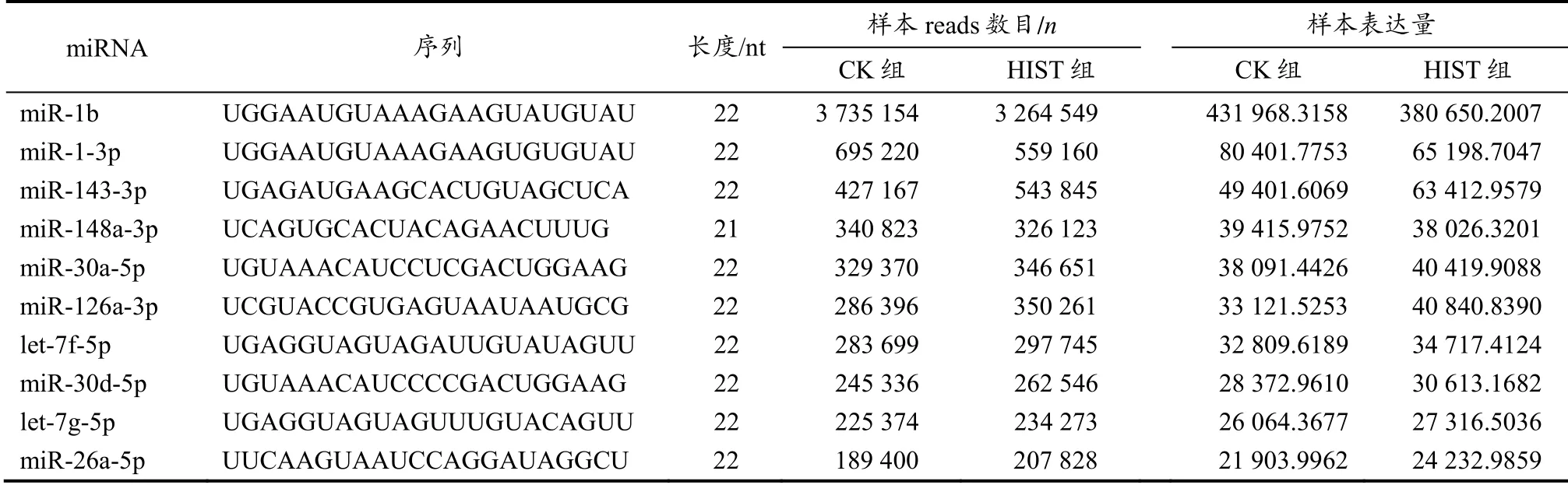
表4 两组大鼠表达最多的已知miRNATable 4 The Most Abundant Known miRNAs Obtained from Two Groups' Libraries
2.3.2 新miRNA 预测
采用miRNA 预测软件MIREAP,两组共预测出337 个新的miRNA,CK 组预测出288 个新miRNA,HIST 组预测出288 个新miRNA。其中,两组共有的新miRNA 有239个,CK 组特有的为49 个,HIST 组特有的为49 个。新miRNA 的首位碱基偏向于U,长度分布在18~25 nt,其中以22 nt 为主,这些特征均与目前大鼠中已知序列特征相符。根据目前miRNA 的命名规则并参考不同物种的习惯命名法,本研究对新预测的miRNA 进行了命名,分别被命名为rno-miR-n001 到rno-miR-n337。两组中表达最多的10个新miRNA 信息如表5所示。
2.4 miRNA 差异表达分析
通过差异表达分析发现,HIST 组与CK 组大鼠之间大多数miRNA 的表达无显著差异,但也发现32 个miRNA 存在显著的差异表达(图3、表6)。与CK 组大鼠相比,HIST 组显著上调表达的miRNA 共22 个,显著下调表达的miRNA 共10 个。这证实了高强度间歇游泳运动能诱导大鼠心肌中miRNA 发生显著的差异表达。其中,rno-miRn106 只在CK 组中表达,而在HIST 组中没有检测到其表达。有7 个miRNA 的表达FC 达到了4 倍以上(|log2(FC)|≥2),分别是miR-212-3p、miR-132-5p、rnomiR-n150、miR-212-5p、rno-miR-n117、miR-122-5p、rno-miR-n106。由此可见,高强度间歇游泳运动确实能够诱导心脏中miRNA 的差异表达。
2.5 差异表达miRNA 靶基因预测及其功能分析
2.5.1 靶基因预测
在所有32 个响应高强度间歇运动的差异表达miRNA中,有25 个miRNA 共预测出1 197 个靶基因,平均每个miRNA 有47.88 个靶基因;其他的7 个差异表达miRNA 未能预测到对应的靶基因。除miR-124-3p、miR-200a-5p 仅预测到1 个靶基因外,其余miRNA 均能同时预测到多个靶基因,且存在不同miRNA 靶向同一编码基因的情况,例如,miR-503-3p 和miR-6315 都能调控Tet3,miR-132-5p和miR-503-3p 都能调控Pyroxd2。由此可见,差异表达miRNA 可能参与了众多基因的表达调控。
2.5.2 靶基因功能注释
通过对miRNA 靶基因进行功能注释,发现靶基因及其编码蛋白参与心脏多种生理功能的调控。这些靶基因包括涉及心肌细胞增殖、分化(如Tenm4、Rxrb、Rbp4、Prickle1、Foxs1),心肌凋亡(如Ltk),心肌发育和形态发生(如Epo、Foxs1、Actl10、Epor、Gja1、Srf、Camk2a),心肌收缩(如Srf、Camk2a),心肌肥厚调节(如Akap13),心脏传导(如Gja1),转录调控(如Rxrb、Rbp4、Prickle1、Epo、Foxs1、Srf)(表7)。
为了进一步分析差异表达miRNA 靶基因功能,本研究对这些靶基因进行了GO 分析与KEGG 分析。组间差异表达miRNA 靶基因GO 注释结果表明,差异表达的miRNA所对应的靶基因主要涉及的生物学过程包括细胞的生长、代谢、应激、调节、免疫、细胞生理等、细胞组分包括细胞膜、细胞器和细胞外基质等;生物分子功能包括催化活性、转运活性、酶调节活性及结合活性等(图4)。
组间差异表达miRNA 靶基因的KEGG 注释结果如图5所示,发现其参与肾素-血管紧张素系统、MAPK 通路、Hippo 通路、PI3K-Akt 信号通路、PPAR 信号通路、AMPK信号通路、胰岛素信号传导通路、p53 信号通路、病毒性心肌炎炎症通路、cGMP-PKG 信号通路、mRNA 监控通路等多条信号转导通路。
KEGG 通路的富集分析结果如图6所示,研究发现,这些靶基因在病毒性心肌炎炎症通路、cGMP-PKG 通路的富集水平明显高于其他通路,这说明,参与病毒性心肌炎炎症通路与cGMP-PKG 通路的靶基因最多。

图4 靶基因GO 注释图Figure 4.GO Annotation of Target Genes
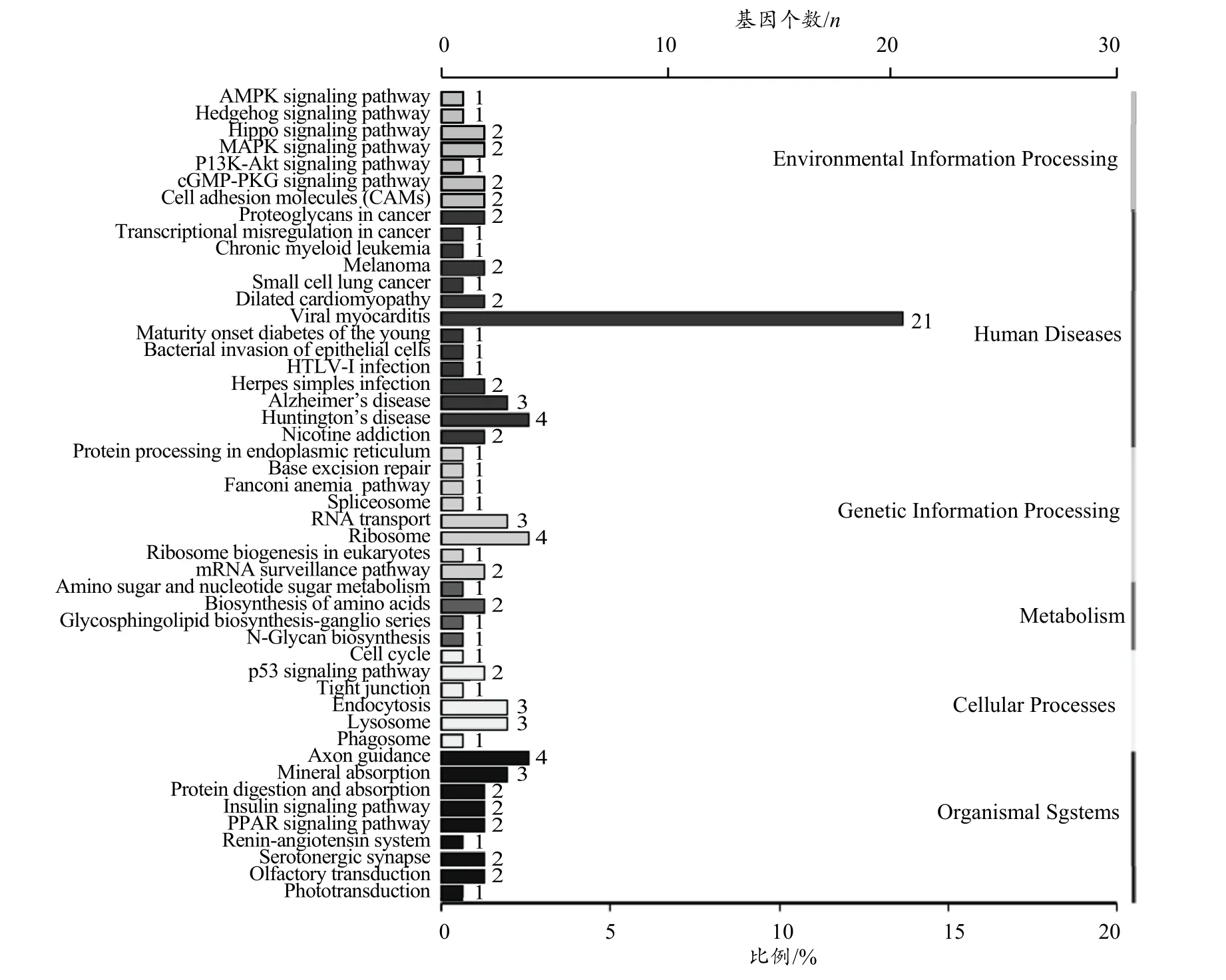
图5 靶基因KEGG 分类图Figure 5.KEGG Classification Diagram of Target Genes

图6 靶基因KEGG 通路富集散点图Figure 6.KEGG Enrichment Scatter Plot of Target Genes
3 讨论
间歇训练法起源于20世纪初,并由德国生理学家Hans Reindell 和教练员Woldemar Gerschler 于20世纪40年代正式提出,因其具有显著增强心泵功能的作用,长期广泛应用于运动训练领域(邓树勋,1990;黎涌明,2015;刘瑞东 等,2017)。关于间歇训练增强心泵功能的机制研究,国内外学者主要集中于抑制心肌凋亡、促进心肌代谢、增强心肌肌原纤维收缩等方面,研究方法主要有心功能评定、代谢组学、蛋白质检测及其基因表达分析等(董蕾,2012;李丽 等,2017;田振军 等,2015)。miRNA 是一种可以调控基因表达的小分子非编码核糖核酸,从心肌miRNA 的视角探究间歇训练对心脏基因表达的影响,具有重要的研究价值。
3.1 高强度间歇运动诱导心脏miRNA 产生的不同调控趋向
3.1.1 上调表达的心肌miRNA
本研究根据miRNA 整体表达情况以及两组间的变化特征,对差异表达miRNA 进行后续分析。在筛选出的22 个上调表达miRNA 中,多数已有相关研究报道,如韩志华(2014)发现,miR-27a 通过SMAD-Akt-mTOR 通路诱导缺血心肌自噬,抑制细胞凋亡,减轻心肌细胞损伤,保护细胞功能。Eskildsen 等(2015)发现,心脏肥大、心力衰竭会促使miR-132、miR-212 上调,miR-132 在房颤的发生中也出现上调的趋势(Qiao et al.,2017)。Wang 等(2016)发现,miR-134-5p 在急性心力衰竭早期显著增加。张在保(2013)发现,2 型糖尿病大鼠心肌梗死后缺血区miR-503 表达上调。Díaz 等(2017)发现,miR-125a-3p 在心肌缺血细胞中表达上调。有些筛出的miRNA 虽无相关报道证实其在心肌细胞中的调控作用,但在循环血液miRNA 的研究中发现了它们对心脏功能的作用,如Kinno 等(2014)发现循环miR-411、miR-409 在房颤的发生中表达上调;Harling 等(2017)发现在术后房颤患者血清中miR-483-5p 过度表达。这些研究印证了本研究的预测结果,也提示了这些差异表达miRNA 在响应间歇运动中的作用,既有可能使心脏发生缺血心肌自噬的保护机制,也存在心力衰竭、心肌缺血、心律失常(如房颤)等可能的变化过程。
3.1.2 下调表达的心肌miRNA
与CK 组大鼠相比,有10 个miRNA 在HIST 组表现出下调趋势,其中的多数miRNA 也已有相关研究报道,如Xu 等(2016)发现,miR-429 下调可引起Notch1 表达增加,进而达到保护心肌细胞免于缺氧诱导的细胞凋亡;Soci 等(2016)发现高强度游泳运动可使miR-208b 下调,诱导心肌生理性肥大。Liu 等(2016)、Dias 等(2016)发现,在心肌梗死引起的心力衰竭大鼠心脏中,miR-122-5p表达上调,提示miR-122-5p 有促心肌细胞凋亡的作用。Li等(2016)发现,miR-182 可通过Akt-mTOR-p70S6K 通路,抑制 Bcat2 表达,诱导心肌病理性肥大的发生;Cakmak 等(2015)发现,充血性心力衰竭与miR-182 的上调表达有关;Wang 等(2018)发现,衰老大鼠出现心脏舒张功能下降、心肌纤维化、自发性高血压等表现,这可能与miR-182、miR-208b-3p 的上调有关系。刘长召等(2017)发现,miR-200b-3p 可能通过调控FSTL1 的表达而参与心肌细胞的炎症反应、氧化应激和细胞凋亡等过程,诱导心肌梗死的出现。Yvan 等(2017)发现,循环miR-124-3p 的上调与心脏骤停的发生有关。前人的研究提示,这些miRNA 响应高强度间歇运动而出现的下调表达对于抑制心肌凋亡、抑制心力衰竭、抑制心肌纤维化、诱导心肌生理性肥大、维持心脏正常功能具有重要意义,在HIST 导致的心脏重塑中起到“良性”作用。
而其他下调表达的miRNA 被验证具有相反的作用,如Yao 等(2017)发现,miR-183-5p 上调表达可阻断内质网应激诱导的细胞凋亡和心力衰竭;Yang 等(2018)发现,miR-200a-5p 可通过靶向RNF11 阻断心肌细胞凋亡;Fang等(2015)发现,肥厚型心肌病患者(HCM)的弥漫性心肌纤维化的发生伴随循环miR-96-5p 的下调表达。上述研究提示,这些miRNA 在HIST 组心肌中的下调表达增加了心肌凋亡、心肌纤维化、心力衰竭的可能性,在HIST 导致的心脏重塑中起着“风险”作用。
综上,这些下调表达的miRNAs 也在心脏响应间歇运动中发挥不同的作用,既有诱导心肌生理性肥大、抑制心肌凋亡、保护心肌细胞的作用,又有诱发心力衰竭、心肌纤维化和心肌凋亡的风险。
根据上调、下调miRNA 及其前人研究证据,可以推测在高强度间歇运动导致心脏重塑的过程中,miRNA 对基因表达的调控可表现出多向性,既可能向心脏生理性肥大、保护心肌等良性方向发展,也可能演变为心力衰竭、心肌缺血、心肌纤维化、心肌凋亡、心律失常等恶性的病理过程(表8),而不同miRNA 的表达会影响其向不同的方向发展,心肌重塑的最终发展方向,受多种miRNA 共同作用的影响。这种众多miRNA 共同调控基因表达的机制,有待于进一步研究。而miR-6315、miR-6324、miR-664-2-5p、miR-191a-3p 等是否与运动心脏重塑或病理性心脏重塑有关尚未见报道,后续可进一步进行这部分研究。
3.2 miRNA 通过对靶基因调控实现对心脏生理活动的影响
miRNA 通过调控靶基因发挥作用,因此,本研究对差异表达的miRNA 进行了靶基因注释,并与以前报道的参与运动响应的基因进行比较,发现,间歇游泳运动响应的miRNA 可通过调控不同的靶基因介入心肌细胞多种生理生化过程,包括涉及心肌细胞增殖与分化、心肌收缩、心肌发育与形态发生、心肌凋亡、心脏传导和心肌细胞膜电位变化等。更重要的是,还有一些靶基因可以调控转录过程,如Rxrb、Rbp4、Prickle1、Epo、Foxs1、Srf。值得一提的是,目前虽鲜有关于miR-6315、miR-6324 以及新预测 rno-miR-n106、rno-miR-n019、rno-miR-n096、rnomiR-n096 调控心脏功能的相关文献,但其靶基因Epo、Epor、Akap13、Gja1、Ltk、Srf、Camk2a 等对心肌功能的影响已得到实验验证。如王小雯(2009)发现,Epo 及其受体Epor 对急性心肌梗死大鼠心肌具有保护作用;Johnson 等(2015)发现,Akap13 通过Akap13-PKD1 信号途径调控心肌收缩、细胞凋亡和代谢通路的转录过程,进而诱导心肌代偿性肥大;初霞(2010)发现,Gja1 及其靶蛋白的下调可诱导心律失常的出现;Honda 等(1999)发现,心脏中Ltk 的激活可导致心脏肥大、心肌细胞变性;Shan 等(2010)发现,Srf 参与了miR-1、miR-206 在糖尿病型心脏病心肌中上调表达,引起心肌凋亡的过程;Guilbert 等(2015)发现,Camk2a 及其编码蛋白参与了心肌舒张的调控过程。与以往报道的参与运动响应的miRNA 一致的是,响应间歇运动的心脏miRNA 靶基因也主要涉及心肌生长、增殖、凋亡、收缩等生理过程,但本研究发现,有些靶基因还与心脏传导、膜电位变化以及转录的调控有关,另外,差异表达miRNA 与其靶基因之间还存在着“一对多”“多对一”的不同的调控关系,这些都说明,miRNA 影响心脏功能的基因表达调控机制可能非常复杂。不同miRNA交叉调控不同基因表达的机制,是miRNA 研究的一个重要方向。

表8 心脏miRNA 响应高强度间歇游泳运动的作用类型Table 8 Types of Cardiac miRNAs Response to HIST
3.3 心脏响应高强度间歇运动的调控通路分析
通过对差异表达miRNA 的靶基因进行GO 分析发现,这些基因涉及细胞的生长、代谢、应激、调节、免疫、细胞生理、细胞膜、细胞器和细胞外基质、催化活性、转运活性、酶调节活性及结合活性等,几乎涉及心肌细胞结构与功能的各个方面。
心脏响应高强度间歇运动有赖于miRNA 的靶基因及其编码蛋白对多种代谢通路的激活或抑制,实现对心脏广泛功能的调控。通过对KEGG 的注释结果进行分类后发现,靶基因参与多条代谢通路,其中包括已有文献报道的与运动心脏重塑密切相关的肾素-血管紧张素系统、MAPK 通路、Hippo 通路、PI3K-Akt 信号通路、PPAR 信号通路、AMPK 信号通路、胰岛素信号传导通路、p53 信号通路、内质网通路、cGMP-PKG 信号通路以及病毒性心肌炎炎症通路等,这些通路分别涉及细胞凋亡、炎症反应、心肌纤维化、心脏血管再生、细胞增殖、心肌细胞肥大等生理过程(刘明 等,2012;马继政 等,2010;马智超,2013;徐同毅,2014;赵永才,2012;Gabriel et al.,2016;Ito et al.,2016;Li et al.,2016;Ma et al.,2015;Santos et al.,2016;Xu et al.,2016;Zhao et al.,2016)。其中,病毒性心肌炎炎症通路、cGMP-PKG 通路是本研究中发现的富集程度最高的两个通路。以上多数通路在心脏重塑方面的作用机制已被前人研究所揭示,为本研究解释HIST 引起心脏miRNA 差异表达的可能调控通路提供了重要参考(表9)。
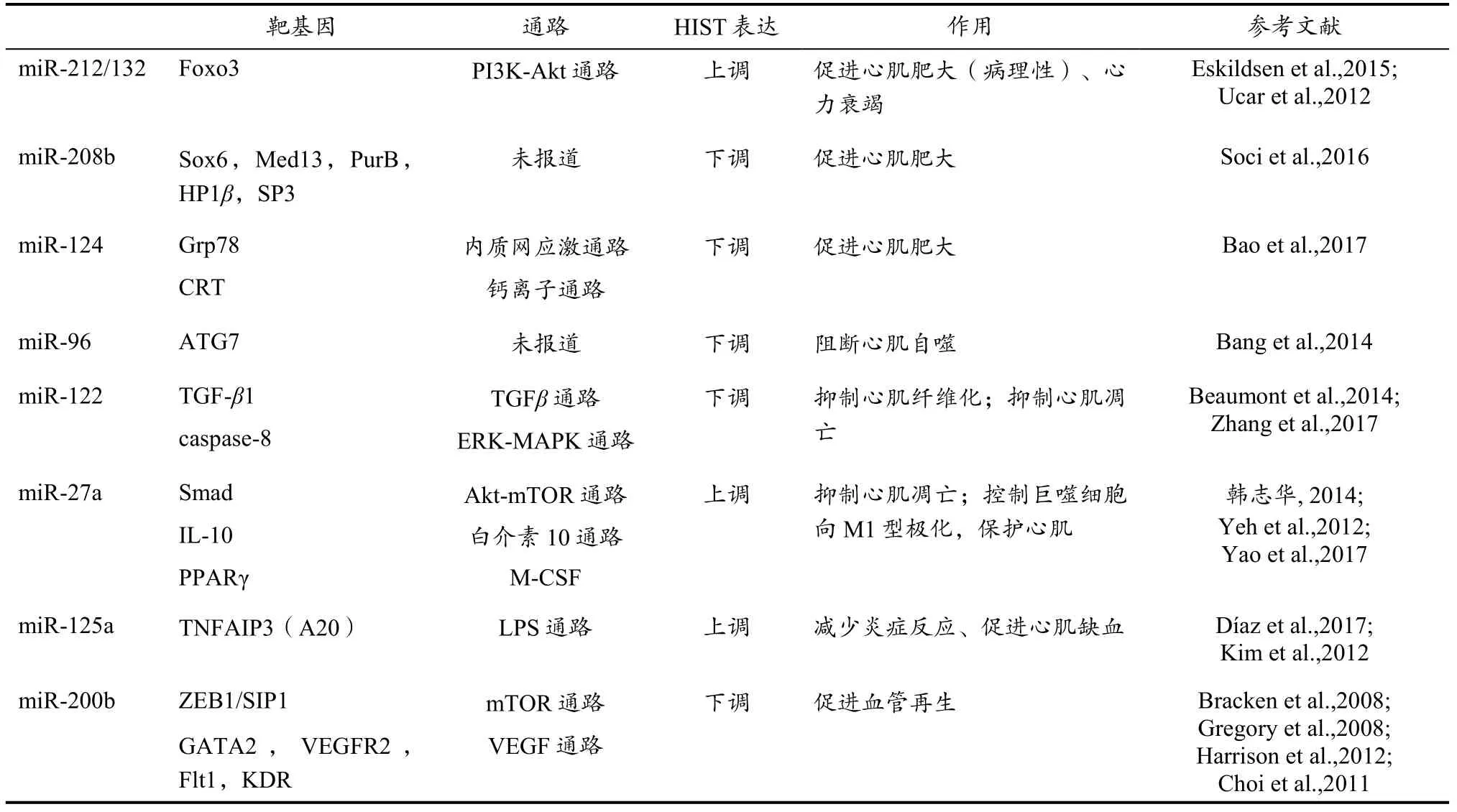
表9 心脏miRNA 响应高强度间歇游泳运动的变化Table 9 Changes of Cardiac miRNAs Response to HIST
该结果还提示了一些其他的代谢通路,如mRNA 监控通路等,虽然目前鲜有相关研究证实这些信号通路与运动心脏重塑有直接关联,但本研究提示,某些差异表达的miRNA 可能通过这些通路参与心脏miRNA 对间歇运动的遗传应答过程。将miRNA 及其靶基因差异表达情况与心肌生理功能变化结合起来,可以更好地揭示心脏响应高强度间歇运动的生理机制。
4 结论
高强度间歇运动导致大鼠心肌miRNA 出现显著性差异表达,影响心肌增殖、凋亡、收缩、心脏传导及转录等多种生理功能,从而实现对运动心脏重塑的调控作用;差异表达miRNA 与其靶基因之间存在着复杂的调控机制,并且这种调控作用既有良性的,也有致病性的;这些miRNA 通过靶基因及其编码蛋白参与PI3K-Akt 通路、mTOR 通路、MAPK 通路、VEGF 通路以及炎症反应相关通路等多种信号通路的调控,可作为心脏响应间歇运动的生物标志物,进一步鉴定、验证其功能,可以为间歇训练计划的优化和运动风险的监测提供重要参考,具有潜在的应用价值。

