枯草芽孢杆菌3 个不同亚种萌发差异初探
梁晶晶,刘宝同,武梦君,冯海霞,张大伟,3*
(1.青岛根源生物技术集团有限公司,山东青岛 266111;2. 青岛农业大学海洋科学与工程学院,山东青岛 266237;3.齐鲁工业大学生物工程学院,山东济南 250353)
枯草芽孢杆菌(Bacillus subtilis)作为一种益生菌,在动物肠道内通过代谢和增殖能够调节肠道菌群、改善机体消化能力、提高免疫力和抗病力。在水体中可通过生物同化作用提升水中氨氮、亚硝酸盐和硫化氢等有害物质的净化效率[1-3]。枯草芽孢杆菌作为一种微生态制剂,在生产、加工和运输过程中往往以孢子形式存在,在肠道和水体中必须由芽孢萌发为营养体,在繁殖代谢阶段才能发挥益生作用。而关于枯草芽孢杆菌在养殖水环境下的真实萌发情况鲜有报道。
枯草芽孢杆菌近缘种群包括枯草芽孢杆菌(B.subtilis)、地衣芽孢杆菌(B.licheniformis)、解淀粉芽孢杆菌(B. amyloliquefaciens)等10 余种[4]。枯草芽孢杆菌又分为多个亚种,包括枯草亚种(B.subtilis subsp.subtilis)、纳豆亚种(B.subtilis subsp.Natto)、斯 氏 亚 种(B.subtilis subsp.spizizenii) 和 沙 漠 亚 种(B.subtilis subsp.inaquosorum)等[4-5]。NCBI 数据库检索显示,截止2018 年发表的枯草芽孢杆菌亚种达到14 种。由于枯草芽孢杆菌各亚种间生理性能有一定差异,本文就纳豆亚种、枯草亚种和沙漠亚种3 个亚种的萌发情况进行初步探究,以期为芽孢杆菌在水质改良中的应用提供参考。
1 材料与方法
1.1 试验材料 枯草芽孢杆菌枯草亚种K91 喷雾干燥菌粉、纳豆亚种N66 喷雾干燥菌粉、沙漠亚种S03 喷雾干燥菌粉是将3 个亚种的发酵液以轻质碳酸钙为载体通过相同的喷雾干燥工艺分别获得常规菌粉制剂,均由青岛根源生物技术集团有限公司提供。
LB( Luria-Bertani)培养基:10 g 蛋白胨、5 g 酵母提取物、5 g NaCl,用1 mol/L NaOH 调节pH 至7.4,用去离子水定容至1 L,高压蒸汽121℃灭菌20 min。
营养琼脂培养基:北京陆桥技术股份有限公司,称取33 g 琼脂于1 L 去离子水中,高压蒸汽121℃灭菌20 min。
葡萄糖玉米粉培养基:15 g 葡萄糖、17 g 玉米粉,去离子水1 L,高压蒸汽121℃灭菌20 min。
草酸铵结晶紫染液:A 液为结晶紫2 g,95%乙醇20 mL;B 液为草酸铵0.8 g,蒸馏水80 mL;混合A、B 二液,静置48 h 后使用。
萌发剂:AGFK(A :L- 天冬酰胺100 mmol/L;G:葡萄糖10 mmol/L;F:果糖10 mmol/L;K:氯化钾50 mmol/L 和L- 丙氨酸10 mmol/L),均采用分析纯试剂,用量1%。
显微镜:尼康E100 及配套照相系统。
1.2 镜检法观察芽孢萌发情况 细菌细胞通常带负电荷,而碱性染料染色部分带正电荷,因此碱性染料很容易与细菌结合使细菌着色,经染色后细菌细胞与背景形成鲜明对比。芽孢杆菌在休眠芽孢状态时不带相应电荷无法染色,因此通过碱性染料染色后采用100 倍油镜观察可以很容易区分细菌的芽孢和营养体。本试验选择草酸铵结晶紫染色液进行染色。
1.3 浊度法测定芽孢萌发率 当光线通过微生物菌悬液时,由于菌体的散射及吸收作用使光线的透过量降低,在一定范围内,微生物细胞浓度与吸光值(OD 值)成正比,营养体对光线吸收强于芽孢,在芽孢未萌发时,OD 值较低,随着萌发成为营养体,OD 值逐渐升高。本试验选择波长为600 nm 的吸光值,萌发试验开始后,每间隔2 h 测定1 次OD 值,简称OD600。取12 个500 mL广口三角瓶,分别加入300 mL LB 培养基,121℃高压蒸汽灭菌20 min,冷却后将其分为4 组,每组3 个重复,A 组加入107CFU/mL N66,B 组加入108CFU/mL N66,C 组加入107CFU/mL S03,D 组加入108CFU/mL S03。将接种好的三角瓶置于32℃、100 r/min 的摇床上培养,取样测定0 、2 、4 、6 、8 h 的OD600并染色镜检观察芽孢萌发情况。
1.4 菌落计数法测定芽孢率 一般细菌的致死点为温度68℃与时间30 min 以下,75℃水浴保持20 min 可以杀死芽孢杆菌的营养体,但芽孢不受损失。分别在培养2、4、8 h 进行取样,将样品在75℃下进行水浴20 min,杀死营养体后测定剩余芽孢含量。取6 个500 mL 的广口三角瓶,分别加入300 mL LB 培养基(或葡萄糖玉米粉培养基),121℃高压蒸汽灭菌20 min,冷却后将其分为2 组,每组3 个重复,A 组加入108CFU/mLS03,B 组加入108CFU/mL K91,将接种好的三角瓶置于32℃、100 r/min 的摇床上培养,取样测定0 、2 、4 、6 、8 h 的芽孢剩余量。萌发率=(初始芽孢含量-萌发后芽孢含量)/初始芽孢含量×100%。
1.5 热激活和萌发剂试验 将添加完菌种的三角瓶放于70℃水浴中热激活30 min,处理后迅速置于32℃水浴中降温。再置于32℃、100 r/min 的摇床上培养并测定萌发率。在LB 培养基中添加1%的萌发剂,热激活后开展萌发率测定试验。
1.6 统计分析 试验数据均用平均值±标准差表示。利用SPSS 19.0 对试验数据进行单因素方差分析和Duncan's多重比较,以P<0.05 为差异显著水平判定依据。
2 结 果
2.1 不同亚种发酵液在LB 培养基中萌发情况 通过结晶紫染色-油镜(400×)观察发现(图1),枯草亚种K91 和纳豆亚种N66 在LB 液体培养基中萌发良好,在4 h 已经大量萌发但仍可见未萌发的芽孢,在8 h 可见大量长杆和短杆,完全未萌发的芽孢基本观察不到;而沙漠亚种S03 2 h 基本未萌发,4~8 h 萌发量增多,可见的杆菌很少。

图1 不同亚种发酵液在LB 培养基中萌发情况(400×)
如图2 所示,同种菌2 种接种量8 h 内的OD600随培养时间延长增长趋势一致,N66 和S03 吸光值增幅不同。N66 2 种接种量下8 h OD600均增加0.54(表1),沙漠亚种S03 在107CFU/mL、108CFU/mL 接种量时OD600分别增加0.38、0.33,接种量低的组萌发会多一些(P<0.05)(表1)。综上,菌种差异带来的萌发影响远远大于接种量对萌发的影响。
2.2 3 个枯草亚种萌发率比较 由图2 可知,32℃、LB培养基中,枯草亚种K91 和纳豆亚种N66 的萌发率前4 h 有显著性差异(P<0.05),6~8 h 趋于一致(P>0.05),但均显著高于沙漠亚种S03。K91 和N66 在培养2 h 时萌发率已达到60% 以上,8 h 萌发率可达80% 以上,S03 即使在培养8 h 时萌发率也不足30%(图2)。

图2 枯草芽孢杆菌3 个亚种萌发率比较
2.3 热激活对沙漠亚种S03 萌发和增殖的影响 如图3所示,采用热激活手段对沙漠亚种S03 进行处理后,芽孢萌发率整体提升不明显,8 h 萌发率低于16%。但是与不进行热激活相比,热激活对增殖有促进作用(P<0.05),热激活组与不进行热激活组8 h 后菌量分别增殖4 倍和3.6 倍,分别达到5.3×108CFU/mL 和3.9×108CFU/mL。2.4 萌发剂对沙漠亚种S03 萌发率的影响 如图4 所示,在LB 培养基中添加以L-天冬酰胺和L-丙氨酸为主的萌发剂对沙漠亚种S03 的芽孢萌发有显著的促进作用(P<0.05),2 h 芽孢萌发率由原来的低于30%提高到83.9%;8 h 萌发率为92.5%,同时总菌量增殖3 倍,而在未加萌发剂时增殖只有1.9 倍。

图3 热激活对沙漠亚种S03 萌发率的影响
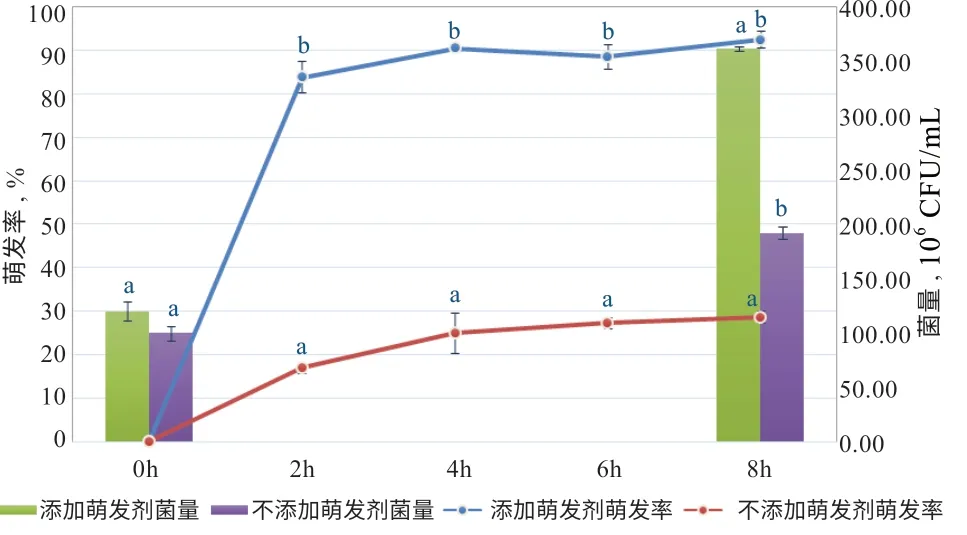
图 4 LB 培养基中添加萌发剂后沙漠亚种S03萌发率和菌量变化
在葡萄糖玉米粉培养基中添加相同的萌发剂沙漠亚种S03 的萌发率也显著提升(P<0.05),8 h 萌发率90.1%,与在LB 培养基中的提升作用无显著性差异(P>0.05)。但菌的增殖情况显著低于LB 培养基中(P<0.05),添加萌发剂前后总菌量均降低(图5)。
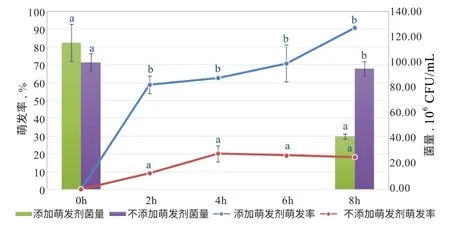
图5 葡萄糖玉米粉培养基添加萌发剂后沙漠亚种S03萌发率和菌量的变化

表1 纳豆亚种N66 和沙漠亚种S03 萌发过程中的OD 600 变化
3 讨 论
在LB 培养基、肉汤培养基(NB)等常用的细菌培养基中枯草芽孢杆菌生长良好,温度和溶氧适宜时,短时间内萌发效率高、整体生长周期短[6]。而枯草芽孢杆菌制剂在水产养殖池塘中使用时,因池水温度较低、营养贫瘠,其生长周期延长,为了缩短芽孢在水体中的萌发时间,在泼洒前部分使用者会进行提前活化,为了便于操作及出于成本考虑,活化常采用1%~5%红糖、葡萄糖、豆粕、玉米粉等作为培养基,将1 kg 含活菌200×108CFU/g 的产品加入10~100 kg 水中,水温20~30℃,气石曝气2~4 h。在这种接种密度大(大于2×108CFU/mL)、营养不足(培养基是正常用量的10%~20%)、温度偏低的条件下,芽孢菌萌发或繁殖存在一定困难。
芽孢萌发可以通过镜检定性观察杆菌与芽孢的大体比例,要准确确定萌发率则需要通过水浴杀死营养体后进行平板培养计数,后者工作量较大、耗时较长。
本试验结果表明,即使在营养条件适中的LB 培养基中,枯草芽孢杆菌3 个亚种萌发水平不一,枯草亚种K19 和纳豆亚种N66 在试验条件下非常容易萌发,而沙漠亚种S03 萌发率较低,8 h 萌发率只有28.7%。沙漠亚种在应用中有独特的作用,如产生抗菌物质[7]、絮凝作用(本实验室前期研究,尚未发表)等,因此寻找提高其萌发率的方法对其生产应用有借鉴意义。
关于芽孢萌发的过程,有研究表明当营养物质接触到芽孢时,会渗透穿过芽孢衣和皮层,与孢子内膜的受体蛋白结合,触发芽孢的萌发,芽孢内部迅速发生一系列变化:H+和Zn2+释放,芽孢核内部pH 上升,继而Ca2+-DPA 大量释放,被水所替代,芽孢的耐热性下降;芽孢皮层的肽聚糖层水解,芽孢核内部蛋白质流动性增强,酶活性加强,开始合成ATP;SASP 蛋白降解,芽孢DNA 释放,进而引导RNA、蛋白质、DNA 的合成[8]。成孢温度、萌发剂、热激活和萌发缓冲液等因素对芽孢的萌发都有一定影响[8-10]。本试验针对萌发率低的沙漠亚种S03 结合萌发机制,分别在试验室通用LB 培养基和水产养殖现场用培养基中增加了以L-天冬酰胺和L-丙氨酸为主要成分的萌发剂,结果表明,在2 种培养基中添加萌发剂后沙漠亚种S03 芽孢萌发率都显著提高,活化8 h 后在LB 培养基中总菌量可增殖3 倍,而在葡萄糖玉米粉培养基中总菌量下降,推测后者营养不足,芽孢萌发后接触不到足够营养而造成死亡。
综上,菌种是影响萌发难易程度的关键因素,剂型和接种量不是关键因素,以L-天冬酰胺和L-丙氨酸为主的萌发剂可显著提高沙漠亚种的萌发效率。萌发后需给芽孢提供足够的营养才能达到有效繁殖的目的,否则会使总菌量降低。
4 结 论
本试验中,枯草芽孢杆菌枯草亚种K91 和纳豆亚种N66 的萌发情况显著好于沙漠亚种S03,107~108CFU/mL接种量对萌发的影响不显著;仅热激活处理对萌发率影响不显著,添加萌发剂可使沙漠亚种S03 的萌发率有显著提高,可达到枯草芽孢杆菌枯草亚种和纳豆亚种的萌发水平。
——和田盘羊

