交叉引物恒温扩增技术检测创伤弧菌的应用研究
张 晶,吴新伟,陈惠玲,陈佳璇,狄 飚,白志军
创伤弧菌(Vibriovulnificus)隶属弧菌科弧菌属,广泛分布于亚热带河口、海洋及海产品中,是一种重要的海洋病原体[1-2]。相比霍乱弧菌、副溶血性弧菌,创伤弧菌容易在有潜在慢性疾病或免疫力低下的易感人群中造成严重的致命的感染[3]。在美国,澳大利亚,加拿大,西班牙,日本,韩国,中国台湾和我国浙江有许多该病原体引起的的死亡病例[3-6]。防控创伤弧菌危害发生的关键是快速检测和早期及时诊断。近几年发展起来的交叉引物恒温扩增(cross priming amplification,CPA) 技术是一种新兴核酸等温扩增技术[7],具有恒温、快速等特点,应用前景广泛。本研究拟针对创伤弧菌特异性溶血素A基因(Vibrio vulnificus specific hemolysin gene A,vvhA)设计特异性引物和探针,利用CPA结合胶体金免疫层析技术和全封闭式核酸检验装置,建立一种快速准确的检测创伤弧菌的新方法。
1 材料与方法
1.1菌株来源 试验用创伤弧菌菌株为本实验室自海产品中分离保存。其他菌株:溶藻弧菌、河弧菌、霍乱弧菌、蜡样芽胞杆菌、金黄色葡萄球菌、肠球菌核酸、铜绿假单胞菌和胎儿弯曲杆菌菌株均由本实验室保存。创伤弧菌vvhA基因携带情况均经荧光PCR法验证。
1.2仪器与试剂 恒温金属浴(杭州博日科技有限公司),荧光定量PCR仪(美国ABI)。Bst DNA polymerase(美国NEB),DNA核酸提取试剂盒(德国Qiagen),含有核酸试纸条的全封闭式核酸检测装置(杭州尤思达生物技术有限公司),创伤弧菌荧光PCR试剂盒(深圳生科原生物科技有限公司)。引物和探针委托TaKaRa公司合成。
1.3 方 法
1.3.1引物和探针设计 通过序列比对vvhA基因(GenBank: KP224270.1)的保守区域,设计CPA引物和探针。包括1对外围引物VVF3和VVB3,1对交叉扩增引物VVDR1和VVCPF,以及1对检测探针VVDR5F(5′端标记荧光素FitC)和VVDF5B ( 5′端标记生物素Biotin),见表1。
表1 CPA引物和探针序列
Tab.1 CPA primers and the sequences of probes

引物和探针序列(5′-3′)VVF3CGGCAACGTCAGATGGTTVVB3CGGGTTTCACCCAAAGGTVVDR1AACCAGCTGTATCTTGCTGVVCPFATGAATACCCGTGCCAGGCTTTCCT-GACGCCAAAATTGTCCVVDR5FFITC- GTCGGCATCGACGGTGAAACVVDF5BBIOTIN- ATGAATACCCGTGCCAGGCT
1.3.2基因组DNA的制备 采用脑心浸液培养基于恒温培养摇床中37 ℃,150 r/min培养24 h。用基因组DNA提取试剂盒提取基因组DNA,-20 ℃保存备用。
1.3.3优化CPA反应体系 CPA反应体积20 μL,通过改变反应温度,调整引物探针浓度以及优化Bst DNA polymerase、Betaine、MgSO4、dNTPs剂量反应体系,最终利用分析试纸条的检测结果确定最佳CPA反应体系。
1.3.4灵敏度试验 用优化后的CPA反应体系进行扩增,检测10倍梯度稀释的阳性创伤弧菌菌液(原始浓度为1.28×108CFU/mL)。每个梯度重复3次,验证方法重复性。同时利用创伤弧菌荧光PCR试剂盒(敏感性103copies/mL)进行平行测试。
1.3.5特异性试验 用基因组DNA提取试剂盒提取作为阴性对照的铜绿假单胞菌、蜡样芽胞杆菌、肠球菌、溶藻弧菌、河弧菌、霍乱弧菌、李斯特菌、金黄色葡萄球菌、胎儿弯曲杆菌核酸和以及作为空白对照的脑心浸液培养基,在相同条件下用优化后的CPA反应体系对不同的基因组模板进行扩增,验证方法的特异性。
2 结 果
2.1CPA最佳反应体系的确立 经过反复优化,确立了CPA的最佳反应体系,包含Buffer(1×)、dNTP(0.4 mmol/L)、Betaine(1 mol/L)、MgSO4(4 mmol/L)、VVF3(0.1 μmol/L)、VVB3(0.1 μmol/L)、VVDR1 (0.8 μmol/L)、VVCPF(0.8 μmol/L)、VVDR5F (0.4 μmol/L)、VVDF5B(0.5 μmol/L)、Bst DNA Polymerase(0.1 U/μL)、模板DNA 4 μL,补ddH2O至总体积20 μL。CPA反应条件:60 ℃恒温扩增45 min。
2.2结果判定 CPA反应结束后,按照含核酸试纸条的全封闭式核酸检验装置的操作说明书进行操作[8-9]。室温静置15~30 min,结果为阳性时,装置中核酸免疫试纸条有两条线(质控线和检验线)呈红色;结果为阴性时只有质控线呈红色。
2.3灵敏度试验 对已定量的阳性创伤弧菌菌液(原始浓度为1.28×108CFU/mL)进行10倍梯度稀释至1.28×101CFU/mL,平行做CPA与荧光PCR检测灵敏度实验。每个梯度重复3次,结果显示CPA法对创伤弧菌菌液检测灵敏度为1.28×103CFU /mL(见图1)。创伤弧菌荧光PCR标准曲线图如图2,X轴是菌液浓度的对数值,Y轴是对应的Ct值,线性方程为Y=-3.571 X+42.173,相关系数为99.90%,扩增效率为90.57%。检测灵敏度为1.28×102CFU /mL,平行检测1.28×103CFU /mL对应的荧光信号曲线Ct值为30.5(见图3)。CPA法与荧光定量PCR方法相比,灵敏度低一个数量级,但是结果判定直观,操作简便,成本低廉,可用于创伤弧菌的检测。

注:1~8表示创伤弧菌菌液浓度为1.28×108 cfu/mL~1.28×101 cfu/mL;(+):阳性对照;(-):阴性对照;C为质控线;T为检测线。图1 CPA法检测创伤弧菌菌液灵敏度试验Fig.1 Sensitivity of the CPA assay
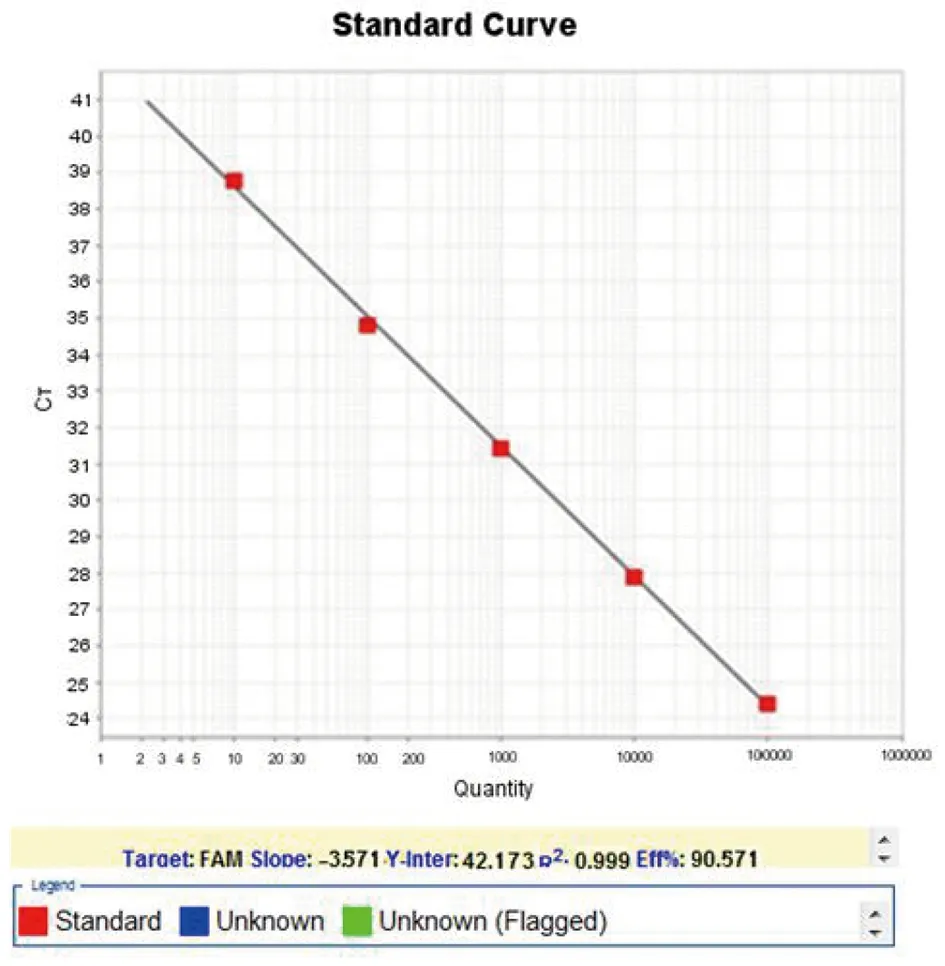
图2 创伤弧菌菌液标准曲线Fig.2 Standard Curve of V. vulnificus by real-time PCR

注:1~8表示创伤弧菌菌液浓度为1.28×108 cfu/mL~1.28×101 cfu/mL图3 荧光定量PCR检测创伤弧菌菌液灵敏度结果Fig.3 Sensitivity of the assay was identified using 10-fold serial dilutions of V. vulnificus by real-time PCR
2.4特异性试验 各取200 μL菌液进行DNA提取后,利用荧光PCR与CPA对51株创伤弧菌进行平行检测,根据实验室前期研究[10]的毒株分型创伤弧菌可分为有CB型、EA型、CAB型、CA型和EB型等亚型。针对以上亚型计算特异性和敏感性,5种亚型中除了CB亚型特异性和敏感性为95.65%和100%,其余亚型特异性和敏感性均为100%(P>0.05),数据显示两种检测方法无统计学差异,荧光PCR与CPA基本一致(见表2)。其余阴性对照铜绿假单胞菌、蜡样芽胞杆菌、肠球菌、溶藻弧菌、河弧菌、霍乱弧菌、李斯特菌、金黄色葡萄球菌、胎儿弯曲杆菌CPA检测均为阴性(见图4)。

注:1~9表示铜绿假单胞菌、蜡样芽胞杆菌、肠球菌、溶藻弧菌、河弧菌、霍乱弧菌、李斯特菌、金黄色葡萄球菌、胎儿弯曲杆菌;(+):阳性对照;(-):阴性对照; C为质控线;T为检测线。图4 CPA法特异性实验结果Fig.4 Specificity of the CPA assay
表2 CPA与荧光定量PCR比较结果
Tab.2 Results for compare CPA with Real-time PCR(P>0.05)
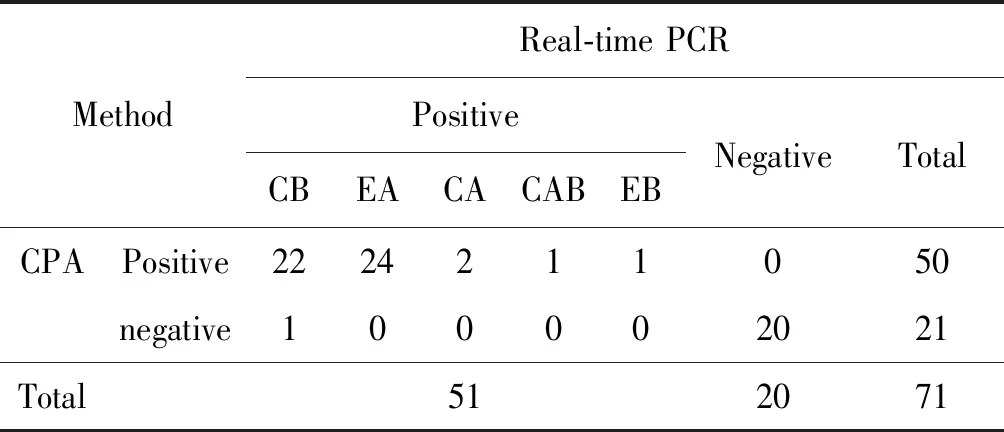
MethodReal-time PCRPositiveNegativeTotalCBEACACABEBCPAPositive2224211050negative100002021Total5120 71
3 讨 论
目前用于创伤弧菌检验的技术已由常规分离鉴定法[11],发展到脂肪酸气相色谱分析法[12]、胶体金免疫层析法[13],分子生物学法如常规PCR[14]、多重PCR[15]、荧光定量PCR[16]等、变性高效液相色谱技术[17]等。这些技术可以在遗传基因水平上检测创伤弧菌,并鉴定毒力株和非毒力株,有助于快速准确地诊断创伤弧菌感染及预防和控制创伤弧菌的爆发。但是这几种方法存在技术要求高、成本昂贵等缺点,很难在基层开展和实行。
本研究采用交叉引物恒温扩增技术靶向创伤弧菌vvhA基因,针对靶序列特异性区域设计了1对外围引物、1对交叉扩增引物、1对带有生物素和荧光素标记的探针以及具有链置换功能的Bst DNA聚合酶,有机地将病原体DNA扩增、核酸杂交、核酸试纸条检测和核酸检测封闭装置几种技术融为一体,建立了创伤弧菌CPA快速检测方法,40~60 min即可完成检测,并且通过直接观察核酸试纸条显色判断结果,简单、便捷,对实验人员和设备要求低,利于创伤弧菌的应急诊断、现场监测。同时由于全封闭式核酸检验装置,可以避免靶核酸释放到外界形成气溶胶污染。
利用本研究中的创伤弧菌CPA-核酸试纸条快速检测方法检测实验室留存的铜绿假单胞菌、蜡样芽胞杆菌、肠球菌、溶藻弧菌、河弧菌、霍乱弧菌、李斯特菌、金黄色葡萄球菌、胎儿弯曲杆菌核酸的结果与已知的菌株信息一致,仅创伤弧菌为阳性结果。针对本实验室前期的研究,创伤弧菌毒株分型可分为CB型、EA型、CAB型、CA型和EB型等亚型。利用CPA法对以上亚型计算特异性和敏感性,5种亚型中除了CB亚型特异性和敏感性为95.65%和100%,其余亚型特异性和敏感性均为100%,说明建立的CPA方法具有良好的特异性。该CPA方法检测灵敏度较高,检测纯培养的创伤弧菌灵敏度可达1.28×103cfu /ml。该CPA法检测灵敏度与荧光定量PCR方法相比仅低一个数量级,但是成本低廉、操作简便,有利于该技术的推广,对创伤弧菌疫情的预防和控制,食品安全的加强具有重要意义。
利益冲突:无

