陕西一养猪场4种细菌的流行状况及分型研究
柳江山,黎 娜,张金蕾,张 倩,杨 俊,彭子欣,李凤琴,葛武鹏,杨保伟
(1.西北农林科技大学 食品科学与工程学院,陕西 杨凌 712100;2.国家食品安全风险评估中心,北京 100022)
21世纪以来,细菌污染食品所导致的食源性疾病爆发已成为全球性公共卫生问题[1]。沙门氏菌、金黄色葡萄球菌、部分致病性大肠杆菌和肠球菌都是常见的人畜共患病病原菌,能够以食品为载体进入人体,严重威胁食品安全,给人类健康带来隐患。
随着我国经济的不断发展和人民生活水平的提高,人们对各种畜禽产品的需求量日益增加,这也直接促进了我国畜禽养殖业的发展。就养猪产业而言,各种大规模的养殖场不断建成,猪场规模越来越大,存栏数越来越多。流行于猪场的沙门氏菌等致病菌不仅会对养猪业造成很大的危害,而且也会对食品安全产生一定的影响[1, 2]。近年来,由于养猪场规模的扩张,猪场环境中的细菌分布发生了很大变化,空气、水、土壤、粪便等环境中的细菌种类变多,数量增大,部分致病性细菌已经扩散[3]。其中,由粪便污染引起的人畜共患病的传播与感染已经引起人们广泛关注。有研究表明,畜禽粪便中大约有150种人畜共患病致病源;畜禽养殖场的污水中,大约每毫升含有超过30万大肠杆菌和65万肠球菌[4]。生猪作为大肠杆菌、沙门氏菌、金黄色葡萄球菌和肠球菌的宿主,一方面可以通过人畜接触将这些细菌直接传递给人类;另一方面,这些细菌也可随动物排泄物、养殖污水、气溶胶等介质污染环境,进而通过食物链传播给社区人群。因此,笔者研究旨在对猪源大肠杆菌、沙门氏菌、金黄色葡萄球菌和肠球菌等病原菌进行调查研究,为猪场合理防治病原菌提供科学参考。
1 材料与方法
1.1 材料
1.1.1 样品 按照国家食品安全风险评估中心“动物源食物链中耐药性细菌污染和传递机制研究工作方案”规定,2015年12月和2016年4月,分别于生猪育肥前期(50~90日龄)和育肥后期(120~130日龄)从陕西省扶风县某猪场4个猪舍采集猪粪样品20份、猪鼻拭子20份、猪舍地面涂抹样品12份、猪舍墙壁涂抹样品12份、土壤样品4份、水体样品3份、养殖人员粪便样品4份等共150份样品。该猪场母猪存栏数为20头,猪舍30个,养殖在栏仔猪和育肥猪约300头。
1.1.2 培养基 缓冲蛋白胨水(Buffered Peptone Water, BPW)、四硫磺酸钠亮绿培养基基础(Tetrathionate Broth,TTB)及添加剂、EC肉汤、mEI培养基、Luria—Bertani(LB)营养琼脂、Rappaport—Vassiliadis(RV)肉汤、Mueller Hinton(MH)琼脂、麦康凯琼脂、脑心浸液琼脂和脑心浸液肉汤培养基均购自北京陆桥技术股份有限公司;XLT4培养基基础及添加剂购自美国BD公司。PCR用Taq DNA 聚合酶、dNTP、PCR buffer、MgCl2均购自宝生物工程(大连)有限公司。细菌检测和分型用引物由杨凌天润奥科生物科技有限公司合成。
1.2 方法
1.2.1 样品前处理 将拭擦获取墙壁和地面涂抹样品的海绵头装入无菌采样袋,向采样袋中加入10 mL无菌BPW,用拍击式均质器快速拍打30 s。猪鼻拭子样品从运送培养基中取出后,用无菌剪刀剪下拭子头,置于装有10 mL无菌BPW的试管中涡旋振荡30 s。取污水、人/猪粪便样品各25 mL(g)加入装有225 mL BPW的均质袋中,用拍击式均质器快速拍打1 min。土壤样品混匀后,称取25 g加入装有225 mL BPW的均质袋中用拍击式均质器快速拍打1 min。
1.2.2 细菌的分离、鉴定与分型 主要有:
(1)大肠杆菌的分离和鉴定。按照国家食品安全风险评估中心“动物源食物链中耐药性细菌污染和传递机制研究工作方案”中规定的方法进行。吸取1 mL 混匀的BPW样品悬液,加入装有9 mL EC肉汤的试管中,37 ℃增菌培养16~20 h后,观察EC肉汤管中的倒置玻璃管是否有气泡产生,有气泡产生者为阳性,继续后续实验。无气泡产生为阴性管,停止实验。
用接种环取阳性管中菌液1环,划线接种于麦康凯琼脂平板,37 ℃培养18~24 h;挑取3~5个大肠杆菌疑似菌落,于麦康凯琼脂培养基上再纯化1次,37 ℃培养18~24 h;挑取2次纯化后的疑似菌落接种在MHA平板上,37 ℃培养18~24 h。
用无菌接种环挑取MHA平板上的培养物制作模板,进行PCR鉴定。PCR鉴定中大肠杆菌ATCC25922用作阳性对照。PCR反应体系为:总体积25 μL,PreMix10 μL,正向引物(50 pM·mL-1)0.3 μL,反向引物(50 pM·mL-1)0.3 μL,ddH2O 12.4 μL,模板DNA 2 μL。大肠杆菌鉴定用引物如表1所示。
PCR反应条件:95 ℃ 预变性6 min;95 ℃ 0.5 min,55 ℃ 0.5 min,72 ℃ 0.5 min 30个循环;72 ℃ 7 min 。PCR产物电泳后,与标准菌株相比,若供试菌的扩增结果同在450 bp处出现目标条带则为阳性菌株。PCR阴性扩增结果重复3次,如仍均为阴性,判断结果为阴性。
(2)大肠杆菌分型。采用多重PCR检测肠出血性大肠杆菌(EnterohemorrhagicEscherichiacoli; EHEC)、肠致病性大肠杆菌(EnteropathogenicEscherichiacoli; EPEC)、肠产毒性大肠杆菌(Enterotoxigenic Escherichia coli; ETEC)、肠侵袭性大肠杆菌(EnteroinvasiveEscherichiacoli; EIEC)和肠聚集性大肠杆菌(EnteroaggregativeEscherichiacoli; EAEC)在大肠杆菌分离株中的流行状况。
使用12种基因用于5类大肠杆菌的分型和检测,具体为:EPEC(escV、bfpB)、EHEC(stxlA、stx2A、escV )、ETEC(elt、estIa、estIb)、EIEC(invE)和EAEC(astA、aggR、pic)[5]。PCR反应体系、条件和阳性结果判定同(1)大肠杆菌PCR检测,扩增中退火温度随所用引物而定。
不同亚型大肠杆菌判定标准:bfpB和escV 2个基因同时扩增阳性可判定为典型EPEC,仅有escV基因为不典型EPEC;stx1、stx2或escV任一基因阳性即判定为EHEC;elt和/或estla基因阳性,estlb阳性可判定为ETEC,仅estlb阳性也可判定为ETEC;invE阳性即可判定为EIEC;pic、aggR、astA中任一基因阳性、两两组合或者全部阳性均可判定为EAEC。
1.2.3 肠球菌分离、鉴定和分型 主要有:
(1)肠球菌的分离和鉴定。吸取1 mL BPW样品悬液,加入装有9 mL肠球菌增菌肉汤的试管,37 ℃培养20~24 h进行选择性增菌。取1环肠球菌增菌液,划线接种于mEI平板,37 ℃培养40~48 h。每个平板挑取带有蓝黑色晕轮的疑似菌落3~5个,不足3个疑似菌落的平板,将疑似菌落全部挑取进行验证。疑似菌落在MHA培养基上划线纯化,37 ℃培养18~24 h后挑取MHA平板上的培养物制备模板,进行PCR鉴定。PCR反应体系和条件同1.2.1(1)大肠杆菌PCR检测,退火温度因引物序列而定。粪肠球菌ATCC29212用作肠球菌PCR鉴定的阳性对照菌株,与标准条带相比,若疑似菌的扩增产物在112 bp处出现目标条带则为阳性菌株。
(2)肠球菌分型。采用PCR对肠球菌分型(表2)[6]。PCR反应体系和条件同1.2.2(1)大肠杆菌PCR检测,退火温度如表2所示。
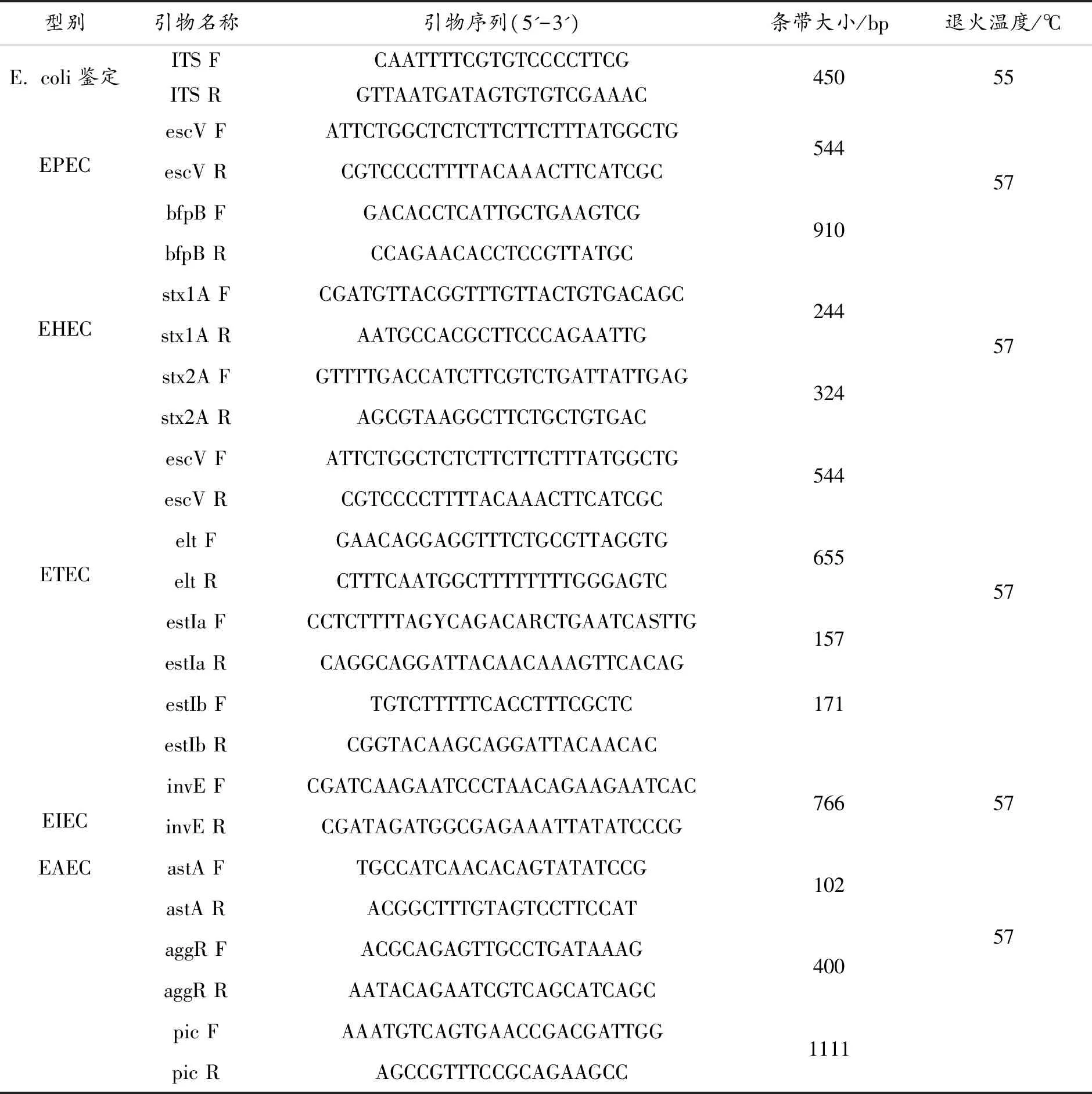
表1 大肠杆菌鉴定和分型用引物及相应扩增片段大小

表2 肠球菌鉴定和分型用引物及相应扩增片段大小
1.2.4 沙门氏菌分离、检测和分型 主要有:
(1)沙门氏菌分离和检测。分别吸取1 mL BPW样品悬液,加入装有9 mL RV和SC增菌液的离心管中,振荡均匀后RV肉汤于42 ℃培养18~24 h,SC肉汤于37 ℃培养18~24 h。分别取1环RV和SC增菌液,划线接种XLT4平板,37 ℃培养24~48 h,挑取疑似菌落。疑似菌落在XLT4培养基上再次纯化后,划线LB平板,37 ℃培养18~24 h。挑取LB平板培养物制作模板进行PCR鉴定。鉴定中Salmonella typhimurium LT2用作阳性对照,PCR反应体系和条件同1.2.2(1)大肠杆菌PCR检测。引物分别为invA-F:5’-GTGAAATTATCGCCACGTTCGGGCAA-3’和invA-R:5’-TCATCGCACCGTCAAAGGAACC-3’。
(2)沙门氏菌血清分型。采用玻片凝集法对沙门氏菌进行血清分型。使用泰国S&A公司生产的沙门氏菌诊断血清,按照沙门氏菌血清诊断操作步骤进行,查阅S&A公司沙门氏菌抗血清诊断附录和沙门氏菌检验国家标准(GB/T4789.4-2016),根据测定得到的抗原确定沙门氏菌的血清型。
1.2.5 金黄色葡萄球菌的分离、检测和分型 主要有:
(1)金黄色葡萄球菌的分离和检测。吸取1 mL BPW样品悬液,加入9 mL 7.5% NaCl肉汤,37 ℃培养16~20 h。取1环增菌液划线接种于Baird-Parker平板,37 ℃培养36~48 h。挑取Baird-Parker平板上的可疑菌落,划线于血平板上,37 ℃培养18~24 h,观察菌落是否产生溶血圈。如菌落周围可见完全透明溶血圈,则判定为阳性结果。同时进行PCR鉴定,鉴定时使用nuc1和nuc2作为引物、ATCC29213作为阳性对照。PCR反应体系和条件同1.2.2(1)大肠杆菌PCR检测条件。与阳性对照菌目标基因扩增条带相比,若疑似菌在694 bp处出现目标条带则为阳性菌株(表3)。
(2)金黄色葡萄球菌SPA和MRSA分型。采用PCR结合DNA序列测定对金黄色葡萄球菌进行SPA和MRSA分型。PCR所用引物如表3所示,PCR反应体系和条件如1.2.2(1)。

表3 金黄色葡萄球菌鉴定、SPA分型和MRSA分型用引物及相应扩增片段大小
1.2.6 数据处理 用Minitab进行数据处理, 通过χ2检验比较检出阳性率,P<0.05有统计学差异。
2 结果与分析
2.1 种细菌在猪育肥前期和后期的检出状况
在采集的150份样品中,4种细菌均有不同程度检出。其中,肠球菌阳性样品检出率最高(81.3%),其次分别为大肠杆菌(66.7%)、沙门氏菌(22.7 %)和金黄色葡萄球菌(6.67 %)阳性样品。
育肥前期采集的75份样品中,肠球菌阳性样品检出率为89.3%,显著(P<0.05)高于育肥后期样品中该菌阳性样品的检出率(73.3%)。育肥前期沙门氏菌阳性样品检出率(38.7%)显著(P<0.05)高于育肥后期(6.67%),育肥前期金黄色葡萄球菌检出率(12.0%)也显著(P<0.05)高于育肥后期(1.33%)。育肥前期大肠杆菌阳性样品的检出率(69.3 %)与育肥后期(64.0 %)无显著性差异。
总体来看,4种细菌在生猪育肥前期所采样品中的检出率均高于后期,除大肠杆菌外,其余3种细菌在猪育肥前、后期的检出率间均存在显著性差异。
2.2 种菌在不同类型样品中的检出状况
育肥前期采集的样品中,污水中大肠杆菌阳性样品的检出率为100 %,其它依次为猪鼻(90.0%)、猪粪(80.0%)、墙壁(66.6%)、地面(41.6%)、人粪和土壤(25.0%)。育肥后期大肠杆菌在污水中的检出率仍然最高(100%),其它分别为猪粪(90.0%)、地面(83.3%)、人粪(75.0%)、猪鼻(60.0%)和墙壁(16.6%),未在土壤中检出大肠杆菌。除污水外,大肠杆菌阳性样品在猪育肥前期和后期采集样品中的检出率均存在显著性(P<0.05)差异。
育肥前期,肠球菌阳性样品在地面、土壤和污水中的检出率均为100%,在其它样品中的检出状况分别为墙壁(91.6%)、猪粪(90.0%)、猪鼻(65.0%)和人粪(50.0%)。育肥后期,人粪和污水中检出率为100%,其它依次为猪粪(90.0%)、地面(83.3%)、墙壁(66.6%)和猪鼻(55.0%),土壤中检出率最低(25.0%)。除污水和猪粪以外,肠球菌在育肥前、后期采集的其它样品中的检出率间均存在显著性差异。
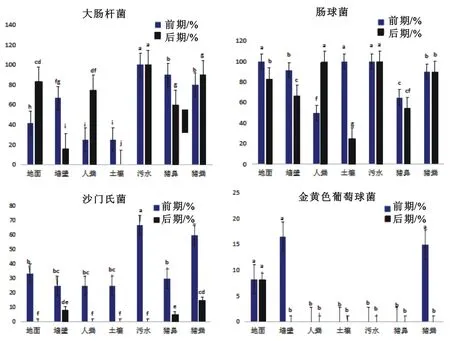
图1 4种细菌在生猪育肥前期和后期不同样品中的检出率
育肥前期沙门氏菌阳性样品在污水中的检出率最高(66.6 %),其次是猪粪(30.0%)、地面(33.3%)和猪鼻(30.0%),在墙壁、人粪和土壤样品中的检出率均为25.0%。育肥后期猪粪中沙门氏菌阳性样品检出率最高(15.0%),其次为墙壁(8.30%)和猪鼻(5.00%),未在其它样品中检出沙门氏菌。沙门氏菌阳性样品检出率在育肥前期和后期采集样品中均存在显著性(P<0.05)差异。
金黄色葡萄球菌阳性样品在育肥前期采集的墙壁涂抹样品中检出率最高(16.6%),其次分别为猪粪(15.0%)和地面样品(8.3%)。只在育肥后期采集的地面样品中检出金黄色葡萄球菌(8.3%)。
2.3 大肠杆菌、肠球菌、沙门氏菌和金黄色葡萄球菌分型
85株大肠杆菌中,43株大肠杆菌使用PCR和本研究所用引物未能分出型别,在可分型菌株中EAEC的检出率最高(40.0%),其次分别为ETEC(7.06%)、EPEC(1.17%)和EIEC(1.17%),未检出EHEC。
87株肠球菌可分为4个亚型,其中粪肠球菌50株(58.62%),屎肠球菌9株(9.2%),鸡肠球菌4株(4.6%),其它类型肠球菌24株(27.58%)。
血清分型结果表明33株沙门氏菌均为鼠伤寒沙门氏菌(Salmonella Typhimurium)。
7株金黄色葡萄球菌中,检出1株(14.3%)MRSA,该菌分离自猪粪,SPA型为T441。其余6株金黄色葡萄球菌中有2株T701型,T189型和T899型各1株,2株无法分型。
3 讨 论
研究表明,该猪场的环境、猪体和饲养员粪便样品中均有4种细菌检出,而且检出率较高。在生猪育肥前、后期采集的150份样品中,肠球菌阳性样品检出率为81.3%,大肠杆菌为66.7%,沙门氏菌为22.7 %。虽然金黄色葡萄球菌阳性样品检出率较低,但仍达6.67 %。
陈茹[7]研究表明,2014年10月至2015年4月,陕西省一规模化猪场中大肠埃希菌(100%)、葡萄球菌(9.3%)和沙门氏菌(2.33%)均有不同程度的流行。李楠等[8]于2010年从吉林省某猪场检出的大肠杆菌阳性样品率为17.4%,虽然检出率较低,但大肠杆菌仍是多种细菌阳性样品检出率中最高者。这些研究结果均与笔者研究类似,表明大肠杆菌在猪场中普遍存在,且检出率较其它菌株高。
4种细菌在猪育肥前、后期的检出率有所不同。对于该猪场来讲,育肥前期(冬季)检出率总体上大于育肥后期(春季),除大肠杆菌之外,其它3种细菌在育肥前期和后期的检出率间均存在显著性差异。根据我们的实地调研和饲养员分析,这可能是因为陕西地处关中地区,冬季天气寒冷,为了保温,猪舍窗户开启时间短,通风效果不好,舍内温度、湿度升高后营造出了适宜细菌生长繁殖的环境条件。而春季猪舍内通风良好,环境相对干燥,不适宜大多数细菌生长,因此育肥前期的检出率较高。
研究表明,该猪场猪源大肠杆菌以EAEC为主,这与浙江工业大学2014年对杭州地区猪场中大肠杆菌的分型结果[9]类似,其结果显示猪场中EAEC检出率最高(22.1%),其次为ETEC(1.47%),未检出EPEC。EAEC感染是发展中国家腹泻的重要病因之一。巴西的研究数据表明,EAEC感染是小儿腹泻最常见的病因,在<2岁的儿童中,EAEC与发病具有较高的相关性[10]。此外,EAEC还与旅行者腹泻相关。在美国,EAEC是继ETEC之后,导致成年旅行者腹泻的第2大病原菌,在去墨西哥旅游的美国成年人中,虽然大多数人无腹泻症状,但48%的人出现了抗集聚蛋白Dispersin抗体的升高[11]。墨西哥一项有关餐桌调味品的调查中发现,在44%的调味品中可检测到EAEC[12]。伊朗的研究[13]发现,140例腹泻儿童病例中,有15例(10.7%)由EAEC感染导致。EAEC所导致的腹泻在孟加拉国和中非也有很高的发病率[14, 15]。我国是猪肉生产大国,猪肉也是我国消费者最主要的食用肉品之一,在猪场中大量检出的致病性大肠杆菌非常有可能随着生猪屠宰、分割和销售等环节进入消费者的餐桌,导致食品安全事件发生。
此外,笔者研究结果表明所调查猪场中粪肠球菌占比最高(58.62%),屎肠球菌较少(9.62%),其它类型的肠球菌占比27.58%。其它类型肠球菌中主要包含了不常见的肠球菌亚型,即:鸟肠球菌、酪黄肠球菌、坚忍肠球菌、恶臭肠球菌、芒地肠球菌和希拉肠球菌等共6种。这与董鹏等[16]对河南省4个地区规模化猪场猪肛门拭子样品中粪肠球菌的研究结果(51.33%)比较类似。王送林[17]从湖南省部分猪场健康猪肠道内共分离到肠球菌115株,其中粪肠球菌11株,屎肠球菌59株,其他肠球菌45株,表明湖南省猪源肠球菌以粪肠球菌和屎肠球菌为主,只是屎肠球菌更为普遍,与笔者研究分型结果略有不同。与赵丽青等[18]报道的省青岛地区动物源粪肠球菌检出率(76.90%),幸文定[19]报道的江西省7个地区猪源粪肠球菌检出率(64.80%)相比,笔者研究中粪肠球菌检出率略低,这可能是由于笔者研究中所采集的样品除粪便外,还有环境样品等原因有关。
笔者研究中,分离到的沙门氏菌血清型均为鼠伤寒,血清型单一。中国动物卫生与流行病学中心李月华等[20]对2012-2017年分离自山东等6省份的89株猪源沙门氏菌进行了血清型鉴定,结果显示猪源菌株以鼠伤寒(58.43%)、肠炎(12.36%)、印第安纳(11.24%)和德尔卑(7.87%)为主。过效民[21]的研究结果则显示从河南省郑州、开封、焦作和许昌4个地市生猪屠宰场检出的沙门氏菌以德尔卑沙门氏菌和鼠伤寒沙门氏菌为主。在四川省猪调查的结果表明猪源沙门氏菌血清型以德尔卑为主(60.26%),其次是鼠伤寒(16.56%)和罗森(6.60%)[22]。在哈尔滨却以猪霍乱(71.40%)血清型为主,其次为猪伤寒(22.90%)和鼠伤寒(5.70%)[23]。与现有研究结果相比,可发现猪源沙门氏菌的主要血清型受地域影响较大,随地域不同而有所不同,但在各地猪源沙门氏菌中均有鼠伤寒沙门氏菌检出。
7株金黄色葡萄球菌中有1株MRSA检出。2013年,中国食品药品检定研究院研究发现,养殖生猪是MRSA的重要宿主[24]。该研究还显示,2013年河北省检出MRSA 28株(25.0%),湖北省检出16株(12.1%),陕西省检出12株(8.51%),四川省检出2株(1.60%)。这表明,在我国,猪场MRSA检出率并不高,且在地区间MRSA检出状况不同。结合笔者研究的数据可以看出,陕西省猪源MRSA分布与其他省份相比并不广泛。另外,虽然笔者研究中只分离到7株金黄色葡萄球菌,但却涵盖了4种SPA型,分别是T701型(2株)、T441型(1株)、T189型(1株)和T899型(1株),剩余2株暂未分出SPA型,表明陕西省猪源金黄色葡萄球菌SPA型的多样性较高。而中国食品药品检定研究院的研究显示,从4个省31个养猪场和2个猪屠宰场中获得的58株MRSA均属于同1个spa型(07-16-23-02-34,t899),与本研究结果有所不同。
综上,笔者研究所调查的猪场中4种细菌分布较为广泛,型别相对较多,且检出很多致病性型别的菌株。该4种细菌可能会给生猪养殖、猪肉产业链和猪肉安全健康发展带来潜在的安全隐患,所以,应结合研究结果对猪场加强管理,控制细菌的生长和污染,从源头上为猪肉食品安全把关。

