铝胁迫对豆瓣菜生理特性及营养元素吸收的影响
郑阳霞,赵善梅,向前,雷凤芸,李钦凤
(1.四川农业大学园艺学院,四川 成都 611130;2.雷波县教育和科技局,四川 雷波 616550)
我国酸性土壤占全国土壤面积的21%,主要分布在南方15个省区,铝毒害是酸性土壤中制约作物生产的重要障碍因子[1-2].酸性条件下,从土壤矿物上释放到土壤溶液中的铝含量增加、形态发生变化,随着pH值的降低,土壤中活性铝的含量和比例上升[1-2].蔬菜作物在铝胁迫下根系生长受到抑制,影响植株对土壤中矿质元素的吸收运输;同时,植株遭受铝毒害时,能通过多种途径不断产生活性氧(ROS),造成细胞膜损伤[3-5].许多蔬菜作物会富集环境中的铝,而在植株体内Al3+能通过竞争阳离子结合位点,阻塞离子通道等方式抑制矿质元素的吸收,导致植株缺素,影响其正常生长发育[4-5].设施蔬菜生产由于复种指数高、施肥量大等特点,易出现土壤退化,土壤酸化导致的活性铝含量升高[6].在农业生产中,水旱轮作为主要的土壤改良技术,淹水能有效改善土壤理化性质,使土壤pH趋于中性[6-7].豆瓣菜(NasturtiumofficinaleR.Br.),又名西洋菜、水田芥,属多年生十字花科(Brassicaceae)豆瓣菜属(Nasturtium)挺水草本植物,具有较高的营养价值和药用价值,在中国南方各地均能栽培[8].已有研究者在生产上对水生蔬菜-旱生蔬菜轮作模式改良土壤进行了探索[9-10],本试验旨在探索豆瓣菜对铝胁迫的生理响应机制,对利用豆瓣菜进行水旱轮作的可行性进行探讨,为土壤酸化改良和豆瓣菜的耐铝机理提供参考依据.
1 试验方法
1.1 供试材料
本试验所用豆瓣菜采自四川省雅安市.采集自然生长健壮的豆瓣菜幼苗,扦插繁殖两次驯化幼苗,选取第2次繁殖后长势一致的幼苗扦插进行铝处理盆栽控制性试验.试验试剂:十八水合硫酸铝(Al2(SO4)3·18H2O,分析纯)水溶液.
1.2 试验设计
供试土壤取自四川农业大学崇州实验基地,土壤基本理化性质为:有机质含量1.65 g/kg,全氮(N)1.15 g/kg,全磷(P)0.45 g/kg,全钾(K)23.78 g/kg.将土壤风干压碎、过5 mm筛后,称取2.5 kg装于15 cm×25 cm(高×直径)的塑料盆内,分别加入0、750、1 500、2 250、3 000 mg/L的Al2(SO4)3·18H2O水溶液1 L,与土壤充分混匀,使土壤中加入的Al3+质量浓度分别为0、300、600、900、1 200 mg/kg,保持淹水状态,自然放置平衡15 d后再次混匀备用.将所选长势一致(株高约5 cm,叶片5~7片)的幼苗分别扦插至盆中,每盆种植10株,每个处理重复3盆.在整个生长过程中不定期的交换盆与盆的位置以减弱边际效应的影响,并及时去除杂草.
1.3 测定项目及方法
种植后分别在第10、20、30天随机采集长势相近的叶片(每盆取10片叶,取样范围为从上至下第5~10片叶)测定生理生化指标,采样时间为上午10点前.丙二醛(MDA)含量用硫代巴比妥酸(TBA)法测定;脯氨酸(Pro)含量用酸性茚三酮比色法测定;超氧化物歧化酶(SOD)活性采用氮蓝四唑(NBT)光还原法;过氧化物酶(POD)采用分光光度法;过氧化氢酶(CAT)活性采用紫外分光光度法测定;抗坏血酸过氧化物酶(APX)采用紫外分光光度法[11-12].
处理后第30天,将豆瓣菜整株收获.用直尺测量根系长度;用TTC法测定根系活力[11];将豆瓣菜地上部与地下部分开充分洗净后,在105 ℃烘箱中杀青30 min后转入80 ℃下烘干至恒质量,分别称取干质量.
将烘干后的植株研磨过筛,贮于干燥器中待测.Al采用铝试剂比色法;全N采用凯氏定氮法测定;全P用H2SO4-H2O2消煮,采用火焰光度法测定;全Ca、Mg、K、Na、Fe、Mn、Zn、Cu先在250 ℃马弗炉灼烧1 h后在500 ℃下灼烧8 h,制成灰分,倒入稀盐酸溶解,用火焰原子吸收光谱法测定[13-14].矿质营养转运系数(TF)=地上部矿质营养含量/根部矿质营养含量.
1.4 数据处理
试验数据采用SPSS 20.0软件进行统计分析,采用Excel 2013软件作图.使用LSD(最小显著差异法)进行方差分析.
2 结果与分析
2.1 铝胁迫对豆瓣菜生长状况的影响
由表1可知,豆瓣菜各项生长指标在铝胁迫下整体呈先增大后减小的趋势,其中叶面积无显著差异.300 mg/kg铝处理下茎粗达到最大值,增幅为13.48%.根长在600 mg/kg铝处理下达到最大值,与对照差异显著,增幅达到48.56%.地上部干质量在300 mg/kg铝处理下达到最大,显著高于对照,增幅为60.78%;地下部干质量在600 mg/kg铝处理下达到最大,显著高于对照,增幅为80%.300 mg/kg铝处理下,根系活力达到最大值,增幅为24.33%,显著高于其他处理.
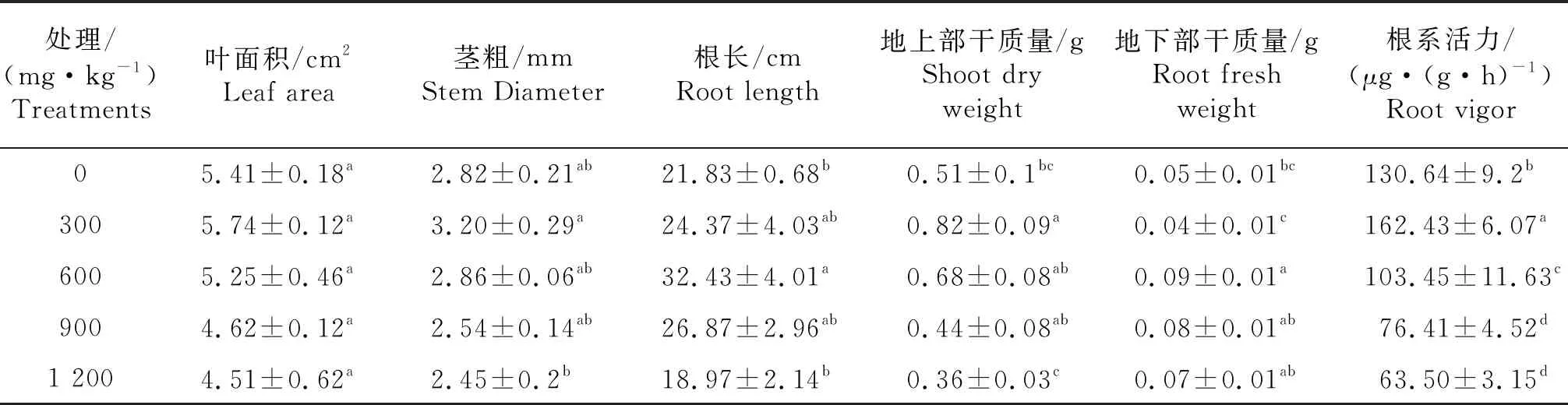
表1 铝胁迫对豆瓣菜生长状况的影响
同列数据肩标小写字母不同表示两者差异达显著水平(P<0.05).
The differences between the same column indicates with the difference small letters were significant(P<0.05).
2.2 铝胁迫对豆瓣菜叶片丙二醛含量的影响
由图1可知,仅在第30天,300 mg/kg铝处理下MDA含量与对照差异不显著,其余各处理下豆瓣菜叶片MDA含量均显著高于同时期对照组,增幅为19.29%~267.88%;随着铝处理质量浓度的升高,豆瓣菜叶片的MDA含量逐渐升高,在1 200 mg/kg铝处理下达到最大,显著高于其他各处理组;随着处理时间的延长,300 mg/kg和600 mg/kg铝处理下的豆瓣菜叶片MDA含量均呈现先增高后降低的趋势,此时铝胁迫对膜系统的伤害可能得到了一定程度的修复;900 mg/kg和1 200 mg/kg处理下的叶片MDA含量随时间延长呈现增长的趋势,均显著高于对照,与对照相比,增幅为78.09%~267.88%,说明高质量浓度铝胁迫破坏了植株体内的活性氧清除系统平衡[15-17].
2.3 铝胁迫对豆瓣菜叶片脯氨酸含量的影响
脯氨酸(Pro)是植物维持原生质稳态的重要分子,可以反映植物耐铝的能力[15].由图2可知,随着铝处理质量浓度的升高,豆瓣菜叶片的Pro含量呈现先升高后降低的趋势,其中,300 mg/kg和600 mg/kg铝处理下的Pro含量均显著高于对照,说明此时Pro的合成得到一定的促进;随着处理时间的延长,300 mg/kg处理下的Pro含量先略微降低后升高;600 mg/kg铝处理下的Pro含量持续升高;Al3+>600 mg/kg处理下,豆瓣菜叶片的Pro含量随时间延长呈下降趋势.Pro的积累可能对豆瓣菜铝胁迫有一定的缓解作用,铝处理质量浓度高于900 mg/kg时,可能豆瓣菜叶片的Pro合成能力即受到限制,而用于缓解铝毒害的消耗过大,造成Pro含量降低.

图1 铝胁迫对叶片丙二醛含量的影响Figure 1 Effect of aluminum stress on MDA content in leaves of watercress
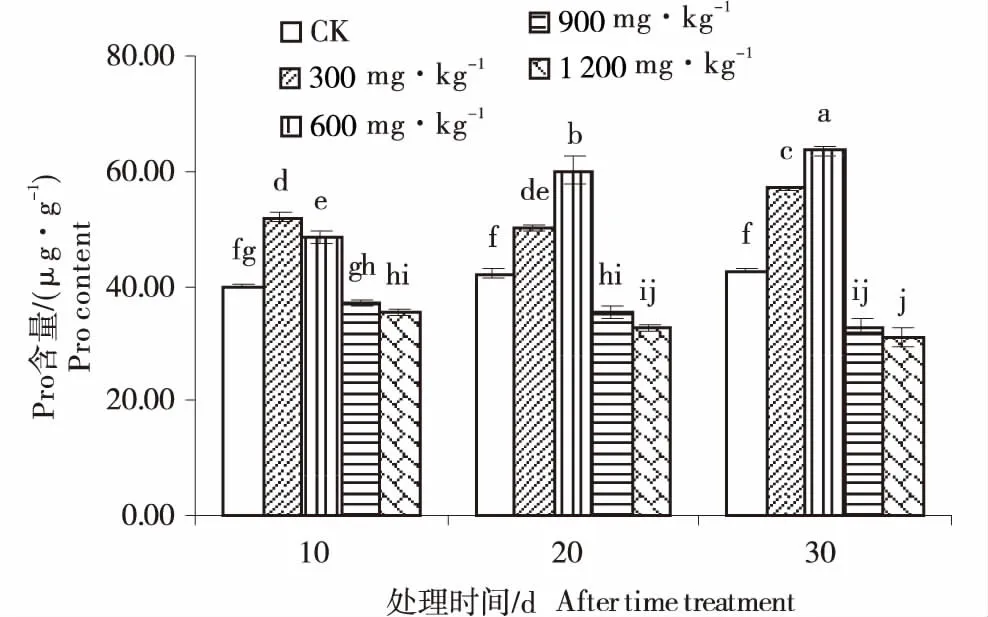
图2 铝胁迫对豆瓣菜叶片脯氨酸含量的影响Figure 2 Effect of aluminum stress on Pro content in leaves of watercress
2.4 铝胁迫对豆瓣菜叶片抗氧化酶活性的影响
铝胁迫会引发氧化胁迫,在铝胁迫下,植物细胞内活性氧物质会增多.SOD、POD、CAT、APX等是植物细胞抵御活性氧伤害的重要保护酶系统,能有效清除活性氧.由图3可知,豆瓣菜叶片SOD的活性整体上呈现先升高后降低的变化趋势.随着时间的延长,300 mg/kg铝处理下的SOD活性呈现增长趋势,且显著高于对照;当Al3+≥600 mg/kg时,SOD活性随处理时间延长呈现先增高后降低的趋势;600 mg/kg处理下与对照差异不显著,≥900 mg/kg的铝处理下SOD活性在第30天均显著低于对照,降幅分别为11.07%和13.16%.
由图4可知,在处理后第10天,POD活性随铝质量浓度升高逐渐升高,增幅为8.02%~29.26%;在处理20 d后,POD活性呈先升高后降低的趋势.随着铝处理质量浓度的升高,当Al3+≥900 mg/kg时,POD活性急剧下降,在第30天降幅最大,分别为对照的10.8%和30.21%;300 mg/kg和600 mg/kg处理下的POD活性随处理时长呈现出了不同的变化趋势,前者先增高后降低,后者持续增高,均显著高于对照,增幅为8.02%~32.47%.
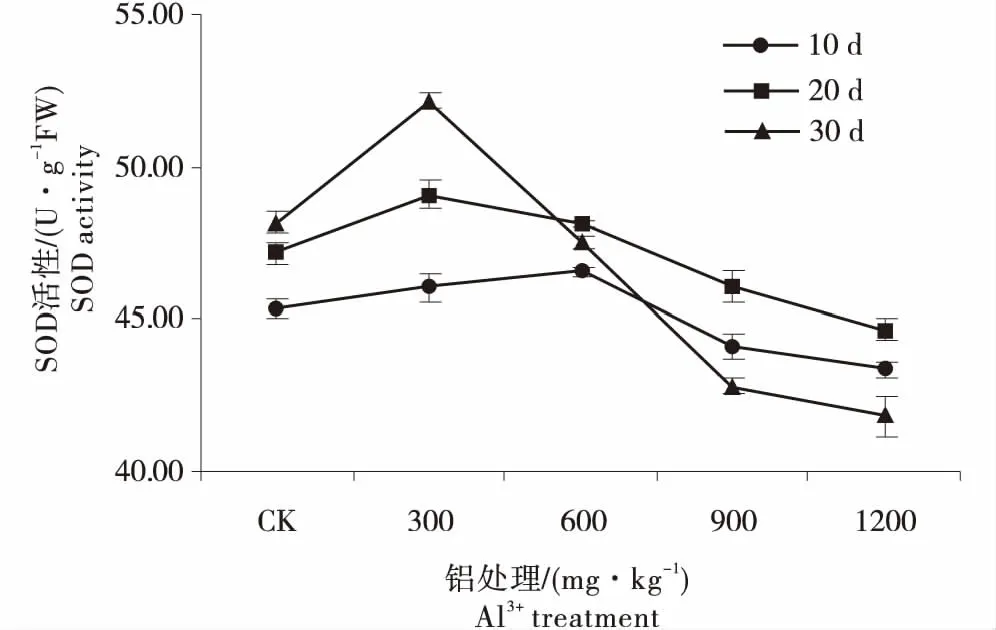
图3 铝胁迫对豆瓣菜叶片SOD活性的影响Figure 3 Effect of aluminum stress on SOD activity in leaves of watercress
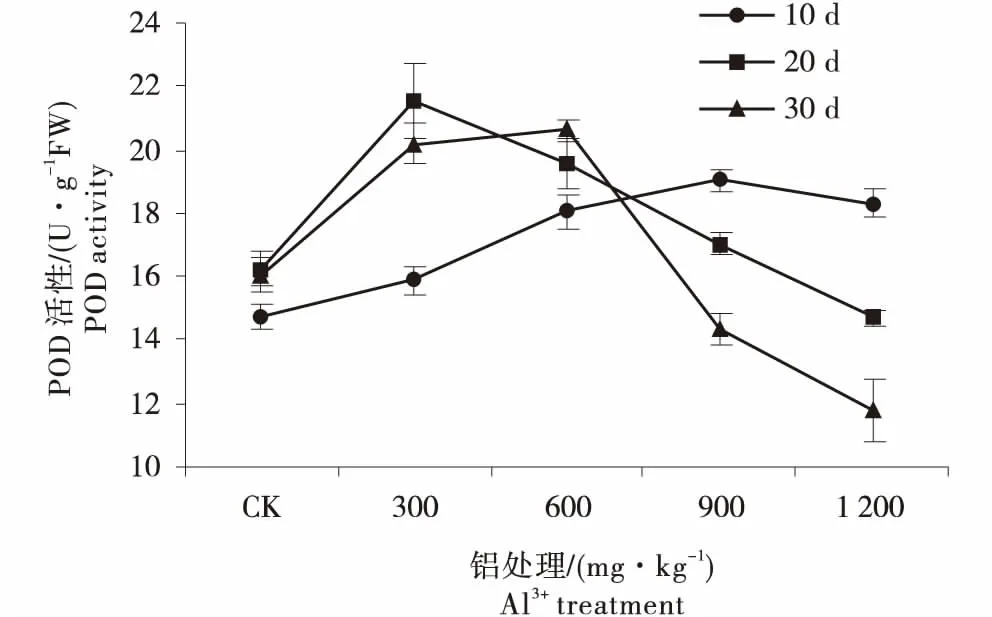
图4 铝胁迫对豆瓣菜叶片POD活性的影响Figure 4 Effect of aluminum stress on POD activity in leaves of watercress
由图5可知,铝胁迫下豆瓣菜叶片CAT活性整体呈现逐渐降低的趋势,降幅为8.93%~41.13%.随着时间的延长,300 mg/kg和1 200 mg/kg铝处理下的CAT活性呈逐渐降低的趋势,600 mg/kg铝处理下的CAT活性呈先降低后升高的趋势;在第30天时,1 200 mg/kg铝处理下的CAT活性为最低值,显著低于对照,降幅为41.13%.
由图6可知,随着时间延长,Al3+>300 mg/kg铝处理下的APX活性均呈现逐渐升高的趋势.在第10天时,豆瓣菜叶片的APX活性在铝胁迫下逐渐升高,各处理下的APX活性均显著高于对照,增幅为24.62%~48.99%;处理20 d后, APX活性呈先降低后升高的趋势,当Al3+≥600 mg/kg时,显著高于对照;在第30天时,1 200 mg/kg铝处理下的APX活性达到处理最高值,增幅为75.39%.

图5 铝胁迫对豆瓣菜叶片CAT活性的影响Figure 5 Effect of aluminum stress on CAT activity in leaves of watercress

图6 铝胁迫对豆瓣菜叶片APX活性的影响Figure 6 Effect of aluminum stress on APX activity in leaves of watercress
2.5 铝胁迫对豆瓣菜植株几种常量元素含量的影响
由表2可知,随着铝处理质量浓度的升高,豆瓣菜N含量整体呈现逐渐减小的变化趋势.其中根系的N含量在Al3+>300 mg/kg时显著低于对照,降幅为9%~27%,各处理之间差异显著.地上部分的N含量在铝胁迫下均显著低于对照,其中1 200 mg/kg铝处理下与900 mg/kg差异不显著,其余各处理间差异显著,降幅分别为16.85%~39.57%,是根系的1.39倍.
随着铝处理质量浓度的升高,豆瓣菜地上部分P含量呈现逐渐降低的变化趋势.其中,Al3+≤600 mg/kg时与对照差异不显著,Al3+≥900 mg/kg时与对照差异显著,降幅为24.61%~33.35%.根系P含量在Al3+≤900 mg/kg时大致呈现逐渐升高的变化趋势,各处理均显著高于对照,1 200 mg/kg处理下的P含量显著低于其他各处理,与对照差异不显著.
在铝胁迫下,豆瓣菜地上部分K含量呈现逐渐降低的变化趋势,各处理均显著低于对照,降幅为7.33%~37.06%;根系随着铝质量浓度升高的变化趋势较为复杂,300 mg/kg和900 mg/kg处理下显著高于对照,增幅为17.29%和22.68%,其他处理下的K含量与对照差异不显著.

表2 铝胁迫对豆瓣菜植株常量元素含量的影响
同列数据肩标小写字母不同表示两者差异达显著水平(P<0.05).
The differences between the same column indicates with the difference small letters were significant(P<0.05).
地上部Ca含量在Al3+≥300 mg/kg时呈逐渐降低的变化趋势,其中300 mg/kg的铝处理显著高于其他各处理,Al3+≤600 mg/kg时,Ca含量与对照差异不显著,Al3+>600 mg/kg时显著低于对照,且各处理组间差异显著,降幅为10.82%~53.19%.根系Ca含量在300 mg/kg的铝处理下与对照差异不显著,降幅达8.71%~56.34%.
在铝胁迫下,豆瓣菜植株的地上部Mg含量呈现先升高后降低的变化趋势,300 mg/kg处理下达到最高值,显著高于对照,增幅为10.72%,在1 200 mg/kg处理下显著低于对照,降幅为21.58%.根系的Mg含量在铝胁迫下总体呈现逐渐降低的变化趋势,Al3+≥600 mg/kg时,Mg含量显著低于对照,降幅为26.8%~41.46%.
豆瓣菜是一种喜钠植物,钠含量很高[14].由表2可知,在铝胁迫下,豆瓣菜植株地上部Na含量呈现逐渐升高的变化趋势,当Al3+≥600 mg/kg时,Na含量显著高于对照,增幅为43.79%~111.89%.根系中的Na含量随着铝处理质量浓度的升高呈现先下降后升高的变化趋势,当Al3+<1 200 mg/kg时,Na含量逐渐降低,600、900 mg/kg处理下显著低于对照,1 200 mg/kg处理下与对照差异不显著.
2.6 铝胁迫对豆瓣菜植株微量元素含量的影响
由表3可知,随着铝处理质量浓度的升高,豆瓣菜地上部分和根系的Al含量均呈逐渐升高的变化趋势,与对照相比,增幅分别为7.92%~46.04%、27.36%~193.41%;其中,当铝处理质量浓度大于300 mg/kg时,根系Al含量随铝处理质量浓度升高均显著高于地上部分;铝进入豆瓣菜植株后,主要集中在根系,地上部分铝含量增幅较小.
铝胁迫下豆瓣菜根系中各微量元素含量整体呈现逐渐降低的趋势,其中300 mg/kg铝处理下Fe含量显著低于对照,600 mg/kg铝处理下与对照差异不显著;Al3+≤600 mg/kg时,Zn含量与对照差异不显著,Al3+≥900 mg/kg时,根系Fe、Zn含量迅速下降,显著低于对照.Al3+≥600 mg/kg时,Mn含量显著低于对照;Cu含量遭受铝胁迫就开始显著降低,各处理均显著低于对照.地上部Fe、Zn含量呈现逐渐下降的趋势,各处理显著低于对照;地上部 Mn含量呈现先升后降的趋势,Al3+≤600 mg/kg时与对照差异不显著,Al3+≥900 mg/kg时,显著低于对照;Al3+<1 200 mg/kg时,各处理下地上部Cu含量与对照差异均不显著,1200 mg/kg铝处理下地上部Cu含量显著高于对照,除显著高于600 mg/kg外与其他各处理差异不显著.
2.7 铝胁迫对豆瓣菜植株元素转运的影响
转运系数是用来评价植物将金属从地下部向地上部运输的富集能力的一种指标.从表4来看,随着铝质量浓度的升高,豆瓣菜对铝的转运能力逐渐降低;在铝胁迫下N、P、K、Ca、Fe、Mn、Zn等营养元素向上转运受到了不同程度的抑制;Mg、Na、Cu的转运能力整体上随铝质量浓度升高而增加,其中Na和Cu元素转运能力增幅最大,当铝质量浓度为1 200 mg/kg时,Na的转运系数是对照的2.3倍,Cu的转运系数是对照的2.6倍.
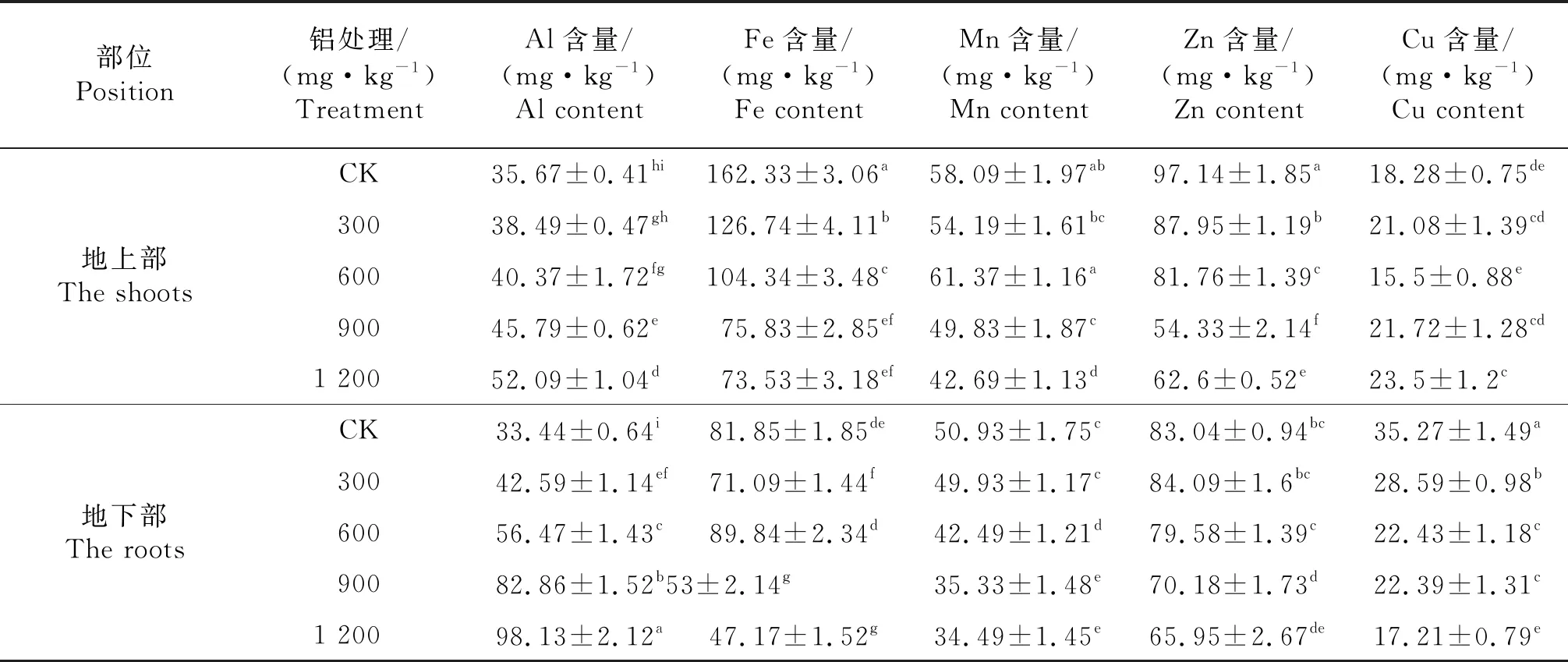
表3 铝胁迫对豆瓣菜植株微量元素含量的影响
同列数据肩标小写字母不同表示两者差异达显著水平(P<0.05).
The differences between the same column indicates with the difference small letters were significant(P<0.05).
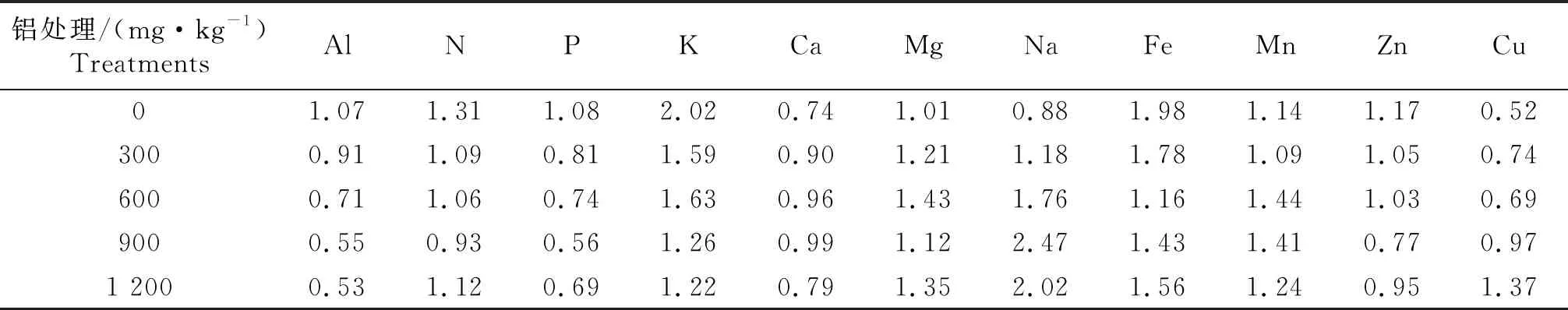
表4 铝胁迫对豆瓣菜植株元素转运系数的影响
3 讨论
3.1 铝胁迫对豆瓣菜生长状况的影响
植物根系是最先感受到环境胁迫的器官,所以植株的生物量和根系状态是判断植株受胁迫情况的重要指标.通过测定铝处理下豆瓣菜植株的生物量、茎粗、根长和根系活力等指标能明显看出,Al3+≤300 mg/kg时,根系伸长,根系活力增大,有机物和营养向地上部转运的效率较高,豆瓣菜的生长得到一定的促进;Al3+≥600 mg/kg时,植株根系生长受到抑制,生物量减少,处理浓度越高,植株生长受到的抑制越大,这与党甲军[16]对油菜在铝胁迫下生长影响的研究结果相符.
3.2 铝胁迫对豆瓣菜生理生化特性的影响
植物遭受胁迫时,植株体内渗透调节失衡,细胞膜的稳定性下降,细胞代谢的产物O2-、羟自由基(OH·)和H2O2等过度积累,引起膜脂过氧化作用等,影响植株正常生长[16-18].SOD、CAT、POD和APX等酶类是细胞抵御活性氧伤害的重要保护酶系统,它们在清除超氧自由基、过氧化氢和过氧化物以及减少羟基自由基形成等方面起着重要作用[16-20].本试验研究结果表明:低铝处理(≤300 mg/kg)下,豆瓣菜的SOD活性显著高于对照,说明低质量浓度的铝处理激发了自身的保护酶系统,促使SOD大量合成,使细胞内活性氧自由基的产生和清除处于动态平衡,对植株的生长并无显著影响;当Al3+>600 mg/kg时,SOD活性开始低于对照,推测600 mg/kg可能是豆瓣菜活性氧自由基清除系统对铝的最大耐受点;随着铝处理质量浓度的增加和处理时间的延长,细胞内产生的氧自由基超出SOD的清除能力,其活性降低[18-20].POD和CAT在清除H2O2的过程中协同工作,他们将H2O2还原为H2O,从而维持细胞内的ROS处于正常水平[18-20].在试验中发现,随处理时间延长,CAT活性逐渐下降;而在铝胁迫初期第10天时,POD活性有所上升,随着时间的延长,POD活性的变化趋势呈现先升高后降低的变化趋势,与SOD基本一致,这与张盛楠等[21]对马尾松幼苗在铝胁迫下生理变化的研究结果相同.由此推测,豆瓣菜叶片的CAT对铝胁迫较为敏感,植株一旦遭受铝胁迫,CAT活性即受到影响,迅速下降; POD与SOD在低质量浓度铝处理下活性升高,能有效维持细胞内活性氧的清除效率,从而保持活性氧清除系统的正常运行[19-21].而在高质量浓度铝胁迫下,3种抗氧化酶的活性均受到强烈抑制,推测此时活性氧清除系统已经遭到破坏,细胞内ROS含量上升,植株受到严重的氧化胁迫.铝胁迫下,叶绿体内H2O2的大量积累,APX通过催化AsA与H2O2反应将H2O2分解,从而缓解氧化胁迫[22].本试验结果表明,当Al3+>300 mg/kg时,随着处理时间的延长,APX活性逐渐升高,且显著高于对照,说明在叶绿体中APX与H2O2的动态平衡并未被打破,表现出了豆瓣菜的耐铝机制.
MDA是细胞质膜不饱和脂肪酸过氧化的产物,逆境下的膜脂过氧化导致MDA大量积累,MDA是植物遭受胁迫伤害的重要指标[19].Pro作为一种重要的渗透保护物质,其代谢中间产物具有诱导基因表达作用及降低渗透胁迫所造成的氧伤害作用,也常被作为反应植物逆境抗性的一个重要指标[17-19].本试验结果表明,随着铝处理质量浓度的升高, MDA的含量均呈升高趋势,处理时间越长,MDA含量积累量更大,说明铝胁迫下豆瓣菜的膜脂过氧化严重,细胞膜受到严重损伤.Pro随铝处理质量浓度升高,呈现先升高后降低的变化趋势,说明较低质量浓度(≤600 mg/kg)的铝处理下豆瓣菜激发了自身的保护机制,大量合成脯氨酸,而高质量浓度铝处理下,Pro显著低于对照,推测此时Pro消耗过量或者其合成机制遭到破坏.
3.3 铝胁迫对豆瓣菜营养元素吸收的影响
据有关资料报道,植物面对铝毒害有共质体内外两种解铝毒途径,前者包括胞质中的螯合效应、液泡的区域化隔离和耐铝型酶的进化等,后者包括铝在细胞壁上固定、质膜的选择透性、螯合物的分泌以及根际pH障碍层等[23-26].本试验中,Al处理下豆瓣菜根系Al含量远高于地上部,表明豆瓣菜吸收的铝主要集中在根系,茎叶吸收量较小,推测豆瓣菜对铝的耐性以通过在根系外排和细胞壁固定为主,具体机制仍需进一步研究证明[18,26].
高浓度的铝可能会抑制根际固氮微生物和酶的活性,降低土壤有效氮的供应,导致植株体内的总N量逐渐降低[27].本试验中豆瓣菜植株的P含量分布随铝质量浓度的升高发生了显著变化,地上部的P含量逐渐降低,根系的P含量先升高后降低,在1 200 mg/kg铝处理下与对照差异不显著,但仍显著高于地上部,这与章爱群等[28]对铝胁迫下玉米地上部分和根系营养元素含量变化的研究结果一致.
K在植物体内主要以离子形式存在,虽然细胞中K的浓度很高,但K不参与任何代谢物的组成,K在细胞中主要与等浓度的无机和有机阴离子调节细胞的渗透势[29].Na只对某些植物种类是必需的矿质元素,孙晓慧等[30]的研究表明,豆瓣菜是一种特殊的喜钠植物,植株体内的钠含量很高.在某些情况下,Na+可以以很高的浓度在液泡中代替K+的作用调节渗透势.从试验结果来看,在铝胁迫下,豆瓣菜的K、Na含量表现出极显著的相关性.随着铝处理质量浓度的升高,地上部的K含量迅速降低,而Na含量与之对应的上升,说明在铝胁迫下,豆瓣菜地上部分K和Na的含量联系紧密,Na可以在某种程度上弥补细胞内K含量的缺失,推测这可能是豆瓣菜植株内K、Na之间可能存在某种平衡机制,以联合对抗外界的胁迫因素,具体机制仍需进一步的研究试验.
铝毒对植物的危害不仅仅体现在对根系生长的抑制,铝毒影响植物生长的另一种方式是抑制矿质养分的吸收诱发缺素症[28,31].本试验研究结果表明,在铝胁迫下豆瓣菜对部分营养元素(N、P、K、Ca、Mg、Fe、Mn、Zn、Cu)的吸收和转运受到了不同程度的抑制作用,推测其部分原因是由于酸性土壤中溶出不同形态的活性铝阻塞了阳离子通道,降低了多价阳离子(Ca2+、Mg2+、Mn2+、Zn2+)在根皮层细胞质外体的负载量,同时高浓度的Al3+强烈竞争质外体上多价阳离子的结合位点,导致植株对多价阳离子的运载量减少[25].如铝通过阻塞Ca2+离子通道而降低Ca2+的吸收量,通过封闭转运蛋白上的Mg2+的结合位点而抑制Mg2+吸收等[32].
本试验发现,豆瓣菜会富集土壤中的铝,且随着铝处理质量浓度的升高,豆瓣菜地上部和根系的Al含量均逐渐升高,而每人每周可耐受的铝摄入量为2 mg/kg[33],食用富铝土壤中种植的豆瓣菜有铝超标的风险;基于豆瓣菜对环境中的铝有富集能力,且在较低浓度铝处理下生长良好,可以考虑将其用于吸附净化铝污染土地.
4 结论
1) 综合来看,豆瓣菜对较低质量浓度的铝处理(≤300 mg/kg)有较好的耐受性,随着铝质量浓度的升高,豆瓣菜的生长受到抑制,铝处理对其生长的影响整体呈现“低促高抑”的变化趋势.
2) 当豆瓣菜遭受铝胁迫时,植株对N、P、K、Ca、Mg等常量元素以及Fe、Zn、Cu等微量元素的吸收和转运均有不同程度的影响,其中主要表现为抑制营养元素(N、Ca、Mg)的吸收和转运.
3) 铝质量浓度>600 mg/kg时,植株自由氧清除系统就会遭受破坏,细胞膜受到损伤,铝处理浓度越大,处理时间越长,豆瓣菜受到的伤害越大.

