一株高效降解羽毛废弃物菌株的筛选及表达条件优化
张钰文 袁航 于江悦 马晓晓 史超硕 李玉
(工业发酵微生物教育部重点实验室 天津科技大学生物工程学院,天津 300457)
羽毛中90%的蛋白是由富含半胱氨酸的β-角蛋白组成的,是重要的蛋白质资源。由于β-角蛋白含有大量二硫键而难被降解,导致其无法直接被利用[1]。目前,羽毛废弃物处理通常采用高温高压、强酸强碱和挤压膨化等物理化学方法[2],不仅破坏羽毛中重要的氨基酸,使某些氨基酸的消化率和利用率降低[3],还造成严重的环境污染[4]。因此,利用生物酶解法可使羽毛废弃物的处理过程更加清洁、高效。
角蛋白酶(Keratinase,E.C 3.4.21/24/99.11)是细菌[5]、放线菌[6]和真菌[7]等微生物产生的一种金属或丝氨酸蛋白酶[8-9],可破坏角蛋白二硫键使其顺利分解为氨基酸及多肽,从而提高角蛋白利用率。目前角蛋白酶生产菌株产酶水平普遍偏低、发酵周期较长、生产成本较高、研究技术不够成熟[10]等问题,致使只有少数具备商业开发价值。因此,不断筛选和优化角蛋白酶生产菌株,降低生产成本,对实现角蛋白酶的工业化应用具有重要意义。
本研究从全国5个不同地方的猪、羊圈土壤中筛选分离了一株降解羽毛的菌株,通过菌株形态特征观察和16S rDNA序列分析法对该菌株进行鉴定,并克隆了角蛋白酶基因序列。在此基础上,通过筛选信号肽来提高角蛋白酶基因在枯草芽孢杆菌中的表达,旨为探索信号肽与靶蛋白表达效率之间的关系研究奠定基础,同时有助于实现重组角蛋白酶的工业化生产。
1 材料与方法
1.1 材料
1.1.1 土样 来自新疆、河南、内蒙古、河北、山东地区的羊圈或猪圈的土壤。羽毛:来自宁夏好水川养殖有限公司。菌株与质粒:B.subtilisWB600和质粒pWB980均由本实验室保存。试剂与培养基:DNA限制性内切酶、DNA聚合酶、DNA连接酶,购自TaKaRa公司;质粒提取试剂盒、DNA片段纯化回收试剂盒、DNA片段切胶回收试剂盒,购自OMEGA公司。
1.1.2 LB培养基 1.0%蛋白胨、0.5%酵母粉、1.0%NaCl、2.0%琼脂粉;富集培养基:0.3%牛肉膏、1.0%蛋白胨、0.5% NaCl、pH自然;牛奶培养基:1.0%蛋白胨、1.0% NaCl、0.5%酵母粉、1.5%脱脂牛奶、2.0%琼脂粉;羽毛粉发酵培养基:1%羽毛粉、0.05% KH2PO4、0.12% K2HPO4、0.05% NaCl、0.01%MgSO4、0.02% CaCl2、pH 7.5-8.0;发酵产酶培养基:2.0%蛋白胨、1.0%酵母粉、1.0%葡萄糖、0.3%KH2PO4、0.6% Na2HPO4、0.03% MgSO4、pH 7.5。
1.2 方法
1.2.1 产角蛋白酶菌株的筛选 称取1 g土壤放入富集培养基中,37℃、220 r/min培养12 h。吸取5 mL上述菌悬液梯度稀释至10-8,每个稀释度取100 μL涂布至牛奶平板,于37℃培养箱中培养1 d。挑出产透明圈的单菌落,并进行多次传代培养。
挑取1个传代纯化多次的单菌落,接种于50 mL LB培养基中,37℃、220 r/min培养12 h后,按照2%的接种量,接种于100 mL羽毛粉发酵培养基中,37℃、220 r/min中培养48 h,观察羽毛降解情况并测其角蛋白酶酶活。
1.2.2 菌落和菌体形态观察 将分离纯化的菌株分别划线于LB平板和牛奶平板中,37℃恒温培养18-24 h,观察菌落的形态、大小、颜色、菌落边缘和表面质地等特征。挑取单菌落,制片,革兰氏染色后,在光学显微镜下观察菌体的个体形态。
1.2.3 角蛋白酶活力的测定 本研究参照 Yamamura等[11]的测定方法,将发酵液4℃、12 000 r/min,离心 10 min,取 250 μL 粗酶液,加入 250 μL 0.05 mol/L Gly-NaOH缓冲液(pH 10.0)溶解1%的底物(角蛋白),60℃反应10 min,加入500 μL 0.4 mol/L三氯乙酸溶液终止反应(对照组先加入三氯乙酸)。12 000 r/min,离心 5 min,取上清 500 μL, 加 入2.5 mL 0.4 mol/L Na2CO3溶液和500 μL福林酚试剂(1∶2 V/V)混合,60℃显色20 min。在波长680 nm下检测吸光值。
酶活力定义:1 g固体酶粉(或者1 mL液体酶),在60℃,pH 10.0条件下,1 min水解角蛋白产生1 μg酪氨酸为一个酶活力单位,以U/g(U/mL)表示。
酶活力的计算,得到测酶活的标准曲线的回归方程:y=0.01x+0.000 7,R2=0.999 7酶活计算公式:

式中:X为样品的酶活力,U/g(U/mL);A为样品平行试验的平均吸光度;K为吸光常数;1为反应试剂的总体积(mL);10为反应时间10 min,以1 min计;n为稀释倍数。
1.2.4 分子生物学鉴定 采用细菌基因组DNA提取试剂盒,以菌株M的基因组DNA作为模板,用16S rDNA保守序列的通用引物27F(5'-AGAGTTTGATCMTGGCTCAG-3') 和 1 429R(5'-TACGGCTACCTTGTTACGACTT-3'3进行PCR扩增,扩增条件为95℃预变性5 min,94℃变性45 s,60℃退火45 s,72℃延伸2 min,30个循环,72℃再延伸10 min。琼脂糖凝胶电泳检测扩增产物,纯化回收PCR产物并测序。将测序结果在NCBI网站上进行BLAST比对,选取并下载相似性99%以上的序列,构建系统进化树。
1.2.5 角蛋白酶基因的获取 将筛选得到的高效降解羽毛菌株的16S rDNA进行测序,将测序结果在NCBI网站上进行BLAST比对,初步判定其为芽孢杆菌属,从 GenBank 中下载芽孢杆菌中的角蛋白酶基因序列,利用软件 DNAMAN比对后,用引物设计软件 Snapgene在其保守区设计了一对引物,上游引物引入BamHI酶切位点,下游引物引入SphⅠ酶切位点。引物由苏州金维智公司合成。
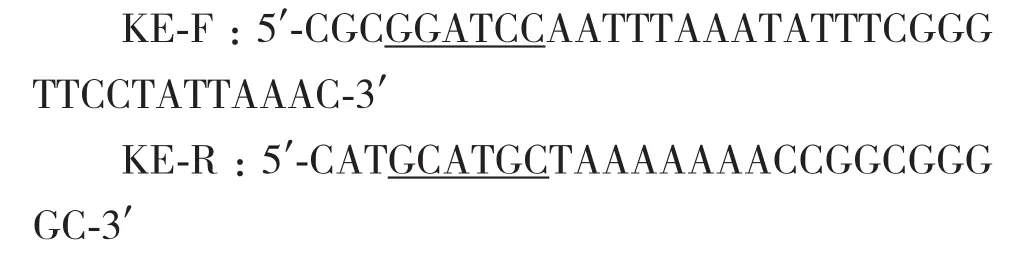
以试剂盒提取的菌株M基因组为模板,PCR扩增角蛋白酶基因,纯化PCR产物并测序,最终确定其为角蛋白酶基因kerK。
1.2.6 表达载体的构建 利用在线工具SignalP 5.0 Serve(http ://www. cbs.dtu.dk/services/Signa lP/) 对角蛋白酶基因kerK进行分析,可知其自身带有Sec途径的信号肽,以基因组为模板,设计引物KE1-F(5'-CGCGGATCCCAGGCGGCAGGGAAATCA-3');KE1-R:(5'-CATGCATGCTAAAAAAACCGGCGGG GC-3'),利用PCR的方法获得不含信号肽的角蛋白酶基因kerK-1,进行纯化回收。
角蛋白酶基因kerK经PCR扩增纯化后,用BamHⅠ-SphⅠ双酶切,回收,通过Solution Ⅰ连接酶连接到 pWB980 表达载体上,连接反应体系为(20 μL):pWB980 载体片段 6 μL,角蛋白酶基因kerK片段 4 μL,Solution Ⅰ 10 μL,16℃连接 6 h,转化入B.subtilisWB600。
将含有信号肽SPSacB、SPDacB、SPYoaW和SPNprE的质粒进行试剂盒回收。分别使用KpnI -BamHⅠ双酶切回收信号肽片段;将信号肽片段、角蛋白酶kerK1基因通过SolutionⅠ连接酶连接到 pWB980 表达载体上,连接反应体系为(20 μL):pWB980载体片段6 μL,信号肽-角蛋白酶基因kerK1片段4 μL,SolutionⅠ 10 μL,16℃连接 6 h,转化入B.subtilisWB600。
2 结果
2.1 产蛋白酶菌株的初筛与复筛
从不同土壤中,利用牛奶培养基筛选得到20株能够产蛋白酶的菌株,它们均能有效的分解牛奶培养基中的酪蛋白成分。计算得到水解圈直径与菌株直径的比值初步判断菌株水解蛋白的能力。
利用羽毛粉液体发酵培养基,将初筛得到的20株有较大水解圈的菌株进行摇瓶复筛,48 h发酵后,观察其羽毛降解情况,并以1.2.3的方法测定角蛋白酶活力。发现其中编号为M的菌株降解羽毛的效果最好,其酶活为21.98 U/mL,如图1所示。将菌株M作为目的菌株,进行下一步的研究。
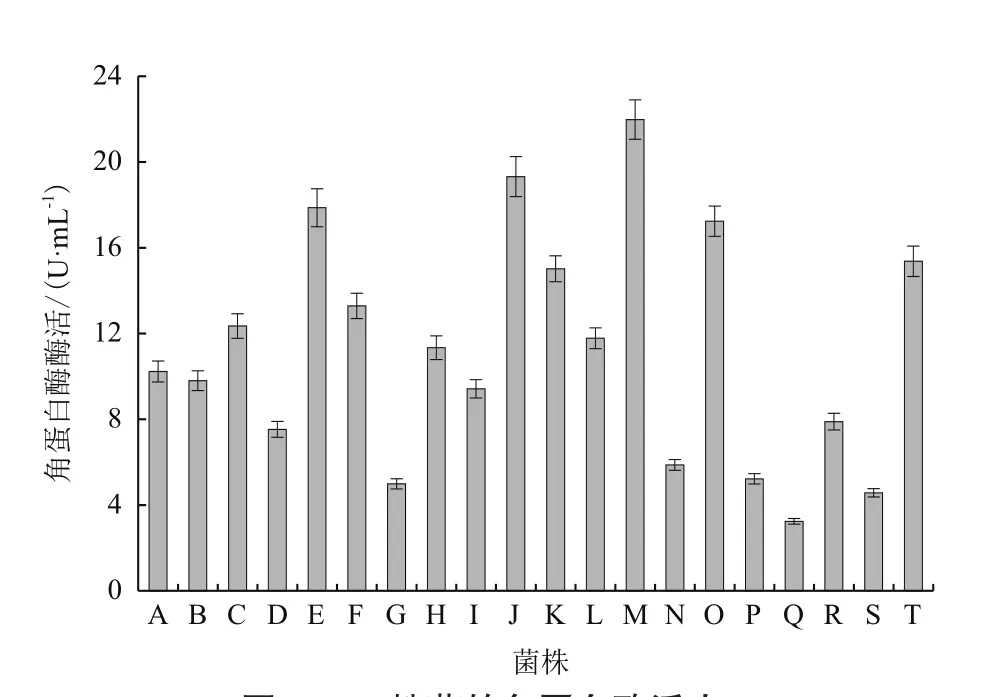
图1 20株菌的角蛋白酶活力
2.2 形态学观察及菌株鉴定
通过筛选获得的菌株M,其在初筛平板上菌落为乳白色、边缘不规则、扁平、表面光滑,挑起时较黏稠。革兰氏染色后镜检,发现菌株M为革兰氏阳性菌、短直杆状、有芽孢,染色均匀(图2),初步判断其为芽孢杆菌(Bacillussp.)。
菌株M经16S rDNA通用引物进行PCR扩增,用0.8%琼脂糖凝胶电泳检测,显示其大小约1 500 bp,将PCR扩增产物测序,测得分子量大小为1 463 bp。测得的16S rDNA的序列与 GenBank数据库中的序列进行相似性比对发现,该菌株基因序列与芽孢杆菌属的解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、枯草芽孢杆菌(Bacillus subtilis)等几株芽孢杆菌属的16S rDNA同源性均达99%以上,系统进化树如图3所示,初步确定该菌为芽孢杆菌。

图2 菌株M的菌落形态和个体形态特征
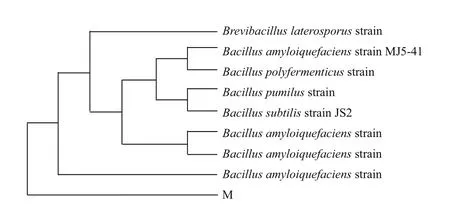
图3 菌株M的系统进化树
2.3 角蛋白酶基因kerK及重组载体的构建
以菌株M基因组为模板,PCR扩增带自身信号肽SPKerK的角蛋白酶基因(图4),扩增产物测序结果与B.amyloliquefaciensK11角蛋白酶基因(GenBank:KR868996.1)相似性达到了97.63%,将其命名为角蛋白酶基因kerK,按照1.2.6所述方法,构建含有自身信号肽的重组菌株,命名该重组菌株为R1-KerK。
选取本实验室表达碱性蛋白酶比较好的4个信号肽SPSacB、SPDacB、SPYoaW与SPNprE,分别构建重组 质 粒 pWB980-SacB-kerK1、pWB980-DacB-kerK1、pWB980-YoaW-kerK1、pWB980-NprE-kerK1,并转化入B. subtilisWB600,获得重组菌株分别命名为R2-SacB,R3-DacB、R4-YoaW与R5-NprE。

图4 角蛋白酶基因PCR扩增结果
2.4 重组菌株初筛
5株重组菌株R1-KerK、R2-SacB、R3-DacB、R4-YoaW与R5-NprE在牛奶平板上,37℃,培养18 h,观察蛋白水解圈大小,如图5所示,与对照A相比,5株重组菌株均产生水解圈,表明5株重组菌中角蛋白酶基因均已成功表达,其中重组菌株R3-DacB的HC值(透明圈直径与菌落直径的比值)最大,为4.5,可以初步认为信号肽SPDacB最有利于角蛋白酶基因的表达。
2.5 发酵上清液的SDS-PAGE检测
2.6 不同信号肽对角蛋白酶分泌的影响
5株重组菌株经48 h摇瓶发酵,取发酵液上清测定角蛋白酶酶活(图7),信号肽SPSacB、SPDacB、SPYoaW、SPNprE和SPKerK表达角蛋白酶水平相差较大。

图5 重组菌株的初筛
将发酵48 h的上清液进行SDS-PAGE分析,结果如图6所示,从图中可以看出5株重组菌上清液在相对分子质量为39 kD左右均有蛋白条带,与角蛋白酶相对分子质量相符。说明5株重组菌株均能成功表达角蛋白酶,其中重组菌株R3-DacB的表达角蛋白酶量较高。重组菌株R1-KerK、R2-SacB、R4-YoaW、R5-NprE产角蛋白酶的酶活分别为68.15 U/mL、63.35 U/mL、18.35 U/mL和23.76 U/mL,其中重组菌株R3-DacB的酶活最高,达到了226.34 U/mL,为菌株M的10倍,是菌株R1-KerK的3.32倍。同时,利用不同菌株发酵降解羽毛,结果(图8)显示重组菌株R3-DacB完全降解羽毛的时间最短,相较于初始菌株M缩短了12 h。以上结果表明,信号肽对角蛋白酶的分泌表达有一定的影响,信号肽DacB能够明显提高角蛋白酶的表达活性。
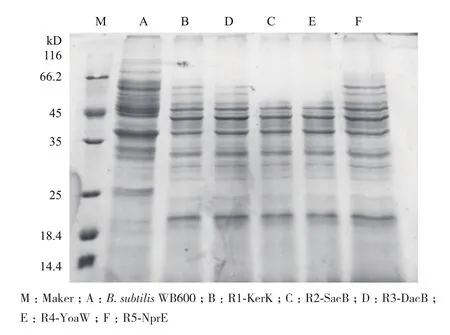
图6 不同重组菌株表达角蛋白酶的SDS-PAGE分析

图7 重组菌株角蛋白酶酶活分析
3 讨论

图8 羽毛降解效果对比
羽羽毛废弃物是家禽屠宰场中产量最高的自然角质材料。根据调查,全世界羽毛废弃物的日积累量约为5×106万t,是巨大的资源库,同时大量的废弃物堆积也造成了严重的环境污染问题。生物降解是最合理的处理方式,角蛋白酶是生物降解羽毛的关键酶,目前羽毛角蛋白降解菌的研究主要集中在细菌、真菌和放线菌。侯燕燕等[12]在新疆天然盐碱地土壤中筛选出一 株高产角蛋白酶的耐盐菌Bacillussp. K-18,其发酵液的角蛋白酶活力为96.7 U/mL。刘柏宏[13]筛选出一株地衣芽孢杆菌,通过对宿主菌株、调控元件及产酶条件的优化,使角蛋白酶酶活比初筛菌株酶活提高了5倍。耿秀秀等[14]从新疆戈壁沙漠中筛选出一株能够降解羽毛的戈壁异常球菌(Deinococcus gobiensis),成功构建了表达角蛋白酶Dgker的重组菌株E.colipET22b-Dgker/BL21,其能够在3 d内完全降解羽毛。孙蓉等[15]筛选得到一株高效降解羽毛的菌株Bacillus subtilisBS10,并且以羽毛粉为底物测定酶活力,为(1.88±0.10)U/mL。本实验通过对筛选到的芽孢杆菌上的角蛋白酶基因在枯草芽孢杆菌中异源表达后其角蛋白酶酶活比初筛菌株提高了2.10倍。信号肽在蛋白质分泌中起到的重要作用,陈景奇[16]通过筛选比较了6种信号肽,信号肽SPNprE使α-淀粉酶AmyLM2,酶活达到260 U/mL,为其自身信号肽的1.79倍。Guan等[17]筛选了19个Sec分泌途径的信号肽,最终获得SPYncM,使氨基肽酶的分泌效率比原始信号肽提高了1.2倍。本实验通过筛选比较了5种信号肽,信号肽SPDacB使角蛋白酶酶活达到226.34 U/mL,是自身信号肽SPKerK的3.32倍。研究表明,信号肽之所以能影响酶的分泌表达,可能是由于它的N区及疏水H区电荷分布的影响,还可能是由于信号肽N区稀有密码子的缺失,从而增强酶的分泌表达[18],H区疏水性残基与信号肽其他区域相互作用也能够影响酶的分泌[19]。同时很多实验表明信号肽的筛选能够有效地提高目的蛋白的表达量,但到目前为止,最佳的信号肽仍无法预测,只能通过大量的筛选来确定目的蛋白的最佳信号肽。在未来的研究中,可在分子层面对信号肽进行进一步改造,也可通过研究枯草芽孢杆菌分泌途径的机制或影响分泌的其他因素,不断提高角蛋白酶分泌表达量,以达到能够工业化应用的目的[20]。
4 结论
本研究以羽毛为唯一碳源,从自然界中筛选到20株产角蛋白酶菌株,初筛获得的菌株接种到含有羽毛粉的复筛培养基中进行发酵筛选,最终获得对羽毛降解能力较强的菌株M,其酶活为21.98 U/mL。通过形态学观察和16S rDNA序列比对,构建进化树,经鉴定该菌株为芽孢杆菌(Bacillussp.)。克隆其角蛋白酶基因kerK,并进行信号肽的筛选比较,成功在B. subtilisWB600中构建重组菌株,发酵48 h,重组菌株R3-DacB发酵48 h时,发酵上清粗酶液中角蛋白酶活力为226.34 U/mL,是自身信号肽SPKerK的3.32倍。

