高压均质对脂质体囊泡特性和稳定性的影响
邰克东,赵苏茂,杨紫恒,毛立科,高彦祥,袁 芳*
(北京食品营养与人类健康高精尖创新中心,中国农业大学食品科学与营养工程学院,北京 100083)
作为近年来发展迅速的功能活性成分传递载体,脂质体在食品工业领域中的研究受到越来越多的关注。该载体以磷脂和胆固醇为主要壁材,通过磷脂分子在水相体系中的自组装,形成与细胞膜类似的磷脂双分子层结构,包括由磷脂非极性尾部交联组成的疏水性区域和磷脂极性头部包围形成的水相内核,具有同时包埋脂溶性和水溶性活性物质的能力,极大提高了活性物质的传递效率[1-2]。此外,脂质体还具有控释缓释[3]、良好的吸收性和生物相容性[4]以及毒性低[5]等一系列优势,在食品领域中已有包括类胡萝卜素[6-7]、白藜芦醇[8]、VC[9]、辅酶Q10[10]、花青素[11]等诸多功能活性成分的包埋应用研究。由于磷脂易发生不可逆的氧化降解和脂质体囊泡聚集沉降等现象,容易导致被包埋活性物质的渗漏,极大限制了脂质体在食品工业中的应用。目前在药剂学中有利用特殊分子材料对脂质体膜表面的靶向修饰研究[12],其提高了脂质体的理化稳定性,但由于较高的生产成本和材料安全性问题,该技术在食品领域的应用前景不太理想。如何利用食品原料来提高脂质体囊泡的稳定性是目前食品脂质体研究亟待解决的主要问题之一。
目前已有研究利用果胶[9]、蛋白质[13]、壳聚糖[14]及其衍生物[15]等食品生物大分子物质对脂质体膜表面进行修饰,从而提高其理化稳定性。但新壳层材料的引入提高了食品脂质体的生产成本,使得制备工艺也更加复杂,规模化的工业生产容易因设备的限制导致产品质量不理想。胆固醇作为脂质体制备常用的辅剂,通过嵌入磷脂双分子层中来提高脂质体膜结构的稳定性,从而对稳定脂质体具有重要作用[16-17]。我国居民膳食胆固醇参考摄入量为每天不超过300 mg,胆固醇与众多人体心脑血管疾病密切相关,有研究已证实膳食胆固醇是否长期过量摄入对高胆固醇血症的发生有重要影响[18];因此如何控制脂质体中胆固醇的用量,以期得到稳定性良好且胆固醇相对含量偏低的脂质体是本研究的主要目的。高压均质法作为乳剂传递体系常用的破碎乳化制备方法,可显著降低乳剂液滴的平均粒径,改善乳剂均一性,对提高乳剂的物理稳定性有重要作用,目前已在工业化生产中大规模应用;因此在工业化生产中利用高压均质法制备食品脂质体具备实际应用的可能。Chung等在研究高压均质法制备包埋有依芬普司的单一大豆卵磷脂脂质体时,循环均质3 次后,均质次数对其粒径和多分散指数(polydispersion index,PDI)的降低无显著作用,100 MPa和150 MPa均质得到的依芬普司脂质体粒径基本一致[19]。Guner等研究发现,无论是蛋黄磷脂还是大豆卵磷脂,在利用去离子水、磷酸盐缓冲液(phosphate buffered saline ,PBS)和醋酸盐缓冲液3 种不同的水化介质制备脂质体时,提高均质压力可有效降低脂质体囊泡的粒径[20]。
与上述不同的是,本研究利用高压均质法探究均质压力、均质次数以及胆固醇含量对含胆固醇脂质体囊泡特性和稳定性的影响。通过将平均粒径、Zeta电位、PDI、离心物理稳定性与磷脂膜和囊泡微结构结果的综合分析,明确利用合适的均质参数和胆固醇用量来提高高压均质法制备的大豆卵磷脂脂质体的物理稳定性,以期为今后开发包埋有功能活性成分的高稳定性食品脂质体产品提供理论参考。
1 材料与方法
1.1 材料与试剂
大豆卵磷脂(纯度大于98%) 嘉吉亚太系统(北京)食品有限公司;芘(纯度大于99%)、8-苯氨基-1-萘磺酸铵盐(8-anilino-1-naphthalenesulfonic acid,ANS)(纯度大于95%)和1,6-二苯基-1,3,5-己三烯(1,6-diphenyl-1,3,5-hexatriene,DPH)(纯度98%)美国Sigma公司;胆固醇、三氯甲烷、无水甲醇、丙酮和二甲基亚砜(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
R201L旋转蒸发仪 上海申生科技有限公司;AR1140型分析天平 上海奥豪斯国际贸易有限公司;Ultra-Turrax T25高速剪切仪 德国IKA公司;NS1001L2K型高压均质机 意大利Niro-Soavi公司;Zetasizer Nano-ZS90型激光粒度仪 英国Malvern公司;UV-1800型紫外-可见分光光度计 日本Shimadzu公司;LUMiSizer全功能稳定性分析仪 德国LUM公司;3K15型高速冷冻离心机 德国Sigma公司;F-7000型荧光分光光度计 日本Hitachi公司;JEM-1200EX型透射电子显微镜 日本电子株式会社。
1.3 方法
1.3.1 高压均质法制备脂质体
采用薄膜水化结合高压均质法制备脂质体[19-20]。准确称取适量的大豆卵磷脂和胆固醇,用25 mL的三氯甲烷将其完全溶解,40 ℃条件下利用真空旋转蒸发仪减压蒸发除去三氯甲烷,待有机相在圆底烧瓶底部形成薄膜后加入100 mL PBS(0.05 mol/L、pH 7.0),利用超声水浴将磷脂膜洗脱,制成粗脂质体混悬液。利用高速剪切仪将粗脂质体混悬液高速剪切分散1 min(10 000 r/min),最后经由高压均质机分别在20~80 MPa条件下循环均质1~6 次得到脂质体制剂。
1.3.2 脂质体粒径和Zeta电位测定
利用动态光散射技术测定脂质体囊泡的流体动力学直径、Zeta电位和PDI。为减少多散射光所造成的测量误差,待测样品用同样浓度的PBS稀释10 倍,测量时取适量稀释后的样品装入聚苯乙烯比色皿中,折光系数设定为1.490,25 ℃下保温平衡1 min,每个样品平行测定3 次,记录样品的平均粒径、Zeta电位和PDI[20]。
1.3.3 脂质体物理稳定性测定
利用LUMiSizer稳定性分析仪,通过加速分层和量化沉淀、悬浮的方法考量脂质体的物理稳定性。参照Tan Chen等的方法[14],取脂质体样品约0.8 mL,均匀注射至测试管底部,温度设定为25 ℃,离心转速为4 000 r/min,光散射系数1.00,样品透射光特征线每20 s记录一次,总测定时长2 h。通过软件绘制出不稳定系数随时间的变化曲线以表示样品在高速离心过程中的失稳状态,不稳定系数越大,变化越剧烈,说明样品物理稳定性越差。
1.3.4 不同因素对高压均质法制备脂质体囊泡特性和稳定性的影响
1.3.4.1 不同均质压力对脂质体囊泡的影响
参考文献[19,21],准确称取1 g大豆卵磷脂和0.25 g胆固醇,按照1.3.1节中的方法制备脂质体,均质压力分别为20、30、40、50、60、70、80 MPa,所有样品均质1 次,考察脂质体囊泡的粒度特性和物理稳定性。
1.3.4.2 不同均质次数对脂质体囊泡的影响
准确称取1 g大豆卵磷脂和0.25 g胆固醇,按照1.3.1节中的方法制备脂质体,均质压力固定为50 MPa,样品循环均质1~6 次,考察脂质体囊泡的粒度特性和物理稳定性。
1.3.4.3 不同m(大豆卵磷脂)∶m(胆固醇)对脂质体囊泡的影响
准确称取1 g大豆卵磷脂和一定量的胆固醇,使得二者质量比分别为2∶1、3∶1、4∶1、6∶1、8∶1、10∶1,按照1.3.1节中的方法制备脂质体,均质压力和均质次数分别为50 MPa和3 次,考察脂质体囊泡的粒度特性和物理稳定性。
1.3.5 荧光探针法分析脂质体膜特性
1.3.5.1 脂质体膜微极性的测定
采用芘荧光探针法研究脂质体膜微极性[22]。取0.1 mL配制好的芘-丙酮溶液(2×10-3mol/L)加入到稀释10 倍的5 mL脂质体样品中,4 ℃避光静置12 h。25 ℃条件下于荧光分光光度计中测定样品,激发波长338 nm,记录350~450 nm发射波长范围内样品的荧光强度,激发电压为450 V,狭缝宽度均为5 mm。在373 nm和385 nm波长处记录芘特征荧光光谱第1个和第3个峰的荧光强度,分别记为I1和I3,并计算二者比值I1/I3,用以表征芘荧光探针在脂质体膜内部环境的微极性。
1.3.5.2 脂质体膜表面疏水性的测定
采用ANS探针法研究脂质体膜表面疏水性[23]。取0.1 mL配制好的ANS-PBS溶液(8×10-3mol/L )加入到稀释10 倍的5 mL脂质体样品中,避光静置30 min。25 ℃条件下于荧光分光光度计中测定样品,激发波长350 nm,记录375~600 nm发射波长范围内样品的荧光强度,激发电压为450 V,狭缝宽度均为5 mm。通过比较ANS在不同脂质体样品中的光谱峰强度变化,表征脂质体膜表面疏水性强度。
1.3.5.3 脂质体膜流动性的测定
采用DPH探针法[24]研究脂质体膜的流动性。取1 mL配制好的DPH-二甲基亚砜溶液(2×10-6mol/L)加入到稀释10 倍体积的5 mL脂质体样品中,避光静置60 min。25 ℃条件下于荧光分光光度计中测定样品,设定激发波长360 nm、发射波长430 nm、激发电压600 V、狭缝宽度均为5 mm,按照公式(1)、(2)计算荧光偏振度P。

式中:I0,0和I90,90代表两个偏振器设定方向平行;I0,90和I90,0代表两个偏振器设定方向垂直;G为光栅校正因子。
通过计算出偏振度P来表征脂质体膜的流动性,偏振度P越大,脂质体膜的流动性越小。
1.3.6 透射电子显微镜观察高压均质法制备脂质体的微观形貌
利用PBS将脂质体样品稀释至合适浓度,将稀释样品滴入铜网中,用磷钨酸溶液染色,滤纸吸除多余的液体并在室温下自然干燥铜网,用透射电子显微镜观察脂质体样品。
1.4 数据统计与分析
每组实验至少重复3 次,采用Origin 9.0软件对实验数据进行处理,运用SPSS 18.0软件对数据进行单因素方差分析,显著性水平为0.05。
2 结果与分析
2.1 均质压力对脂质体粒度特性的影响
传统薄膜水化法形成的脂质体囊泡粒径较大且均一性较差,长期放置易形成沉淀,因此降低粒径的诸多方法成为薄膜水化法最常用的辅助制备手段,其中高压均质法作为常用的乳化均质手段,既避免了超声破碎法可能导致的制剂金属残留问题,又比常用的膜挤出器法在样品处理量上有较大优势。

图1 均质压力对脂质体粒径、Zeta电位(A)和PDI(B)的影响Fig. 1 Effect of homogenization pressure on vesicle size,zeta potential (A) and PDI (B) of liposomes
由图1A可知,随着均质压力的增大,脂质体粒径逐渐减小。当均质压力大于50 MPa时,脂质体的粒径无明显变化,粒径基本维持在130~140 nm范围内。图1B显示,当均质压力为30 MPa时,脂质体平均粒径和PDI均有所上升,说明此时脂质体易产生囊泡破碎后又重新融合聚集的现象,导致较大脂质体囊泡的产生。当均质压力高于50 MPa时,体系PDI增大,说明脂质体在经过较高均质压力处理后,虽然平均粒径仍有所降低,但过小脂质体囊泡因表面张力过大而重新聚集融合,且脂质体样品因均质作用,样品温度显著升高,从而加速体系内流动性脂质体囊泡的聚集现象,使脂质体均一性变差,对脂质体的长期贮藏有不利影响。均质压力对脂质体的Zeta电位无显著影响,所有脂质体的Zeta电位均在-30~-35 mV范围内。刘会晓在对番茄红素纳米脂质体的研究中发现,番茄红素脂质体的平均粒径和PDI在均质压力为30~70 MPa范围内均随均质压力的升高而逐渐降低,主要原因可能是番茄红素的载入提高了脂质体膜结构的稳定性,从而降低了脂质体囊泡因温度升高而产生的聚集现象[25]。Chung等在高压均质法制备阳离子聚合物包覆脂质体的理化特性研究中发现,当均质压力高于100 MPa时,脂质体囊泡粒径无明显变化,即高压均质的微通道剪切、撞击和空穴效应所产生的脂质体分散作用降低[19]。
2.2 均质压力对脂质体物理稳定性的影响


图2 不同均质压力制备的脂质体LUMiSizer样品透光率图谱(A)及不稳定系数随时间的变化曲线(B)Fig. 2 Effect of homogenization pressure on transmittance (A) and instability coefficient (B) of liposomes in LUMiSizer
图2 A、B分别表示不同均质压力处理的脂质体经LUMiSizer快速稳定性分析仪测试的样品透光率图谱以及不稳定系数随时间的变化曲线。从图2A透光率图谱中可以看出,20 MPa和30 MPa处理后的脂质体经高速离心2 h后,样品整体的透光率均有所增大,且不稳定系数随时间的延长而显著增大,说明脂质体的物理稳定性较差。其中30 MPa处理样品离心前后的透光率变化最大,与其粒径和PDI增大的结果一致,脂质体因更容易发生聚集沉淀而导致物理稳定性降低。均质压力高于40 MPa时,脂质体样品在离心过程中的透光率几乎无明显变化,且不稳定系数的变化幅度也降低,说明脂质体粒径的降低对样品物理稳定性的提高有促进作用。虽然在2.1节中当均质压力高于50 MPa时,脂质体PDI有所提高,但样品整体物理稳定性仍保持良好,证明脂质体整体粒径与样品物理稳定性有直接关系。Guner等在研究溶剂、均质和贮藏条件对脂质体影响时发现,降低脂质体的粒径可提高其在室温条件下的贮藏稳定性[20]。
2.3 均质次数对脂质体粒度特性的影响
经不同的均质次数后脂质体的粒径、Zeta电位和PDI变化情况如图3所示。在50 MPa均质压力下,随着均质次数的增加,脂质体的平均粒径逐渐降低。当均质次数超过4 次后,脂质体的平均粒径不再显著降低,说明过多均质次数对脂质体粒度降低无明显作用。同时,均质次数对脂质体的Zeta电位和PDI均无显著影响。在保证脂质体均质效果的前提下,研究适当均质压力(50 MPa)处理条件下均质次数对脂质体粒径的影响,对降低工业化高压均质法生产脂质体的能耗具有实际指导意义。

图3 均质次数对脂质体粒径、Zeta电位(A)和PDI(B)的影响Fig. 3 Effect of homogenization cycles on vesicle sizes, zeta potential (A)and PDI (B) of liposomes
2.4 均质次数对脂质体物理稳定性的影响


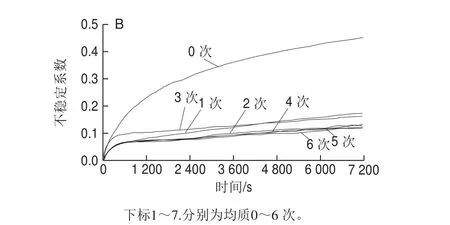
图4 不同均质次数制备的脂质体LUMiSizer样品透光率图谱(A)及不稳定系数随时间的变化曲线(B)Fig. 4 Effect of homogenization cycles on transmittance (A) and instability coefficient (B) of liposomes in LUMiSizer
由图4可知,在考察不同均质次数处理后脂质体的物理稳定性时发现,无高压均质处理的脂质体,其在高速离心下的物理稳定性极差,当经过高压均质处理后,脂质体的物理稳定性显著提高。但在50 MPa均质压力下,经不同均质次数形成的脂质体,LUMiSizer图谱中样品各处的透光率无显著变化,说明提高均质次数对脂质体的物理稳定性无显著影响,与PDI无显著性差异的结果相一致。综合不同均质压力的实验结果,当高压均质形成脂质体的粒径低于150 nm时,脂质体样品在离心过程中的物理稳定性均无明显差异。
2.5 m(大豆卵磷脂)∶m(胆固醇)对脂质体粒度特性的影响

图5 大豆卵磷脂与胆固醇质量比对脂质体粒径、Zeta电位(A)和PDI(B)的影响Fig. 5 Effect of soybean lecithin/cholesterol ratio on vesicle sizes, zeta potential (A) and PDI (B) of liposomes
由图5中可知,随着大豆卵磷脂与胆固醇质量比的提高,可导致脂质体粒径的显著减小,主要是由于胆固醇的载入占据了脂质体磷脂膜中的空间,使磷脂膜厚度增大,从而影响了脂质体整体粒径的大小,这与Abe等的研究结果保持一致[26]。Zeta电位绝对值随着大豆卵磷脂与胆固醇质量比的降低而增大,可能是脂质体膜中胆固醇相对含量的提高使带电磷脂在脂质体膜表面暴露程度提高,从而使脂质体表面的负电荷增多。范明辉等在研究红景天苷脂质体时将这一现象归因于胆固醇的极性头部在脂质体膜表面易与胆碱结合,将胆碱基团拉向膜内,从而增强膜表面的负电效应[27]。还有研究认为,由于胆固醇的载入使磷脂分子极性头部间的距离增大,减少了脂质体膜表面的单位面积结合位点,降低了反离子与其结合的可能性,从而使脂质体膜表面的负电荷特性增强[28]。随着胆固醇相对含量的提高,脂质体的PDI却无显著变化,说明胆固醇的乳化特性对脂质体的稳定性有促进作用。
2.6 m(大豆卵磷脂)∶m(胆固醇)对脂质体物理稳定性的影响


图6 不同大豆卵磷脂与胆固醇质量比的脂质体LUMiSizer样品透光率图谱(A)及不稳定系数随时间的变化曲线(B)Fig. 6 Effect of soybean lecithin/cholesterol ratio on transmittance (A)and instability coefficient (B) of liposomes in LUMiSizer
由图6可知,m(大豆卵磷脂)∶m(胆固醇)=2∶1脂质体的物理稳定性最差,说明过多胆固醇的载入不利于高压均质后脂质体物理稳定性的提高。从不稳定系数曲线中可以发现,当m(大豆卵磷脂)∶m(胆固醇)从10∶1降低至3∶1时,曲线变化的斜率逐渐降低,说明适当提高磷脂膜中胆固醇的相对含量对高压均质脂质体物理稳定性的提高有促进作用。
2.7 m(大豆卵磷脂)∶m(胆固醇)对脂质体膜特性的影响

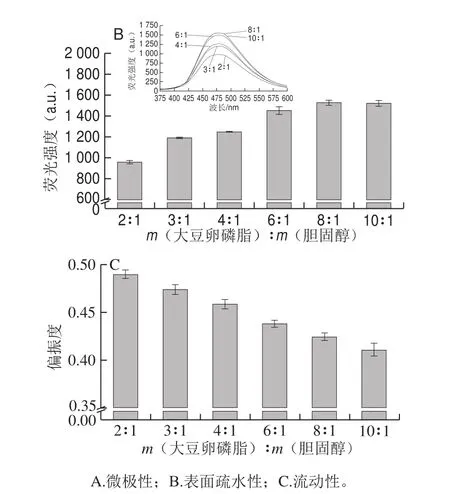
图7 m(大豆卵磷脂)∶m(胆固醇)对脂质体膜特性的影响Fig. 7 Effect of soybean lecithin/cholesterol ratio on membrane characteristics of liposomes
芘作为一种易进入磷脂双分子层中的脂溶性荧光探针,可被用来研究脂质体膜内的微极性环境。由于脂质体膜是由磷脂分子通过疏水相互作用自发形成的分子有序组合体,其主要驱动力是尽可能减少磷脂疏水性尾部与水相环境的接触。当磷脂膜结构越致密时,内部疏水性越高,载入其中的芘探针周围环境的微极性越低。由图7A可知,随着m(大豆卵磷脂)∶m(胆固醇)降低,芘探针荧光峰I1/I3总体逐渐降低,说明脂质体膜内微极性逐渐降低,膜结构紧密性有所提高。当m(大豆卵磷脂)∶m(胆固醇)=10∶1~6∶1时,胆固醇含量提高使芘的微极性有所增大,可能是少量胆固醇的载入对脂质体膜结构紧密性产生不利影响,随着胆固醇含量的继续提高,膜结构因胆固醇的骨架效应,分子间排列紧密性显著提高。
ANS在水相环境中几乎无荧光强度,与磷脂膜结合后,其荧光强度显著增强。由于ANS只吸附于脂质体膜和水相环境的交界面,与磷脂膜表面暴露的疏水区域结合,可间接反映脂质体膜表面的结构变化。由图7B可知,随着m(大豆卵磷脂)∶m(胆固醇)的降低,ANS的荧光强度逐渐降低,说明脂质体膜上可与ANS结合的疏水区域逐渐减少,磷脂极性头部所组成的膜表面结构稳定性有所提高。
DPH作为一种疏水性极强的荧光探针,因其结构近似杆状,可与磷脂分子在膜中平行排列,可用来研究脂质体磷脂膜的流动性。当DPH因磷脂膜的流动性产生不同程度的倾斜时,经荧光激发可产生水平和垂直方向不同的偏振分量,并通过计算从而反映脂质体膜的流动性。由图7C可知,随着m(大豆卵磷脂)∶m(胆固醇)的降低,荧光偏振度逐渐增大,说明DPH在磷脂膜内的运动逐渐受到限制,脂质体磷脂膜的流动性逐渐降低。通过上述3 种荧光探针对脂质体磷脂膜不同区域的荧光标记分析可知,胆固醇载入量的增大提高了经高压均质形成的脂质体膜结构的稳定性,对物理稳定性的提高有促进作用。综合脂质体粒度特性和物理稳定性结果,当m(大豆卵磷脂)∶m(胆固醇)=3∶1时,经高压均质(50 MPa均质3 次)的空载脂质体的稳定性最好,且由于其稳定的囊泡结构,在包埋功能活性物质上具有良好的潜质。
2.8 不同m(大豆卵磷脂)∶m(胆固醇)脂质体微观结构观察

图8 不同大豆卵磷脂与胆固醇质量比的脂质体透射电子显微镜微观形貌Fig. 8 Transmission electron micrographs of liposomes with different soybean lecithin/cholesterol mass ratios
由图8可以看出,不同m(大豆卵磷脂)∶m(胆固醇)的脂质体均呈规则球形囊泡结构,说明高压均质法对含胆固醇脂质体样品的制备具有良好效果。随着m(大豆卵磷脂)∶m(胆固醇)的降低,脂质体囊泡变大,与平均粒径的变化结果相一致。
3 结 论
通过高压均质法对传统薄膜水化法形成的粗脂质体混悬液进行均质处理,增加均质压力和均质次数可显著降低脂质体囊泡的粒径并提高脂质体的离心物理稳定性,但均质压力和均质次数分别高于50 MPa和3 次后,脂质体囊泡粒度的降低以及其物理稳定性的提高效果不再显著,甚至当均质压力大于50 MPa时,PDI有所增大,说明脂质体囊泡的均匀性变差。胆固醇的载入可提高脂质体膜微结构的稳定性,但脂质体粒径随着胆固醇载入量的提高而显著增大。当m(大豆卵磷脂)∶m(胆固醇)=2∶1时,脂质体的离心物理稳定性最差,说明在高压均质过程中,过高胆固醇的载入不利于脂质体离心物理稳定性的提高,而适量胆固醇的载入对其物理稳定性无显著影响,所形成的脂质体均呈球形囊泡结构。综上所述,m(大豆卵磷脂)∶m(胆固醇)=3∶1对未来利用高压均质法制备包埋有活性物质的脂质体在提高样品稳定性上有一定的参考价值。

