柠檬醛对副溶血性弧菌的抑制作用
郭 都,孙慧慧,孙 正,孙 怡,夏效东,石 超*
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
副溶血性弧菌是一种嗜盐的革兰氏阴性菌,最适宜生长在含盐量为2%~4%的环境中,因此主要存在于江河湖海、海底沉积物、各类海产品及盐渍食品中[1-2]。该菌在天然水产品中有很高的携带率,在温暖的季节尤其是夏季检出率可以高达90%[3]。近几年来,随着人们生活水平的提高以及对海鲜食品喜爱程度的增加,海鲜空运越来越普遍,水产品消费量大幅上升,副溶血性弧菌引发的食物中毒事件也呈现逐年增加的态势[4]。食用被副溶血性弧菌污染的生的或未煮熟的海鲜,尤其是贝类,可能会导致以腹泻、头痛、呕吐、恶心、腹痛、低热为主要症状的急性胃肠炎等疾病[5]。因此,有效预防和控制副溶血性弧菌对于保障公众健康具有重要意义。
为降低海产品中副溶血性弧菌污染的风险,目前采取的主要控制措施包括物理保鲜、化学防腐剂保鲜以及生物保鲜等技术[6-8]。物理保鲜技术如辐照杀菌和超高压杀菌虽然能够很大程度地保留食品的营养和香味,但是因其对技术及工厂安全防护措施方面的要求较高,导致实际应用成本较高[9];化学防腐剂虽然具有良好的抑菌效果,但易使菌体产生耐受性,且有可能改变食品的自然风味和质构,往往具有潜在毒性,不易被消费者接受[10]。因此,寻求安全、有效的控制海产品中副溶血性弧菌的方法具有重要意义。
近年来,植物源活性物质因具有天然、安全和营养等优点而受到广泛关注,越来越多的研究者将目光投向天然的植物源活性物质,研究其抑制食源性致病菌的功效[11-12]。植物源活性物质是植物中天然存在的一大类化合物,广泛分布于水果、蔬菜、豆类、坚果等植物中,赋予植物颜色、味道以及香气,并且可以保护植物体免受自由基、病毒、细菌以及真菌的影响[13]。柠檬醛(C10H16O)是柠檬草油的主要成分,已被欧盟委员会承认可作为食品中的调味成分(EU 872/2012),且被美国食品药品管理局批准应用,被公认为是安全的成分(GRAS 182.60)。研究表明,柠檬醛可通过损伤线粒体对黄曲霉、指状青霉等真菌的细胞形态造成破坏[14-16]。对于一些致病细菌来说,柠檬醛也表现出一定的抑菌活性,如柠檬醛对硫酸盐还原菌[17]、金黄色葡萄球菌、蜡样芽孢杆菌、单增李斯特菌[18]以及阪崎克罗诺肠杆菌[19]均具有一定的抑制作用。除此之外,研究表明柠檬醛还具有杀虫驱虫、抗炎和抗氧化等多种生物活性[20-22]。但目前柠檬醛对副溶血性弧菌的抑制作用及抑菌机理鲜有报道。
本研究以副溶血性弧菌为研究对象,从7 种植物源活性物质中筛选出对副溶血性弧菌抑菌效果较好的物质,探究其对副溶血性弧菌的抑菌作用,并从其对细胞膜功能及通透性影响的角度研究其抑菌机理,旨在为柠檬醛作为一种植物源抑菌剂控制副溶血性弧菌提供理论依据。
1 材料与方法
1.1 材料与试剂
副溶血性弧菌(Vibrio pharahaemolyticus)标准菌株ATCC 17802和ATCC 33847购于美国模式培养物寄存库。其余副溶血性弧菌分离菌株(240、243、245、247、248、253、256和260)均由香港理工大学食物安全及科技研究中心从鲜虾中分离得到。
植物源活性物质柠檬醛、丁香酸、阿魏酸、绿原酸、硫辛酸、原儿茶酸和原儿茶醛(纯度≥98%)成都曼斯特生物科技有限公司;3%(质量分数,下同)氯化钠胰蛋白胨大豆琼脂(tryptone soya agar,TSA)、3%氯化钠胰蛋白胨大豆肉汤(tryptone soya broth,TSB)、硫代硫酸盐柠檬酸盐胆盐蔗糖琼脂(thiosulfate citrate bile salts sucrose agar,TCBS) 北京陆桥技术有限公司;DiBAC4(3)荧光探针 美国Sigma公司;ATP检测试剂盒(S0026) 碧云天生物技术有限公司;Live/Dead®BaclightTM细菌活性检测试剂盒 美国赛默飞世尔科技公司;二甲基亚砜(纯度≥99.5%) 天津市科密欧化学试剂有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
微生物全自动生长曲线分析仪 芬兰Bioscreen公司;5804R低温冷冻离心机 德国Eppendorf公司;Max M2多功能微孔板检测仪 美国Molecular Devices公司;A1激光共聚焦显微镜(laser scanning confocal microscope,LSCM) 日本Nikon公司;S-4800场发射扫描电子显微镜 日本Hitachi公司;SCIENTZ-IID超声波裂解仪 宁波新芝生物科技股份有限公司。
1.3 方法
1.3.1 菌种活化及菌悬液制备
将冻存于-80 ℃冰箱的副溶血性弧菌于3% NaCl TSA平板划线并置于37 ℃恒温培养箱培养12 h进行活化。随后挑取单菌落接种于30 mL 3% NaCl TSB中,将培养液置于37 ℃恒温摇床中培养12 h(120 r/min)。将培养后的菌悬液离心(5 000×g、4 ℃、5 min)并去除上清液,随后使用pH 7.2磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤两次。最后用PBS重悬菌体沉淀,调整菌悬液在600 nm波长处的吸光度为0.50±0.05,使菌液浓度约为108CFU/mL,备用。
1.3.2 植物源活性物质对副溶血性弧菌最小抑菌浓度的测定
植物源活性物质对副溶血性弧菌最小抑菌浓度(minimal inhibitory concentration,MIC)的测定参照欧洲临床微生物和感染病学会药敏委员会的方法[23],采用琼脂稀释法测定。首先按照1.3.1节的方法活化副溶血性弧菌并制备菌悬液。随后,将TCBS培养基煮沸溶解后冷却至45~50 ℃,将培养基加入24 孔细胞培养板中,再向其中分别加入柠檬醛、丁香酸、阿魏酸、绿原酸、硫辛酸、原儿茶酸以及原儿茶醛,使各孔植物源活性物质的终质量浓度分别为5.00、2.50、1.25、1.00、0.80、0.60、0.40、0.30、0.20、0.15、0.10、0.05 mg/mL,充分搅拌混匀。待培养基凝固后,吸取2 μL菌悬液接种至各孔中央。将样品置于37 ℃培养箱中培养24 h后观测结果,肉眼能观察到副溶血性弧菌不生长的最小质量浓度为该植物源活性物质对副溶血性弧菌的MIC。实验以不含有植物源活性物质的TCBS培养基作为阴性对照,含有0.10 mg/mL卡那霉素的TCBS培养基作为阳性对照。卡那霉素溶液使用无菌水配制,并使用0.22 µm滤膜过滤。
1.3.3 柠檬醛对副溶血性弧菌生长曲线的影响
柠檬醛对副溶血性弧菌生长曲线的影响的测定参照Shi Chao等[19]的方法。按1.3.1节的方法活化副溶血性弧菌,使用3% NaCl TSB调节菌悬液OD600nm为0.50±0.05,并稀释100 倍体积。向蜂窝板每孔中加入125 μL菌悬液(约106CFU/mL),随后每孔加入125 μL使用3% NaCl TSB溶解的柠檬醛溶液,使柠檬醛终质量浓度分别为2 MIC、MIC、1/2 MIC、1/4 MIC、1/8 MIC、1/16 MIC和1/32 MIC。实验设置不添加柠檬醛的菌悬液作为对照组(CK),同时设置3% NaCl TSB作为背景空白对照组。将样品置于微生物全自动生长曲线分析仪中,于37 ℃下每隔1 h测定24 h内各孔样品在600 nm波长处的吸光度,绘制生长曲线。
1.3.4 柠檬醛对副溶血性弧菌细胞膜电位的影响
柠檬醛对副溶血性弧菌细胞膜电位的测定参照Li Guanghui等[24]的方法进行,将1.3.1节所得菌悬液加入96 孔板中,置于37 ℃恒温培养箱中培养30 min。再向每孔中加入0.5 μL 1 μmol/L DiBAC4(3)荧光染料并使染料均匀地分布于菌悬液中,置于37 ℃孵育30 min。随后向对应样品孔中添加柠檬醛溶液,使柠檬醛的终质量浓度依次为0(CK)、MIC(0.1 mg/mL)和2 MIC(0.2 mg/mL),处理5 min后,使用多功能酶标仪检测各孔样品的荧光强度:设置多功能酶标仪激发和发射波长分别为492 nm和515 nm,激发和发射缝隙宽度分别为3 nm和5 nm。以相对荧光强度反映膜电位的变化。
1.3.5 柠檬醛对副溶血性弧菌胞内ATP浓度的影响
按照1.3.1节的方法活化菌种并制备菌悬液,向离心管中加入2 mL菌悬液,并添加不同质量浓度的柠檬醛溶液,使柠檬醛终质量浓度为0(CK)、MIC(0.1 mg/mL)和2 MIC(0.2 mg/mL)。将样品置于37 ℃培养箱中培养30 min。随后将样品置于冰上,对样品进行超声破碎处理,裂解菌体细胞以检测副溶血性弧菌胞内ATP浓度[25]。每个样品超声结束后立即将其置于100 ℃下处理2~3 min,使样品中ATP酶灭活。将样品离心(5 000×g、5 min),取上清液,按照ATP检测试剂盒说明书检测各样品的ATP浓度。
1.3.6 柠檬醛对副溶血性弧菌细胞膜完整性的影响
副溶血性弧菌细胞膜完整性的测定参照Shi Chao等[26]的方法,使用Live/Dead®Baclight细菌活性检测试剂盒进行检测。首先按照1.3.1节方法制备菌悬液,随后使用体积分数70%异丙醇溶液分别制备活菌、死菌溶液。取活菌溶液并添加柠檬醛溶液,使柠檬醛质量浓度分别为0(CK)、MIC(0.1 mg/mL)和2 MIC(0.2 mg/mL),并在37 ℃下孵育30 min。随后,离心(10 000×g、4 ℃、1 min)去除上清液,加入相同体积的质量分数0.85% NaCl溶液,重悬菌体得到处理组样品。同时设置标准曲线组和背景空白对照组(不含副溶血性弧菌的对应质量浓度柠檬醛-PBS溶液),按照不同比例将活菌和死菌溶液混合,得到活菌比例分别为0%、10%、50%、90%和100%的标准曲线组样品。向96 孔黑色酶标板中依次加入100 μL样品组、标准曲线组以及背景空白对照组。随后,向每孔加入100 μL 2× SYTO 9/PI染料,充分混匀,将样品置于25 ℃下避光孵育10 min。最后使用多功能酶标仪检测荧光强度,SYTO 9染料的激发、发射波长分别为485、542 nm,PI染料的激发、发射波长分别为485、610 nm。
LSCM观察:菌液制备同1.3.1节方法,使用0.85% NaCl溶液调节菌液浓度至OD600nm为0.5。添加柠檬醛于各组菌液中,使柠檬醛质量浓度为0、MIC(0.1 mg/mL)和2 MIC(0.2 mg/mL),在37 ℃下培养30 min。随后离心(10 000×g、1 min、4 ℃)去除上清液,加入相同体积的0.85% NaCl溶液,摇匀、重悬,得到处理组样液。将SYTO 9和PI等量混合配制混合荧光染料,取3 µL混合染料加入1 mL菌液中,轻柔混匀,于暗处孵育10 min。取3~5 µL样品滴于载玻片上,盖上盖玻片,调节LSCM于800 倍下观测荧光强度并拍照。
1.3.7 柠檬醛对副溶血性弧菌细胞形态的影响
参照Li Guanghui等[27]的方法,利用场发射扫描电子显微镜观察柠檬醛对副溶血性弧菌细胞形态的影响。按照1.3.1节中的方法制备菌悬液,随后加入柠檬醛使得柠檬醛质量浓度分别为0、MIC(0.1 mg/mL)、2 MIC(0.2 mg/mL)和4 MIC(0.4 mg/mL),并置于37 ℃培养箱中分别培养2 h和4 h。在对应的时间点取出样品进行离心(5 000×g、10 min、4 ℃),弃去上清液,使用PBS洗涤菌体两次,并将菌体重新悬浮于2.5%戊二醛-PBS溶液中固定12 h。依次使用PBS、无菌水洗涤菌体,并将菌体置于体积分数1%锇酸溶液中固定5 h,随后使用不同体积分数的乙醇溶液(30%、50%、70%、80%、90%和100%)进行梯度洗脱,每次10 min。最后使用少量无水乙醇将菌体重悬浮,并将样品滴加至专用圆形小玻片并贴附于场发射扫描电子显微镜载物台,真空干燥2 h后喷金处理,于20 000 倍下观察细菌细胞形态并拍照。
1.4 数据统计与分析
数据以平均值±标准差表示,使用SPSS软件对数据进行统计分析,显著性检验采用单因素方差分析,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 植物源活性物质对副溶血性弧菌的MIC
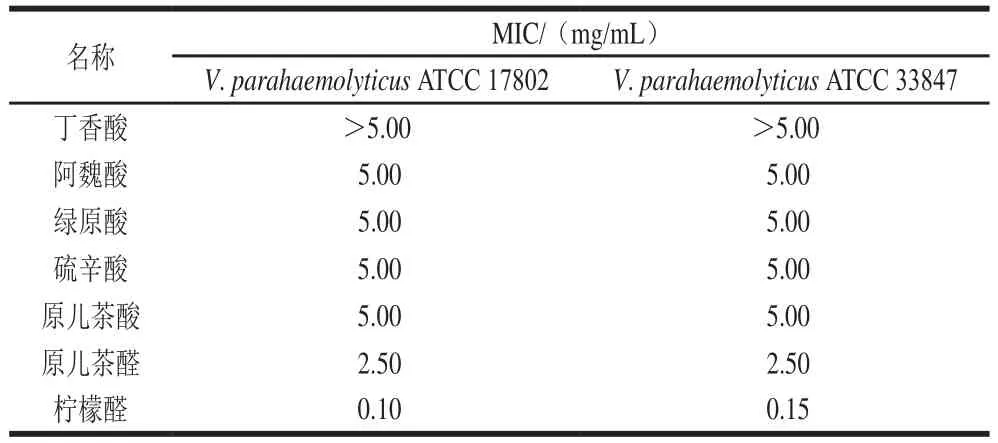
表1 7 种植物活性物质对两种副溶血性弧菌标准菌株的MICTable 1 MICs of 7 plant extracts against two standard strains of V. parahaemolyticus
如表1所示,所测7 种植物源活性物质均能有效抑制两种副溶血性弧菌标准菌株,其中柠檬醛的抑制效果较为突出。丁香酸对两株副溶血性弧菌标准菌株ATCC 17802和ATCC 33847的MIC均大于5.00 mg/mL;阿魏酸、绿原酸和硫辛酸对副溶血性弧菌的MIC为5.00 mg/mL;原儿茶醛与原儿茶酸虽然具有相似的化学结构,但二者对副溶血性弧菌的MIC相差较大,原儿茶酸对副溶血性弧菌的MIC为5.00 mg/mL,而原儿茶醛对副溶血性弧菌的MIC为2.50 mg/mL;柠檬醛对副溶血性弧菌ATCC 17802和ATCC 33847的MIC分别为0.10 mg/mL和0.15 mg/mL。由此可见,柠檬醛对副溶血性弧菌具有良好的抑制作用,因此,选择柠檬醛进行后续研究,并测定其对从水产品中分离的8 株分离菌的MIC。
2.2 柠檬醛对8 株副溶血性弧菌分离菌株的MIC
为验证柠檬醛对副溶血性弧菌抑制作用的广泛性,实验选取了8 株来源于新鲜水产品的副溶血性弧菌分离菌株,分别编号240、243、245、247、248、253、256和260。如表2所示,柠檬醛对8 株副溶血性弧菌分离菌株的MIC在0.30~0.60 mg/mL范围内,即该8 株副溶血性弧菌分离菌株均能被柠檬醛有效抑制。

表2 柠檬醛对8 株副溶血性弧菌分离菌株的MICTable 2 MICs of citral against eight V. parahaemolyticus strains
2.3 柠檬醛对副溶血性弧菌生长曲线的影响
图1为柠檬醛对两株副溶血性弧菌标准菌株生长曲线的影响。结果表明,当质量浓度为MIC时,柠檬醛对两株副溶血性弧菌的抑制作用均表现为延长其生长延滞期、降低其最大生长速率。当柠檬醛质量浓度为1/2 MIC及以下时,在24 h内,柠檬醛对副溶血性弧菌的生长曲线几乎没有影响。

图1 副溶血性弧菌ATCC 17802(A)、ATCC 33847(B)在含有不同质量浓度柠檬醛的3% NaCl TSB中的生长曲线Fig. 1 Growth curves of V. parahaemolyticus ATCC 17802 (A) and ATCC 33847 (B) cultured in 3% NaCl TSB with various concentrations of citral
2.4 柠檬醛对副溶血性弧菌胞内ATP浓度的影响

图2 柠檬醛对副溶血性弧菌ATCC 17802胞内ATP浓度的影响Fig. 2 Effect of citral on intracellular ATP concentration of V. parahaemolyticus ATCC 17802
实验结果表明,细菌胞内ATP浓度(x)与相对荧光强度(y)具有良好的线性关系(y=376 201x+194 055,R2=0.983 2),因此,可以根据标准曲线计算各组样品中胞内ATP的浓度。由图2可知,柠檬醛对副溶血性弧菌ATCC 17802胞内ATP浓度有极显著的降低作用(P<0.01)。未经柠檬醛处理的副溶血性弧菌胞内ATP浓度为(1.963±0.072)µmol/L,经质量浓度为MIC的柠檬醛处理后,副溶血性弧菌胞内ATP浓度降为(0.097±0.003)µmol/L;而经2 MIC柠檬醛处理后,胞内ATP浓度降至检出限(0.010 μmol/L)以下。
2.5 柠檬醛对副溶血性弧菌细胞膜电位的影响
DiBAC4(3)是一种对细胞膜电位敏感的亲脂性阴离子荧光染料,通常被用作细胞膜电位的指示染料。当细胞发生去极化时,染料进入细胞后发出的荧光由于键合激活而增强[28]。如图3所示,经柠檬醛处理后,副溶血性弧菌ATCC 17802细胞膜电位有极显著的改变(P<0.01)。经MIC柠檬醛处理后,细菌细胞膜电位出现去极化;经2 MIC柠檬醛处理后,细菌细胞膜电位出现更显著的去极化,呈现质量浓度依赖性。

图3 柠檬醛对副溶血性弧菌ATCC 17802细胞膜电位的影响Fig. 3 Effect of citral on membrane potential of V. parahaemolyticus ATCC 17802
2.6 柠檬醛对副溶血性弧菌细胞膜完整性的影响
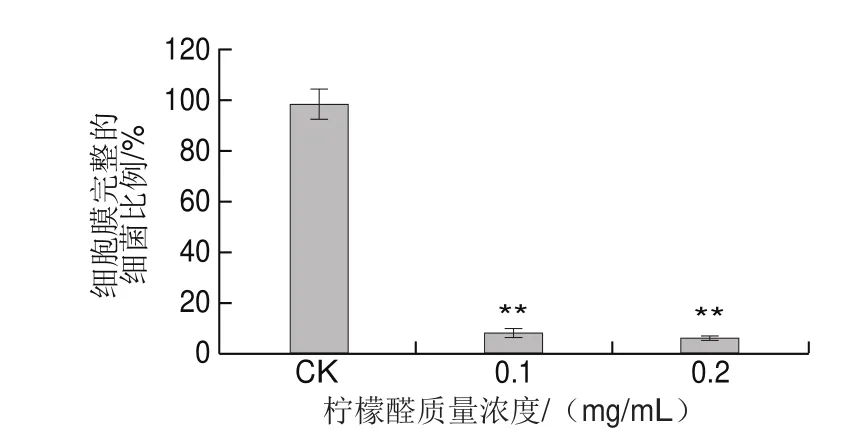
图4 柠檬醛对副溶血性弧菌ATCC 17802细胞膜完整性的影响Fig. 4 Effect of citral on membrane integrity of V. parahaemolyticus ATCC 17802
Live/Dead®BaclightTM细菌活性检测试剂盒已被广泛用于检测细胞膜完整性的定性和定量研究,PI和SYTO 9是其中的两种核酸染料。SYTO 9是一种绿色荧光小分子染料,它能够穿透完整的细胞膜;PI为红色荧光大分子染料,仅能穿过不完整的细胞膜,可用于识别细胞膜受损的菌体[29]。实验通过检测不同活细菌比例标准样品的绿色荧光强度与红色荧光强度的比值,建立绿色荧光强度与红色荧光强度的比值和细胞膜完整的细菌比例之间的线性关系,实验结果表明,绿色荧光强度与红色荧光强度的比值和细胞膜完整的细菌比例有着良好的线性关系(y=0.845 5x+0.440 5,R2=0.999),可以根据标准曲线计算各样品中细胞膜完整的细菌比例。由图4可知,与CK组相比,柠檬醛对副溶血性弧菌ATCC 17802细胞膜的完整性具有极显著的破坏作用(P<0.01),经MIC柠檬醛处理后,副溶血性弧菌细胞膜完整性降低为CK组的(9.34±1.70)%,经2 MIC柠檬醛处理后,副溶血性弧菌细胞膜完整性降低至CK组的(7.43±0.57)%。
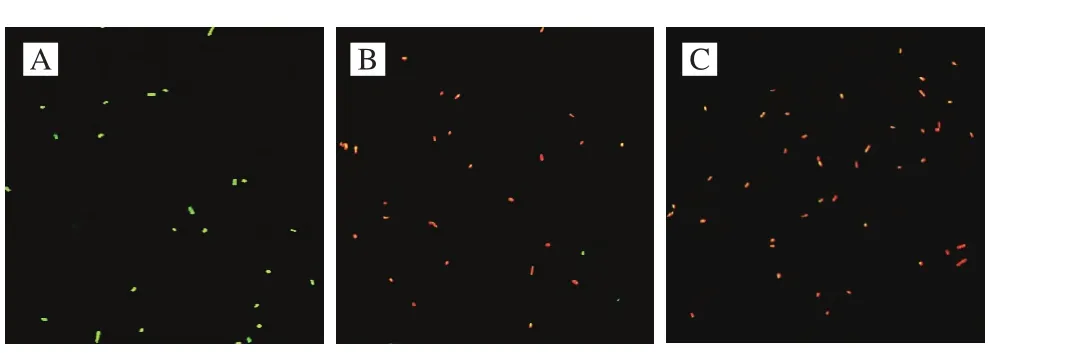
图5 LSCM观察未经柠檬醛处理(A)及经质量浓度MIC(B)和2 MIC(C)柠檬醛处理后副溶血性弧菌ATCC 17802细胞膜完整性(800×)Fig. 5 Membrane integrity of V. parahaemolyticus ATCC 17802 without (A) and with citral treatment at MIC (B) and 2 MIC (C)examined by LSCM (800 ×)
如图5所示,经MIC柠檬醛处理后的副溶血性弧菌(图5B)绝大多数发出红色荧光,而经2 MIC柠檬醛处理后(图5C),视野内菌体几乎全部呈现红色荧光,细胞膜完整的副溶血性弧菌数量几乎降为零。综上所述,一定质量浓度范围的柠檬醛可明显破坏副溶血性弧菌细胞膜完整性。
2.7 柠檬醛对副溶血性弧菌细胞形态的影响

图6 扫描电子显微镜观察柠檬醛对副溶血性弧菌ATCC 17802细胞形态的影响(20 000×)Fig. 6 Cell morphology of V. parahaemolyticus ATCC 17802 with and without citral treatment examined by field emission scanning electron microscope (20 000 ×)
图6表明,未经柠檬醛处理的副溶血性弧菌(图6A、B)呈杆状,形态饱满、胞体光滑。经质量浓度为MIC的柠檬醛处理2 h及4 h后,部分细菌出现表面塌陷,菌体变形(图6C1、D1)。经2 MIC柠檬醛处理2 h及4 h后,细菌细胞表面出现严重的皱缩和塌陷,部分细菌干瘪并丧失了原本的杆状形态(图6C2、D2)。经4 MIC柠檬醛处理2 h及4 h后,细菌变形程度更大,皱缩程度更加严重(图6C3、D3)。在同一质量浓度下,柠檬醛处理4 h的细菌形态的变形程度显著高于处理2 h的菌体。综上所述,柠檬醛对副溶血性弧菌细胞形态的破坏程度随其质量浓度升高及作用时间延长而增加。
3 讨 论
食源性疾病已经逐渐成为全球范围内最严重的公共健康问题,其引起的感染对于各国人民的公共卫生及健康都造成了巨大的危害[30],其中副溶血性弧菌广泛存在于海产品中,是许多沿海国家的首要致病菌。在我国,由副溶血性弧菌引起的食物中毒发生率已经持续几年位居首位[31]。抗生素的滥用导致耐药菌株不断出现[32],随着生活水平的提高,消费者对于食品的安全性提出了更高的要求。因此,寻求安全、高效而又不易导致耐药的植物源天然抑菌剂已经成为研究热点。柠檬醛是多种水果、蔬菜及中草药中的活性成分,并且已被证明具有一定的抑菌活性[17-19],然而,柠檬醛对副溶血性弧菌的抑制作用及机理鲜有报道。
本实验以副溶血性弧菌标准菌株ATCC 17802和ATCC 33847为研究对象,测定了7 种植物源活性物质的MIC,相对于阿魏酸、硫辛酸等物质,柠檬醛具有更低的MIC。一些研究也报道了天然物质对副溶血性弧菌的有抑制效果,如Xie Ting等[33]得出壳聚糖对副溶血性弧菌的MIC为1.25 mg/mL的结论;Xu Defeng等[34]利用琼脂稀释法测定了一种来源于枯草芽孢杆菌的新型抗菌肽AMPNT-6对副溶血性弧菌的MIC,结果表明,其对副溶血性弧菌的MIC为1.25 mg/mL。相比于以上学者的研究,本研究结果表明柠檬醛对副溶血性弧菌具有良好的抑制作用。另外,本实验还发现柠檬醛对8 株副溶血性弧菌分离菌株也具有良好的抑菌效果,证明柠檬醛对副溶血性弧菌具有广泛的抗菌作用。
ATP是细菌重要的能量分子,在多种生理过程中起着重要作用,抑菌物质可以通过影响胞内ATP浓度发挥抑菌作用。本研究结果表明柠檬醛对副溶血性弧菌胞内ATP浓度有极显著的降低作用(P<0.01)。Turgis等[35]发现,芥末精油可使大肠杆菌O157:H7和伤寒沙门氏菌胞内ATP浓度降低。胞内ATP浓度的降低可能是由于质子泵水解ATP速率增大,导致ATP快速消耗或是细胞膜通透性改变,使胞内ATP通过细胞膜泄漏造成的[36]。因此,在本研究中,副溶血性弧菌胞内ATP浓度的降低说明柠檬醛可能是通过影响细菌细胞代谢功能或细胞膜通透性,从而起到抑制副溶血性弧菌生长的作用。
细胞在静息状态下存在于细胞膜两侧的电位差称为膜电位,正常的膜电位对细胞存活和必需营养物质的运输是必不可少的[37]。本研究结果表明,柠檬醛能够改变副溶血性弧菌的膜电位,且发生显著的去极化。类似研究表明,绿原酸使痢疾志贺氏菌、肺炎链球菌细胞膜发生去极化[38]。然而,本团队前期研究表明,柠檬醛和百里醌可使阪崎克罗诺肠杆菌细胞膜发生超极化[19,25]。Bot等[39]曾提出,细胞膜电位发生超极化或去极化是由于pH值改变或细胞膜通透性改变后K+为保持细胞内外电位均衡而导致的。因此,推测柠檬醛作用于细菌后,改变了细菌细胞膜的通透性,进而改变了细胞膜电位,从而达到抑制副溶血性弧菌的效果。
为验证上述推测,本实验探究了柠檬醛对副溶血性弧菌细胞膜完整性的影响,结果表明,柠檬醛显著降低了副溶血性弧菌细胞膜的完整性。类似地,Diao Wenrui等[11]发现质量浓度为2 MIC(0.25 mg/mL)的茴香精油可破坏志贺氏菌细胞膜完整性。Shi Chao等[19]发现质量浓度为2 MIC(1.08 mg/mL)的柠檬醛使阪崎肠杆菌细胞膜完整的细菌比例显著降低至对照组的15%(P<0.05)。细胞膜的完整性是菌体正常生长代谢的重要条件。细胞膜完整性被破坏后,可能会导致一些重要细胞组分如蛋白质、核酸和糖类物质流出,从而影响菌体的正常生长代谢[40]。利用场发射扫描电子显微镜观察柠檬醛对副溶血性弧菌细胞形态的影响。结果表明,柠檬醛可使副溶血性弧菌细胞膜皱缩,菌体表面凹陷。类似地,蓝蔚青等[41]发现经壳聚糖、茶多酚和溶菌酶复合保鲜剂处理后,金黄色葡萄球菌菌体发生扭曲变形、干瘪破裂的现象。张赟彬等[42]观察到肉桂醛可使金黄色葡萄球菌失去圆滑的球状形态,使大肠杆菌菌体细胞凹陷、胞膜表面褶皱,但未使菌体溶解破裂。
综上所述,柠檬醛能够显著改变副溶血性弧菌的细胞膜电位,使其出现去极化;通过降低细菌胞内ATP浓度、细胞膜完整性以及破坏细菌原有光滑饱满的细胞形态而使其正常的生理功能紊乱,从而达到抑制副溶血性弧菌生长的目的。本研究结果为柠檬醛作为天然抑菌物质应用于食品中控制副溶血性弧菌提供了理论依据。结合本研究结果以及现有应用基础,柠檬醛有潜力作为新型天然抗菌物质应用到食品工业中控制副溶血性弧菌。然而,柠檬醛对于食品感官品质的影响及在食品中的应用效果及潜力需要在实际应用前进一步探讨。

