链霉菌JD211所产活性物质对水稻种子萌发及叶片防御反应的影响
李张 徐志荣 汪青松
摘要:为了研究链霉菌JD211所产活性物质对水稻种子萌发及叶片抗性酶活性的影响,用不同比例的JD211固体发酵物浸提液处理水稻种子和根系,测定种子发芽率、可溶性糖含量、蛋白质含量、根系活力以及叶片抗性酶活性的变化。结果表明,用适宜比例的JD211浸提液处理种子,种子发芽率、蛋白质含量及根系活力高于对照,用稀释比例为 1 ∶ 2 500 JD211浸提液处理的根系活力比对照高41.5%,可溶性糖含量略低于对照;用稀释比例为1 ∶ 320的浸提液处理根系60 h后,水稻叶片中的5种抗性酶活性明显优于对照。
关键词:链霉菌JD211;活性物质;防御酶;可溶性糖;根系活力;水稻
中图分类号: S351.1;S182 文献标志码: A 文章编号:1002-1302(2019)07-0095-04
链霉菌是高等放线菌,可产生多种抗生素、植物激素等活性物质,对于提高植物的抗病、抗逆性能具有重要的作用,具有用于开发生物农药的潜力[1]。有研究发现,链霉菌可以作为根际促生菌[2],其代谢产物可以促进种子的萌发[3]。赵娟等研究发现,生防菌能够提高根系质量和根系活力[4]。
植物的抗病性表现为一系列复杂的生理生化变化,包括植物细胞内活性氧的积累与清除、抗病信号的产生与转导、防卫反应的表达与调控等。在这一系列复杂的过程中,一些相关酶类起着很重要的调控作用,如过氧化氢酶(CAT)、过氧化物酶(POD)和超氧化物歧化酶(SOD)等[5]。梁军锋等发现,用47W08、47W10、48G10、48G15、512G04、51W06、82W09等7株放线菌大都能诱导多酚氧化酶(PPO)和苯丙氨酸解氨酶(PAL)活性增加[6]。杜亞楠等发现,用农抗702浸泡水稻叶片可以提高水稻叶片的抗性酶活性[7]。
链霉菌JD211是从江西庐山珙桐植株体内分离筛选得到的,其产生的活性组分对多种植物病原真菌有较强的抑菌作用[8]。邵正英等研究发现,链霉菌JD211能够提高水稻根系超氧化物歧化酶、过氧化物酶等抗性酶活性[9]。徐志荣等用链霉菌JD211发酵液处理水稻叶片,发现能够诱导叶片过氧化氢酶活性[10]。但是链霉菌JD211所产活性物质对水稻种子萌发的影响以及用其处理根系对水稻叶片抗性酶活性影响的研究目前尚未开展。本研究采用JD211固体发酵物浸提液处理水稻种子和根系,探讨JD211所产活性物质对水稻种子萌发及叶片防御反应的影响,旨在为该生防菌在农业生产中的促生防病作用研究提供理论依据。
1 材料与方法
1.1 供试材料
供试菌株为链霉菌JD211,由江西农业大学应用微生物研究所提供。供试水稻品种为陆两优996,购自北京金色农华种业股份有限公司。供试土壤为江西农业大学生物科学与工程学院实训基地的菜园土。试验于2017年6—9月在江西农业大学生物科学与工程学院实训基地进行。土壤基本理化性质如下:有机质含量为32.58 g/kg,全氮含量为 1.756 g/kg,碱解氮含量为109.9 mg/kg,速效磷含量为 21.6 mg/kg,速效钾含量为88.5 mg/kg,pH值为6.4。
1.2 试验方法
1.2.1 固体发酵物浸提液的制备 将链霉菌JD211固体发酵物[8]、蒸馏水的体积比设为1 ∶ 1,浸提24 h,用0.22 μm滤膜过滤除菌,得到的浸提液即为JD211原液,于4 ℃保存备用。
1.2.2 链霉菌JD211对水稻种子萌发的影响 用稀释300倍的“84”消毒液对水稻种子表面消毒10~15 min,然后用无菌水冲洗3~5次,于30 ℃浸种12 h,再将种子置于铺有2层滤纸、含有10 mL不同浓度JD211的平皿中。将JD211分别稀释成原液浓度的1/2 500、1/1 250、1/1 000、1/250、1/125、1/50,以无菌水作为空白对照,另以10 μg/mL赤霉素作为阳性对照。每皿设30粒种子,3个重复。于30 ℃黑暗培养,分别在培养24、48、72 h记录各组的发芽情况(以幼芽长度达到种子长度的1/2,且幼根与种子等长为发芽标准,两者需要同时满足)。
1.2.3 链霉菌JD211对水稻种子蛋白质、可溶性糖含量及根系活力的影响 称取1 g萌发72 h的水稻种子,去根、芽、谷皮后,置于研钵中,加入pH值为5.6的柠檬酸缓冲液和石英砂,研磨成匀浆后倒入20 mL刻度管中,定容至10 mL,振荡混匀,于20 ℃放置15 min(4 min振荡1次),于3 ℃、6 000 r/min 离心10 min,取上清液备用。用考马斯亮蓝法测定可溶性蛋白含量(鲜质量含量)[11],用蒽酮法测定可溶性糖含量[12],用氯化三苯基四氮唑法(TTC)测定根系活力[13]。
1.2.4 播种与水稻培育 种子消毒后,用蒸馏水冲洗3~4次,催芽24 h,播种于装有2 kg菜园土的塑料桶中,菜园土为过20目的细土,桶内直径为23 cm,高为17 cm,每桶浇水且无明水,播种100粒,再在表面撒1层过100目的细土,洒水,将细土浸湿,微露种子。每天定时定量浇水。
1.2.5 链霉菌JD211浸泡根系对水稻抗性相关酶活性的影响 将生长至3叶1心期的水稻苗从桶中连泥一起挖出,用流水将其根系冲洗干净,然后放入含有不同浓度JD211浸提液的组培瓶中,将根全部浸没,在每个组培瓶中放入30株水稻苗,分别将JD211稀释为原液浓度的1/320、1/640、1/1 280、1/2 560,以蒸馏水作空白对照,10 μg/mL赤霉素作阳性对照,每个浓度设5个重复,每天定时定量补充溶液,于30 ℃空调房内培养,处理12、24、36、48、60 h后取样测定相关酶活性。过氧化氢酶、苯丙氨酸解氨酶活性的测定参照文献[14];过氧化物酶活性的测定采用愈创木酚法[15],以470 nm处的吸光度在1 min内变化0.01为1个酶活性单位U,单位质量叶片中的酶活性单位即为U/g;多酚氧化酶活性在 398 nm 处测定[16];超氧化物歧化酶活性的测定采用氮蓝四唑法[17]。
1.2.6 数据统计及分析方法 采用WPS 2017进行数据处理,用DPS 8.0进行统计分析。
2 结果与分析
2.1 链霉菌JD211浸提液对水稻种子萌发的影响
由表1可见,催芽24 h后,原液浓度1/1 250处理组水稻种子的发芽率明显高于其他组。在培养24~48 h,原液浓度 1/1 000 的处理组的发芽率提高了57.77百分点,培养72 h后比空白对照组提高了11.11百分点。培养72 h时,原液浓度1/1 250、1/1 000、1/250处理组的发芽率分别比空白对照组提高了1.11、11.11、2.22百分点;低浓度(原液浓度的 1/2 500、1/1 250)JD211处理组的发芽率与空白对照组差异不明显,中等浓度(原液浓度的1/1 000、1/250)JD211处理组的发芽率明显高于空白对照组,甚至超过赤霉素处理组;高浓度(原液浓度的1/125、1/50)JD211处理组的发芽率明显低于空白对照组。
2.2 链霉菌JD211浸提液对种子可溶性糖、蛋白质含量及根系活力的影响
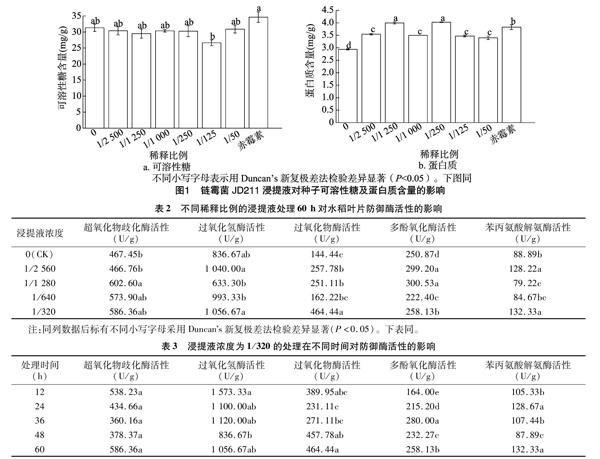
由图1可知, 经过各个稀释比例浸提液处理的种子可溶性糖含量无明显差异,且比空白对照略低。赤霉素处理组的可溶性糖含量高于其他处理组。处理组的蛋白质含量有了显著的提高,都高于空白对照组,高出幅度为15.7%~37.1%,其中浸提液浓度的1/1 250、1/250这2个处理的蛋白质含量分别为3.99、4.03 mg/g,分别比赤霉素处理的高4.4%、5.1%。
由图2可知,链霉菌JD211浸提液浓度1/2 500、1/1 250、1/1 000、1/250、1/50处理组的根系活力分别为447、363、383、331、412 mg/(g·h),分别比空白对照组的根系活力[316 mg/(g·h)]高41.5%、14.9%、21.2%、4.7%、30.4%。浸提液濃度1/2 500处理组的根系活力比赤霉素处理组高 6.68%。结果说明,JD211浸提液对根系活力有明显的促进作用。
2.3 链霉菌JD211浸提液处理根系对水稻叶片抗性酶活性的影响
以不同稀释比例的链霉菌JD211浸提液浸泡根系60 h,由表2可以看出,浸提液浓度 1/320 处理的5种防御酶活性都高于对照组,且过氧化氢酶、过氧化物酶及苯丙氨酸解氨酶活性都是各个处理组中最高的。因此,用1/320 JD211浸提液处理水稻根系,进一步研究不同处理时间对防御酶活性的影响。
2.3.1 不同JD211浸提液处理浓度对水稻叶片防御酶活性的影响 由表2可知,JD211浸提液浓度1/1 280处理的叶片超氧化物歧化酶活性显著高于对照组,JD211浸提液浓度 1/1 280、1/640、1/320处理的超氧化物歧化酶活性分别比对照组高28.9%、22.8%、25.4%;过氧化氢酶活性以JD211浸提液浓度1/320处理最佳,为 1 056.67 U/g,比对照高26.3%;试验组过氧化物酶活性均高于对照组,JD211浸提液浓度为1/2 560、1/1 280、1/320处理的过氧化物酶活性分别比对照组高78.5%、73.9%、221.5%;JD211浸提液浓度 1/2 560、1/1 280处理的多酚氧化酶活性优于低稀释比例处理及对照,且各个稀释比例处理与对照组间有显著差异;苯丙氨酸解氨酶活性最佳的处理为JD211浸提液浓度的1/320处理,比CK高48.9%。
2.3.2 不同JD211浸提液处理时间对水稻叶片防御酶活性的影响 由表3可以看出,超氧化物歧化酶、过氧化物酶活性都随时间的增加出现先降后升的趋势,在处理60 h时酶活性最高,分别为586.36、464.44 U/g,在48~60 h超氧化物歧化酶活性相比其他时间段上升幅度更大。从整体上看,过氧化物酶活性主要在处理的后期发挥作用;过氧化氢酶活性在处理12 h时最大,为1 573.33 U/g,在12~24 h CAT活性快速下降,在其他时间段的活性变化较小;多酚氧化酶活性的变化趋势为先升后降再升,在12~24 h PPO活性大幅度上升,在36 h时达到峰值,且各时间段间的多酚氧化酶活性差异显著(P<0.05);苯丙氨酸解氨酶活性在60 h达到最大值,在 48~60 h期间,PAL活性出现大幅度的增加,趋势远大于其他时间段。
3 结论与讨论
本研究结果表明,适宜浓度的链霉菌JD211浸提液能够提高水稻种子的发芽率,效果甚至比赤霉素处理的更佳。在适宜浓度的链霉菌JD211浸提液处理下,种子中的蛋白质含量、根系活力都有所提高,而可溶性糖含量略有下降;用适宜浓度的链霉菌JD211浸提液处理水稻根系,叶片过氧化物酶、多酚氧化酶、苯丙氨酸解氨酶、过氧化氢酶和超氧化物歧化酶活性有明显提高。由此可见,链霉菌JD211的分泌代谢产物可以促进种子萌发,这与靳振江等的研究结果[3]一致,而发芽率对不同浓度的JD211浸提液处理表现出“低促高抑”,可能是由于高浓度的浸提液破坏了其中的抗氧化机制[18]。白永富等发现,在种子萌发过程中,酶将贮藏在种子内的物质分解成游离的氨基酸,再合成新的蛋白质用于新细胞建成,在这个过程中,随着储藏蛋白质的降解,可溶性蛋白含量也随之增加[19]。有研究发现,根系活力与植物抗病性呈正相关。
植物的诱导抗病性是遇到外界环境胁迫或者病原菌的伤害时所产生的一种获得性抗性[20]。苯丙氨酸解氨酶催化苯丙氨酸脱氨后产生肉桂酸,最后转化为木质素,木质素可以提高木质化程度,加强细胞壁的机械屏障,防止病原菌入侵[21]。PPO可以催化酚与氧气反应产生醌,使组织褐变,从而减轻感染,增强抗病能力[22]。此外,POD、PPO还参与木质素和植保素的合成代谢[5,22]。SOD、POD、CAT能决定植物脂质过氧化作用的敏感性[23]。本研究发现,用链霉菌JD211浸提液处理水稻根系能不同程度地诱导水稻叶片中CAT、POD、PPO、PAL和SOD活性的提升。由此说明,链霉菌JD211所产活性物质能够诱导叶片产生CAT、POD、PAL、SOD和PPO。多数防御酶的产生主要在处理60 h时,说明JD211的活性物质主要在后期发挥作用。但是,目前链霉菌JD211浸提液处理根系诱导水稻叶片酶活性的机制还不清楚,可能是直接或者间接地调节植保素相关基因的表达,从而使防御酶活性大幅度提升;还有可能是因为JD211浸提液对水稻本身有轻微的毒害作用,而使活性氧暴发[24],植物自身通过防御酶保护系统,作出自我调节,产生大量防御酶[25-26]。
链霉菌JD211浸提液能明显提高种子发芽率,处理根系还能诱导抗性酶活性上升,这为链霉菌JD211在植物促生及诱导抗病性方面的研究提供了依据,为植物的生物防治提供了新思路,但是其促生及诱导机制尚不明确,有待通过进一步研究证明。
参考文献:
[1]易 龙,张 亚,廖晓兰,等. 链霉菌防治植物病害的研究进展[J]. 江苏农业科学,2014,42(3):91-95.
[2]Saleem M,Arshad M,Hussain S,et al. Perspective of plant growth promoting rhizobacteria (PGPR) containing ACC deaminase in stress agriculture[J]. Journal of Industrial Microbiology & Biotechnology,2007,34(10):635-648.
[3]靳振江,黄 河,何曙光. 链霉菌FB1的发酵产物对5种豆科植物种子萌发的影响[J]. 大豆科学,2007,26(3):443-446.
[4]赵 娟,杜军志,薛泉宏,等. 3株放线菌对甜瓜幼苗的促生与抗性诱导作用[J]. 西北农林科技大学学报(自然科学版),2010,38(2):109-116.
[5]宋瑞芳,丁永乐,宫长荣,等. 烟草抗病性与防御酶活性间的关系研究进展[J]. 中国农学通报,2007,23(5):309-314.
[6]梁军锋,薛泉宏,牛小磊,等. 7株放线菌在辣椒根部定殖及对辣椒叶片PAL与PPO活性的影響[J]. 西北植物学报,2005,25(10):2118-2123.
[7]杜亚楠,魏赛金,涂国全,等. 新农抗702对水稻抗纹枯病诱导抗性的初步研究[J]. 江西农业大学学报,2012,34(2):270-275.
[8]王世强. 链霉菌JD211对水稻的防病促生效应及机制[D]. 南昌:江西农业大学,2014.
[9]邵正英,聂 丽,李 张,等. 链霉菌JD211对水稻根系形态特征和抗性酶活的影响[J]. 西南农业学报,2017,30(4):739-743.
[10]徐志荣,傅雁辉,赵英杰,等. 链霉菌JD211发酵液对水稻防御稻瘟病菌诱导抗性的作用[J]. 浙江农业学报,2017,29(6):971-976.
[11]王孝平,邢树礼. 考马斯亮蓝法测定蛋白含量的研究[J]. 天津化工,2009,23(3):40-42.
[12]陈建勋,王晓峰. 植物生理学实验指导[M]. 广州:华南理工大学出版社,2002:54-56.
[13]张志良,瞿伟菁,李小芳. 植物生理学实验指导[M]. 北京:高等教育出版社,2009:32-33.
[14]隋 丽. 放线菌769对水稻抗稻瘟病的诱导抗性研究[D]. 长春:吉林农业大学,2008:21-22.
[15]田世平,徐 勇,姜爱丽,等. 冬雪蜜桃在气调冷藏期间品质及相关酶活性的变化[J]. 中国农业科学,2001,34(6):656-661.
[16]张蜀秋,韩玉珍,李 云. 植物生理学实验技术教程[M]. 北京:科学出版社,2011:195-196.
[17]胡 能,涂晓嵘,李昆太,等. 农抗702诱导水稻抗瘟性对水稻丙二醛含量及抗氧化酶活性的影响[J]. 江西农业学报,2017,29(4):1-5.
[18]魏赛金,王世强,李昆太,等. 链霉菌702对水稻种子萌发、幼苗生长及土壤微生物的影响[J]. 农业环境科学学报,2014,33(5):853-861.
[19]白永富,卢秀萍. 烟草种子萌发期间可溶性蛋白质含量与游离氨基酸含量的相关性研究[J]. 中国农学通报,2006,22(8):286-288.
[20]刘 宇,刘建华,刘伟成,等. 利迪链霉菌A02诱导番茄抗灰霉病作用机制研究——对植株防御酶系的影响[J]. 华北农学报,2007,22(2):152-155.
[21]张淑珍,靳立梅,徐鹏飞,等. 野生大豆接种大豆疫霉根腐病后苯丙氨酸解氨酶(PAL)活性的变化[J]. 大豆科学,2009,28(6):1044-1048.
[22]陈 秦,薛泉宏,申光辉,等. 放线菌制剂对番茄PPO活性及生物量的影响[J]. 西北农林科技大学学报(自然科学版),2010,38(3):184-188.
[23]Li Y,Zhang S S,Jiang W S,et al. Cadmium accumulation,activities of antioxidant enzymes,and malondialdehyde (MDA) content in Pistia stratiotes L.[J]. Environmental Science and Pollution Research International,2013,20(2):1117-1123.
[24]李佩芳. 黄瓜霜霉病过敏性反应的研究[D]. 郑州:河南农业大学,2013:5-9.
[25]徐微风,覃和业,刘 姣,等. 冰菜在不同浓度海水胁迫下的氧化胁迫和抗氧化酶活性变化[J]. 江苏农业学报,2017,33(4):775-781
[26]张成玲,杨冬静,赵永强,等. 镰刀菌胁迫对不同甘薯品种抗氧化酶及MDA含量的影响[J]. 江苏农业学报,2017,33(2):263-266. 杨 华,雷 平,郭照辉,等. 细菌防治水稻稻瘟病研究进展[J]. 江苏农业科学,2019,47(7):99-104.

