《2019年APASL慢加急性肝衰竭共识建议(更新)》要点
朱 冰,游绍莉,胡瑾华,辛绍杰
慢加急性肝衰竭(acute-on-chronic liver failure,ACLF)最早于1995年由日本学者提出,其主要是指慢性肝病或肝硬化患者因急性损伤,在特定时间内发生急性肝功能失代偿。一直以来,欧洲肝病学会(European Association for the Study of the Liver,EASL)及亚太肝病学会(Asian Paci fi c Association for the Study of the Liver, APASL)等不同组织对ACLF存在一些争议焦点,主要包括:是否应当将器官衰竭(肝外)包括在ACLF的定义中?究竟是脓毒症导致肝功能衰竭,还是脓毒症是肝功能衰竭的结果?ACLF是否应当包括非肝硬化慢性肝病?ACLF是否包括失代偿期肝硬化?ACLF是否包括定义肝衰竭主要事件,如肝损伤原因、黄疸和凝血功能?鉴于此,APASL ACLF研究联盟(APASL ACLF Research Consortium, AARC)分别于2018年10月在印度新德里、11月在APASL会议期间,广泛征求领域专家意见建议,最终形成ACLF共识,并于今年5月正式发布。现将共识要点分析归纳,供同道参考使用。
1 ACLF概念的明确
ACLF是一组临床症候群,表现为各种损伤引起的急性严重肝脏功能不全。此类患者临床表现虽类似急性肝衰竭(acute liver failure, ALF),但有潜在慢性肝病或肝硬化基础,且预后差,明显有别于失代偿期肝硬化患者因急性损伤导致的急性失代偿(acute decompensation, AD)。
共识认为肝衰竭定义的主要事件包括肝损伤、黄疸、凝血障碍等基本要素。肝性脑病(hepatic encephalopathy, HE)是定义的一部分,但共识认为HE是肝衰竭的结果,是否要等到HE出现才诊断为肝衰竭尚存在争议。在正常肝脏、慢性肝病、代偿期肝硬化、失代偿期肝硬化基础上,肝脏受到急性损伤打击后的表现,包括ALF、ACLF、AD及终末期肝病(end-stage liver disease, ESLD),如图1所示。APASL对ACLF定义易于与ALF区别,且概念简单,所定义的人群具有同质性。
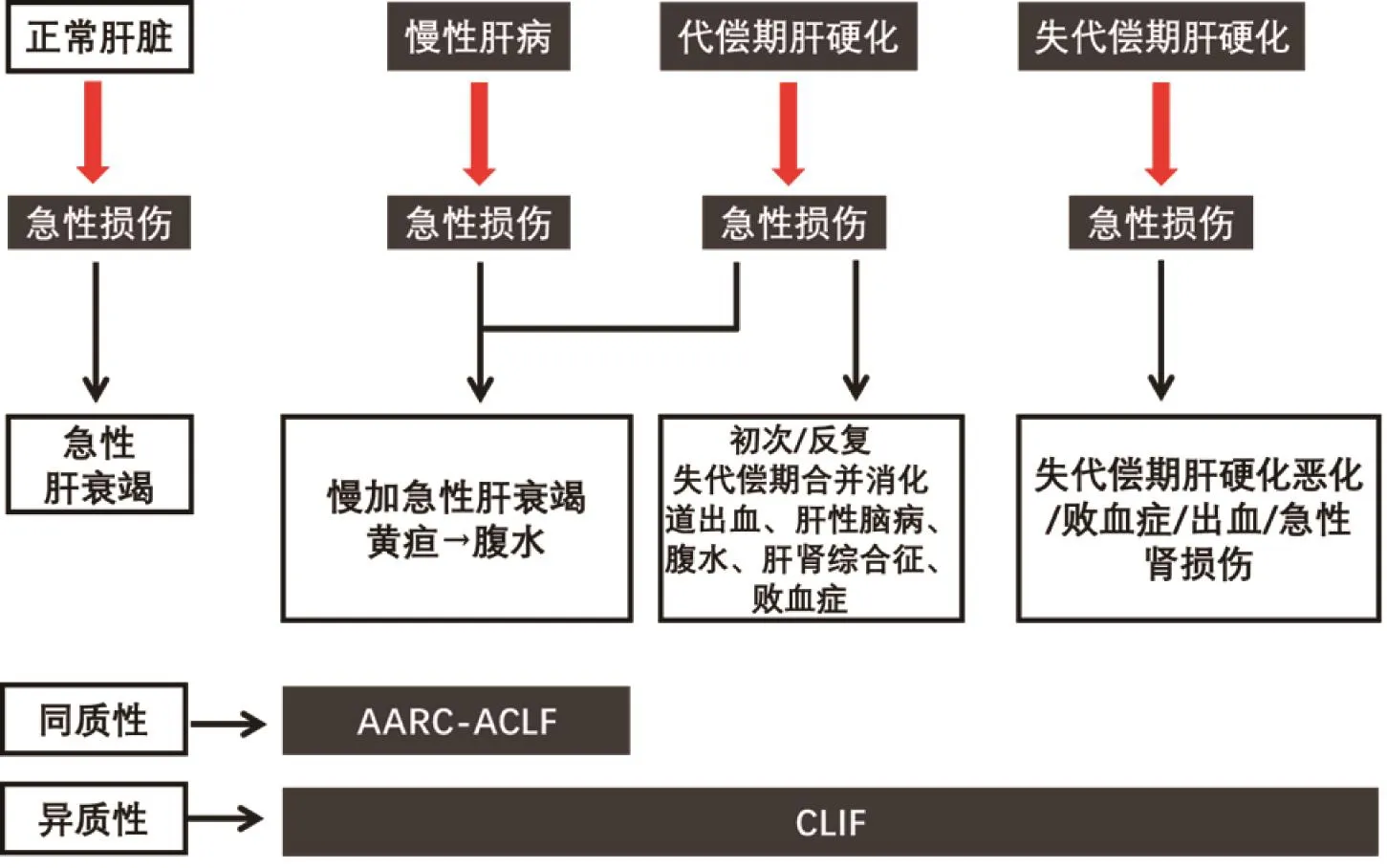
图1 ACLF的概念和不同定义中所包含的群体Figure 1 The concept of ACLF and the groups contained in different definitions
2019年度APASL上,研究者对ACLF五个方面内容做了修订,更有利于临床医生对现有ACLF定义的理解。①ACLF的急性肝损伤时间窗定义为4周是合适的;②ACLF的可恢复性是AARC定义ACLF的一个特点,纳入AARC研究的患者随着时间推移,肝损伤表现为逐渐减轻,肝储备改善,纤维化减轻,门脉压力降低;③ACLF与AD、ESLD应进行鉴别,针对不同肝病基础导致的肝衰竭表现须开展前瞻性队列研究,以分辨患者的同质性;④尽管病死率并不适合用于定义一种疾病,但是基于对这些重症患者在入院、治疗、肝移植中应予以优先的考虑,仍须保留病死率的表述;⑤重申ACLF的定义,不包括肝脏以外器官功能衰竭,肝外器官衰竭是肝衰竭的后续事件。
ACLF 患者28 d与90 d病死率较高,存活90 d的患者,约70% ACLF患者病情逐渐恢复,凝血指标先于胆红素恢复正常,AARC基线评分可判别哪些患者易于恢复,基线和肝脏瞬时弹性成像连续检查可评估ACLF的可恢复性。
2 ACLF诊断要点
2.1 ACLF的定义 ACLF是指在慢性肝病/肝硬化(先前诊断/未确诊)基础上的急性肝损伤,以黄疸(血清胆红素≥5 mg/dl)和凝血障碍[国际标准化比值(international normalized ratio, INR)≥1.5或PTA<40%]为主要表现,4周内并发腹水和/或HE,且28 d有较高病死率。
2.2 慢性肝病的定义 慢性肝病(chronic liver disease, CLD)包括肝硬化和非肝硬化慢性肝病。常见的慢性肝病包括HBV、HCV、酒精性以及非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)所导致的慢性肝炎或肝硬化等。若伴有明显纤维化,非酒精性脂肪性肝炎(nonalcoholic steatohepatitis, NASH)应视为慢性肝病。既往有肝硬化失代偿表现的患者应当排除。ACLF患者慢性肝病和肝硬化的诊断应结合病史、体格检查、实验室、内镜或影像学检查。当存在潜在的慢性肝病和/或不明原因慢性肝病和/或不明原因急性损伤时,建议通过经颈静脉肝活检协助诊断。
2.3 急性损伤病因的定义 ①感染。嗜肝病毒感染,包括HBV再激活或重叠感染。HBV再激活仍然是东方国家患者急性损伤的主要病因,再激活可以是自发的,也可以是因化疗或免疫抑制治疗、高效抗反转录病毒治疗HIV后免疫恢复、利妥昔单抗(抗CD20)化疗后或潜伏HBV活化等因素引起。其他急性打击因素主要包括HEV重叠感染,其他感染包括螺旋体、原虫、蠕虫、真菌等,以及其他部位细菌、寄生虫播散至肝脏。目前资料不足以证明细菌感染本身可导致黄疸和肝功能衰竭。②药物诱导的ACLF(drug-induced ACLF, ACLF-D)。ACLF-D是一种不同于药物性肝损伤(drug-induced liver injury, DILI)的疾病,发展为ACLF-D的患者可发生失代偿和死亡的严重后果。药物可以作为诱发因素,诱导肝硬化患者发生ACLF-D,例如抗结核药物、补充和替代药物、抗反转录病毒药物以及甲氨蝶呤等。阿奇霉素、唑类抗真菌药和抗菌剂等是否会诱发ACLF还须要更多证据验证。③自身免疫性肝病。自身免疫性肝炎相关ACLF(auto-immune hepatitis ACLF,ACLF-AIH)常表现为自身抗体阴性或血清IgG水平正常,抗体阴性AIH病例在没有组织学确认情况下可能被忽视。临床伴随自身免疫性肝外特征/自身免疫性家族史或自身免疫性疾病患者要高度怀疑。对于ACLF-AIH患者,应考虑使用激素治疗。④急性静脉曲张出血(acute variceal bleeding,AVB)。AVB发生率随着肝硬化严重程度增加而增加,代偿期肝硬化(Child-Pugh A级)患者AVB导致ACLF发生率低于5%;一旦发展为ACLF,则90 d病死率会升高。⑤血管性肝病。在肝硬化患者中,急性门静脉血栓形成(portal venous thrombosis,PVT)可能诱发ACLF。肝硬化或Budd-Chiari综合征(Budd-Chiari syndrome, BCS)患者急性PVT可能诱发ACLF。目前尚无PVT或BCS表现的ACLF患者自然病史或预后的数据,也无血管性肝病ACLF患者可推荐的治疗建议。
2.4 ACLF的凝血状态 ACLF患者血液处于低凝状态,随着全身炎症反应综合征(systemic in fl ammatory response syndrome, SIRS)和脓毒症的发展,患者凝血状态可能会发生改变。传统的凝血检测,包括PT、APTT、INR、纤维蛋白原水平和出血时间,但上述指标不能全面衡量ACLF的出血风险。ACLF凝血功能的评估和管理应以血总体粘弹性测定(包括TEG/Sonoclot/ROTEM)为指导。
2.5 ACLF肝组织学检查 经颈静脉肝活检有助于明确ACLF肝损伤病因。肝活检能够确定肝纤维化程度,对判定ACLF患者的预后及结局有一定的帮助,也有助于区分ACLF与失代偿性肝硬化。此外,胆管胆色素沉积、嗜酸性变和肝实质萎缩等组织学指标也可以预测ACLF预后。肝活检评估的标准化对于统一CLD和急性损伤的诊断和治疗至关重要。
3 ACLF与AD的区别
ACLF与AD很相似,但容易被混淆(见表1)。AD是发生在肝硬化或失代偿肝硬化基础上,在某些诱因作用下出现肝性表现(黄疸、腹水、HE)或肝外表现[静脉曲张出血、急性肾损伤(actute kidney injury, AKI)或脓毒症],病程可长达3个月,胆红素水平一般低于5 mg/dl,腹水、HE 、AVB可能先于黄疸发生。 AD患者发生肝外器官衰竭时,短期病死率高。ACLF是一种肝功能不全的综合征(黄疸、凝血障碍、腹水伴或不伴HE),诱发因素仅来源于肝脏(酒精、病毒、药物、自身免疫等因素),在4周内发生肝功能衰竭。ACLF的黄疸和凝血障碍先于腹水发生,腹水的进展是由于肝脏严重炎症后门脉压力的迅速升高,同时,肝外器官衰竭的表现,如AKI、脓毒症、AVB往往发生在ACLF之后。AD长期存活率较ACLF低,多器官功能衰竭发生率均较ACLF高,AD应该被认为是肝硬化病程发展中的一个时期的表现,而不是一个综合征。对潜在预测因子和诱因的评估有利于协助AD的管理。黄疸发生前的任何失代偿都强烈提示AD,没有反复发作的失代偿表现则是ACLF的特点。

表1 ACLF与AD的区别Table 1 Differentiating ACLF from AD
4 ACLF预后评估:推出AARC评分
AARC评分是一个评估预后的较好工具,可以评估哪些患者可能出现逆转,效果优于MELD、MELDNa、CLIF-SOFA和SOFA评分。累积病死率随AARC评分增加而增加,第1周内AARC评分的变化趋势可以预测是否须要肝移植:<10分或降低至<10分,生存率提高,不须要肝移植;AARC评分为>10分的患者应列入肝移植对象。AARC-ACLF应在第4 d和第7 d进行评估,以预测疾病的进展和预后。
乳酸可协助判定ACLF的严重程度,乳酸清除率较基线乳酸更能反映患者的病情。血小板计数高、白细胞计数低和无HE是可恢复性的独立预后因子。年龄、肝硬化、肝静脉压力梯度(hepatic venous pressure gradient, HVPG)>18 mmHg和/或静脉曲张出血、腹水、自发性细菌性腹膜炎(spontaneous bacterial peritonitis, SBP) 和 HE等并发症是死亡的独立预测因素。超重或肥胖和血脂异常会增加ACLF患者肝病严重程度。
5 梳理规范ACLF的管理
5.1 恰当的处理对ACLF的疗效有重要影响 如早期(2周内)HBV-ACLF的抗HBV治疗、酒精性ACLF和AIH-ACLF选择激素治疗等。
5.2 ACLF的血液净化治疗 血浆置换是ACLF肝移植或自发性恢复的有效治疗方法,特别是对Wilson病和严重的ACLF-AIH患者的治疗。当发生危及生命的容量过载、高钾血症、高钠血症和代谢性酸中毒,保守治疗无效时应立即启动肾脏替代治疗。
5.3 ACLF脓毒症的处理 在ALCF患者中,入院时约有1/3存在细菌感染,入院第1周可能还会增加。无脓毒症的患者28 d病死率较低,基线合并脓毒症或在入院第4 d前出现脓毒症的患者病死率高。细菌感染是预测ACLF器官功能衰竭的重要因素。ACLF最常见的感染是SBP、肺炎、尿路感染和菌血症。ACLF患者应密切监测感染的存在,以使其能够早期诊断和治疗。一旦怀疑或诊断为细菌感染,应单独或联合使用广谱抗菌药物,然后根据抗生素敏感性试验结果调整治疗。
5.4 肾功能障碍与肾功能衰竭的处理 对于ACLF患者的肾脏器官功能障碍的诊断,推荐使用急性肾损伤网络标准。在ACLF患者中,血清肌酐>1.1 mg/dl提示肾功能障碍,>1.5 mg/dl提示肾功能衰竭。ACLF伴随AKI患者的30 d病死率很高。与失代偿性肝硬化相比,AKI在ACLF患者中更为常见且进展迅速,与更严重的预后相关。AKI的分期及病程是临床预后的重要决定因素。ACLF患者应根据 PIRO(易感性、感染/炎症、反应、器官衰竭)评分对ACLF患者分层,以确定发生AKI的风险。应尽一切努力防止所有ACLF患者出现AKI。ACLF患者 HRS-AKI输注特利加压素治疗优于去甲肾上腺素。
5.5 HE的处理 约有1/3的ACLF患者存在HE,包括1~2级HE(器官功能障碍)和3~4级HE(器官衰竭)。HE严重程度与病死率有关,3~4级病死率高于1~2级HE。炎症在ACLF患者HE发病机制中起重要作用,并与细胞因子风暴有关。处理方面包括识别与治疗感染在内的诱发因素,解决高氨血症和全身炎症。难治性患者可能须要大容量血浆置换或白蛋白透析,并须要鉴别门体分流和栓塞。氨与HE/脑衰竭的严重程度有关,是ACLF中HE的简单有效的标记物。乳果糖、利福昔明降氨仍是肝硬化HE患者的主要治疗方法。
5.6 血流动力学改变及穿刺引起的循环功能障碍(paracentesis induced circulatory dysfunction,PICD)的管理 基线HVPG是预测ACLF病死率的重要指标,降低HVPG对ACLF的管理意义重大,应重视HVPG测定的安全性和标准化程序。ACLF非侵袭性HVPG的替代测定方法须进一步研究。ACLF患者如果在没有其他治疗的情况下进行穿刺大量放腹水,大约80%发生PICD。使用白蛋白进行扩容,发病率可降低。加压素与白蛋白联合使用在预防PICD方面具有协同作用。ACLF应用非选择性β受体阻滞剂是安全的,可减轻全身炎症、降低门脉压力及其他潜在作用,与提高短期存活率相关,推荐无禁忌证的ACLF患者使用。
5.7 ACLF的肝移植 肝移植应该在ACLF病程的早期选择,可避免脓毒症和多器官衰竭的并发症,但目前尚缺少有效的标准和评分系统确定早期肝移植的时机。器官衰竭本身不应该成为肝移植的禁忌证,除非需要心、肺功能支持或第4 d或第7 d器官衰竭进展迅速。APASL AARC评分在肝移植患者的筛选方面有较好优势。MELD评分为中度升高的HBV再激活患者、肝硬化、胆红素>10 mg/dl、PT<40%、血小板<100×109/L时,应早期移植。类固醇治疗无效的重症酒精性肝炎患者应优先考虑肝移植。
6 关注儿童ACLF
APASL首次对儿童ACLF形成共识。目前,儿童ACLF尚无专门的定义,存在的主要问题是:①临床确定HE非常困难,特别是年龄<3岁的儿童;②器官肿大的儿童,临床腹水诊断较困难;③部分儿童肝功能衰竭可能无黄疸表现,而当前的ACLF定义要求黄疸。APASL认为可借助影像学、生化检测等手段协助诊断。目前,APASLACLF定义可用于儿童ACLF诊断,但尚须进一步开展多中心前瞻性队列研究。
APASL中关于儿童ACLF的研究数据主要来自印度3个中心的回顾性研究。约14%的儿童CLD病例表现为ACLF,病因依次为Wilson病(41.2%~45.7%)、自身免疫性肝病(17.6%~41.9%)、隐源性肝硬化(3.2%~41.2%)。最常见的急性损伤因素是病毒性肝炎和肝毒性药物。目前,共识认为应将胆道闭锁从ACLF定义中排除。儿童ACLF短期(28 d)生存率差,约为33%。约50%的ACLF儿童可见一个或多个肝外器官衰竭,其中AKI和3~4级HE最常见。AKI会使结局不良的风险成倍增加。AARC-ACLF模型也可用于动态评估儿童ACLF的预后。评分≥11分的患儿须要立即考虑肝移植。
7 总 结
《2019年APASL慢加急性肝衰竭共识建议(更新)》[1]要点主要是基于AARC纳入的前瞻性研究队列(>3300例)数据,新增了关于ACLF与肝硬化AD的区别;ACLF的可恢复性;DILI-ACLF,AIH-ACLF,PVT/ACLF;门静脉和全身血流动力学与ACLF的相关性的阐述,并指出AARC评分可用于指导ACLF治疗,同时首次就儿科ACLF达成一定共识。在过去的5年,ACLF的领域研究进展迅速,东西方学者对ACLF定义争议较多,尤其是患者人群的同质性及急慢性肝损伤的准确区分都会影响到ACLF的病程、精准预后及肝移植的筛选。因此,东西方观念的融合,确认ACLF人群的同质性可能是科学处置此类患者的惟一道路。

