有机氯类农药在残留剂量下联合诱导乳腺癌MCF-7细胞增殖的机制研究
郎朗,董晓琪,狄静波
1. 哈尔滨商业大学中药学博士后科研流动站,哈尔滨 150076 2. 哈尔滨商业大学生命科学与环境科学研究中心,哈尔滨 150076
有机氯类农药曾被广泛用于农林领域,但因其难降解,易通过食物链生物富集和放大,危害人类健康,已被列为持久性有机污染物,虽已于1983年停止生产和使用,但在环境和多种植物中仍可检出[1]。笔者课题组在前期实验中,检测了东北地区中药材中有机氯类农药的残留量,虽然单一有机氯类农药含量未超出国家标准,但其联合毒性效应需引起关注。本实验选取雌激素受体阳性的乳腺癌MCF-7细胞为受试对象,研究了六氯苯、β-六六六和p,p’-滴滴涕单一和联合毒性作用。采用MTT法考察3种农药单独和联合作用时对乳腺癌MCF-7细胞生长的影响,用流式细胞仪检测有机氯类农药联合作用时对乳腺癌MCF-7细胞周期分布的影响,用Western Blot法检测有机氯类农药联合作用时对乳腺癌MCF-7细胞中ERα、ERβ、ERK1/2、p-ERK1/2、Ki67、c-Myc和CyclinD1蛋白表达的影响。
1 材料与方法(Materials and methods)
1.1 实验材料
乳腺癌MCF-7细胞由哈尔滨商业大学生命科学与环境科学研究中心提供;雌二醇(E2,纯度≥98%)购自美国Sigma公司;六氯苯(HCB,纯度≥99%)购自天津市光复精细化工研究所;β-六六六(β-BHC,纯度≥99%)、p,p’-滴滴涕(p,p’-DDT,纯度≥99%)购自天津市农业部环境保护科研监测所;溴化四氮唑蓝(MTT,纯度≥97.5%)购自美国Sigma公司;兔抗ERα、ERβ、ERK1/2和p-ERK1/2多克隆抗体购自北京市中杉生物技术有限公司;兔抗Ki67、CyclinD1多克隆抗体和人β-肌动蛋白抗体购自北京市博奥森生物技术有限公司。WELLSCAN MK 3型酶标仪、EPS-300型电泳仪购自美国Bio-Rad公司。
1.2 实验方法
1.2.1 残留剂量下有机氯类农药对乳腺癌MCF-7细胞增殖的影响
乳腺癌MCF-7细胞饥饿培养3 d(无酚红RPMI1640培养液,含10%去雌激素的胎牛血清),稀释为4×104个·mL-1的细胞悬液,按每孔4 000个接种于96孔板中,24 h后,加入不同浓度药物,阳性对照组加入E2,浓度为1.0×10-8mol·L-1。单一给药设3组,根据前期实验中检测到的中药材中有机氯类农药的残留量,确定毒性实验剂量[2],HCB浓度为3.5×10-9mol·L-1,β-BHC浓度为7.4×10-9mol·L-1,p,p’-DDT浓度为5.4×10-8mol·L-1。设4个联合用药组,分别为HCB+β-BHC、HCB+p,p’-DDT、β-BHC+p,p’-DDT、HCB+β-BHC+p,p’-DDT(均为等效剂量)。同时设溶剂对照组(0.1%浓度的正己烷),每个剂量组设6个平行孔。继续培养24、48和72 h后,测定OD490值。计算细胞增殖率(proliferation rate, PR):
1.2.2 残留剂量下有机氯类农药对乳腺癌MCF-7细胞周期的影响
饥饿培养MCF-7细胞,稀释后加入6孔板,按每孔1.5×105个细胞培养24 h后,每孔加1 mL的药液。给药组为E2组、β-BHC+p,p’-DDT联合组、HCB+β-BHC+p,p’-DDT联合组和溶剂对照组(均为等效剂量)。每组设3个平行样,48 h后收集细胞,离心后用PBS冲洗。用预冷的70%乙醇在4 ℃冰箱里固定细胞12 h后,离心后倒去固定液,加入配好的PI染液500 μL,室温孵育30 min,过300目滤网,流式细胞仪检测。
1.2.3 Western Blot法测定增殖相关蛋白
饥饿培养MCF-7细胞,稀释为1.0×106个·mL-1,分装于培养瓶中,用RIPA裂解液提取细胞总蛋白,BCA法进行蛋白定量后,加入蛋白上样缓冲液煮沸备用,制备100 g·L-1SDS-PAGE凝胶进行电泳。采用湿转电转仪将凝胶蛋白转印到PVDF膜上,转膜结束后将膜用含5% BSA的TBST溶液于室温条件下封闭2 h。利用TBST缓冲液漂洗PVDF膜3次,每次15 min,然后与相应的一抗在4 ℃条件下孵育过夜。TBST洗膜3次,每次15 min,然后加入二抗(碱磷酶标记羊抗鼠或羊抗兔IgG)室温孵育1 h,TBST洗膜3次,每次15 min,化学发光法检测,图像采集,ImageJ软件进行图像分析。
1.3 统计学方法
2 结果(Results)
2.1 残留剂量下有机氯类农药对乳腺癌MCF-7细胞增殖的影响
如图1所示,3种有机氯类农药单独或联合诱导乳腺癌MCF-7细胞24、48和72 h后,分别计算各组平均OD值,经分析可知,残留剂量下3种农药分别作用于细胞24、48和72 h后,细胞增殖与对照组比较无明显差异(P>0.05)。当农药联合作用时,在24、48 h时β-BHC+p,p’-DDT组、HCB+β-BHC+p,p’-DDT组细胞增殖有显著提高(P<0.01),与E2组作用相似。β-BHC+p,p’-DDT组和HCB+β-BHC+p,p’-DDT组24 h增殖率分别为115.0%和120.1%,48 h增殖率分别为121.2%和126.3%。作用72 h时,各组与对照组相比差异不显著(P>0.05)。
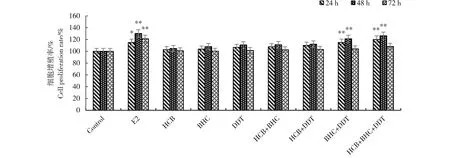
图1 残留剂量下有机氯类农药对乳腺癌MCF-7细胞增殖的影响(n=6)注:与对照组相比,*P<0.05、** P<0.01。E2表示雌二醇,浓度为1.0×10-8 mol·L-1;HCB、β-BHC和p,p'-DDT分别表示六氯苯、 β-六六六和p,p'-滴滴涕,其残留浓度分别为3.5×10-9 mol·L-1、7.4×10-9 mol·L-1和5.4×10-8 mol·L-1。Fig. 1 Effect of organochlorine pesticides on the proliferation of breast cancer MCF-7 cells at the residual dose (n=6) Note: compared with control, * P<0.05, ** P<0.01. E2 stands for estradiol, and its concentraiton is 1.0×10-8 mol·L-1; HCB, β-BHC and p,p'-DDT stand for hexachlorobenzene, β-hexahexachlorocyclohexane and p,p'-clofenotane; their residual doses were 3.5×10-9 mol·L-1, 7.4×10-9 mol·L-1 and 5.4×10-8 mol·L-1.
2.2 残留剂量下有机氯类农药联合对乳腺癌MCF-7细胞周期的影响
细胞的增殖和分化受细胞的Gl、S、G2和M 4个时期严格调控,残留剂量下有机氯类农药联合对细胞周期的作用如表1所示,β-BHC+p,p’-DDT组与HCB+β-BHC+p,p’-DDT组、E2组与对照组相比G1期细胞比例显著降低(P<0.05),S期细胞比例显著升高(P<0.01),G2/M期细胞比例无明显变化(P>0.05)。2种农药联合组使乳腺癌MCF-7细胞的S期细胞比例显著增加,促进细胞增殖。
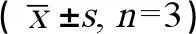
表1 残留剂量下有机氯类农药作用乳腺癌 MCF-7细胞48 h后细胞周期的变化Table 1 Changes of cell cycle of breast cancer MCF-7 cells treated with organochlorine pesticides at residual dose for 48 h n=3)
注:A为HCB,B为β-BHC,C为p,p’-DDT;与对照组相比,*P<0.05、**P<0.01。
Note: A represents HCB; B represents β-BHC; C represents p,p’-DDT; compared with control, *P<0.05, **P<0.01.
2.3 残留剂量下有机氯类农药联合对乳腺癌MCF-7细胞增殖相关蛋白的影响
2.3.1 残留剂量下有机氯类农药对乳腺癌MCF-7细胞雌激素受体蛋白的诱导
Western Blot法检测结果如图2所示,β-BHC+p,p’-DDT组和HCB+β-BHC+p,p’-DDT组均能降低乳腺癌MCF-7细胞中ERα蛋白表达量,且HCB+β-BHC+p,p’-DDT组<β-BHC+p,p’-DDT组
2.3.2 残留剂量下有机氯类农药对乳腺癌MCF-7细胞MAPK信号转导通路的影响
如图3所示,E2组、β-BHC+p,p’-DDT组和HCB+β-BHC+p,p’-DDT组与对照组相比,ERK1/2蛋白表达并无明显变化(P>0.05)。

图2 残留剂量下有机氯类农药对乳腺癌MCF-7细胞中ER蛋白的影响(n=3)注:与对照组相比,*P<0.05、**P<0.01。Fig. 2 Effects of organochlorine pesticides on ER protein in breast cancer MCF-7 cells at the residual dose (n=3) Note: compared with control, *P<0.05, **P<0.01.
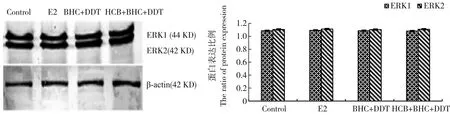
图3 残留剂量下有机氯类农药对乳腺癌MCF-7细胞中ERK蛋白的影响(n=3)Fig. 3 Effects of organochlorine pesticides on ERK protein in breast cancer MCF-7 cells at the residual dose (n=3)
如图4所示,E2组、β-BHC+p,p’-DDT组和HCB+β-BHC+p,p’-DDT组与对照组相比,P-ERK1/2蛋白表达量均有升高(P<0.01),且2个有机氯类农药联合组的促增殖效应强于E2组。
2.3.3 残留剂量下有机氯类农药对乳腺癌MCF-7细胞增殖相关蛋白的诱导
Ki67是一种只能在细胞核中进行表达的增殖相关蛋白,是检测细胞增殖活性的较好的指标[3]。如图5所示,与对照组相比,E2组和2个有机氯类农药联合组均可使Ki67蛋白表达量升高(P<0.01),
HCB+β-BHC+p,p’-DDT组作用强度高于β-BHC+p,p’-DDT组,而β-BHC+p,p’-DDT组与E2组作用强度相当。
CyclinD1为ER调控的蛋白,当雌激素作用时能升高细胞G1期的早、中期CyclinD1蛋白表达量,诱导细胞的增殖。如图6所示,与对照组相比,E2组和2个有机氯类农药联合组均使CyclinD1蛋白表达量升高(P<0.01),且作用强度序列为HCB+β-BHC+p,p’-DDT组>β-BHC+p,p’-DDT组>E2组。
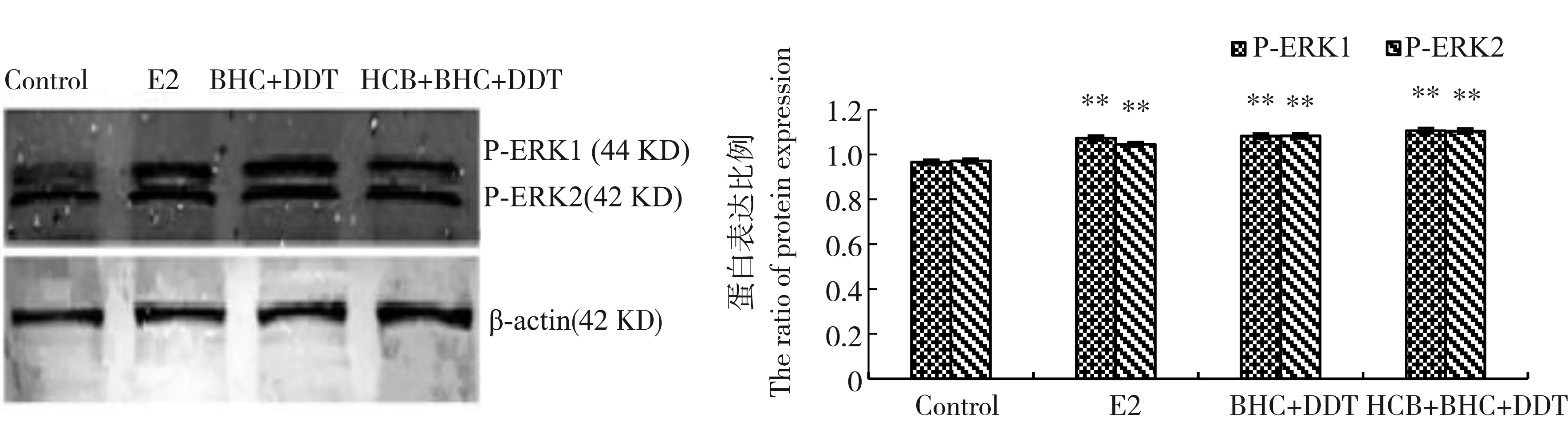
图4 残留剂量下有机氯类农药对乳腺癌MCF-7细胞中p-ERK蛋白的影响(n=3)注:与对照组相比,** P<0.01。Fig. 4 Effects of organochlorine pesticides on p-ERK protein in breast cancer MCF-7 cells at the residual dose (n=3) Note: compared with control, ** P<0.01.
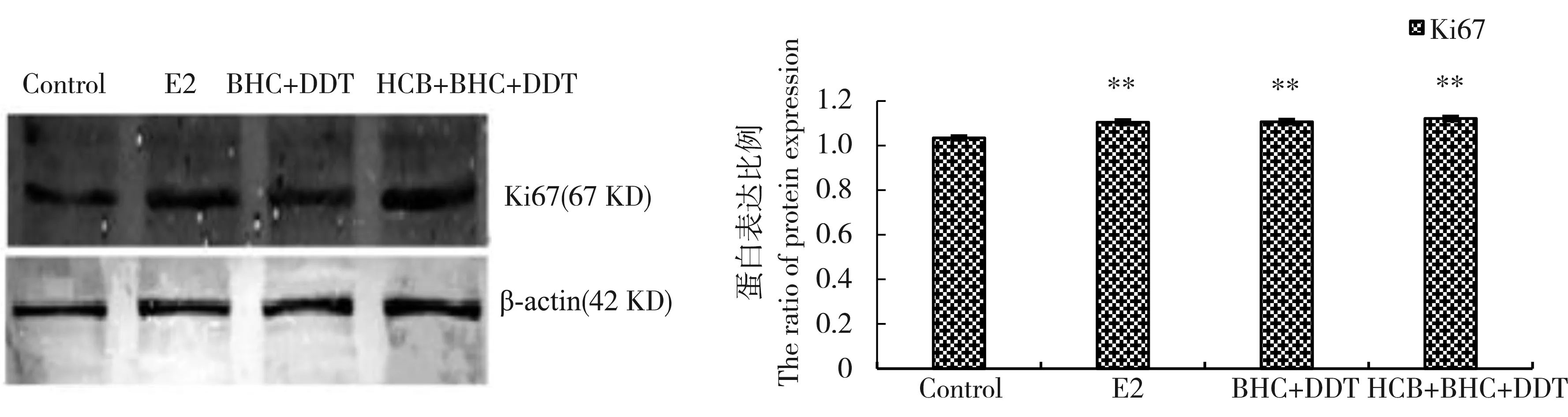
图5 残留剂量下有机氯类农药对乳腺癌MCF-7细胞中Ki67蛋白的影响(n=3)注:与对照组相比,** P<0.01。Fig. 5 Effects of organochlorine pesticides on Ki67 protein in breast cancer MCF-7 cells at the residual dose (n=3) Note: compared with control, ** P<0.01.
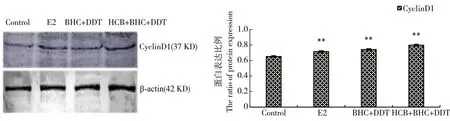
图6 残留剂量下有机氯类农药对乳腺癌MCF-7细胞中CyclinD1蛋白的影响(n=3)注:与对照组相比,** P<0.01。Fig. 6 Effect of organochlorine pesticides on CyclinD1 protein in breast cancer MCF-7 cells at the residual dose (n=3) Note: compared with control, ** P<0.01.
蛋白转录因子c-Myc是乳腺癌细胞的特异性蛋白。如图7所示,与对照组相比,E2组和2个有机氯类农药联合组均可使c-Myc蛋白表达量升高(P<0.01),且作用强度序列为HCB+β-BHC+p,p’-DDT组>BHC+p,p’-DDT组>E2组。
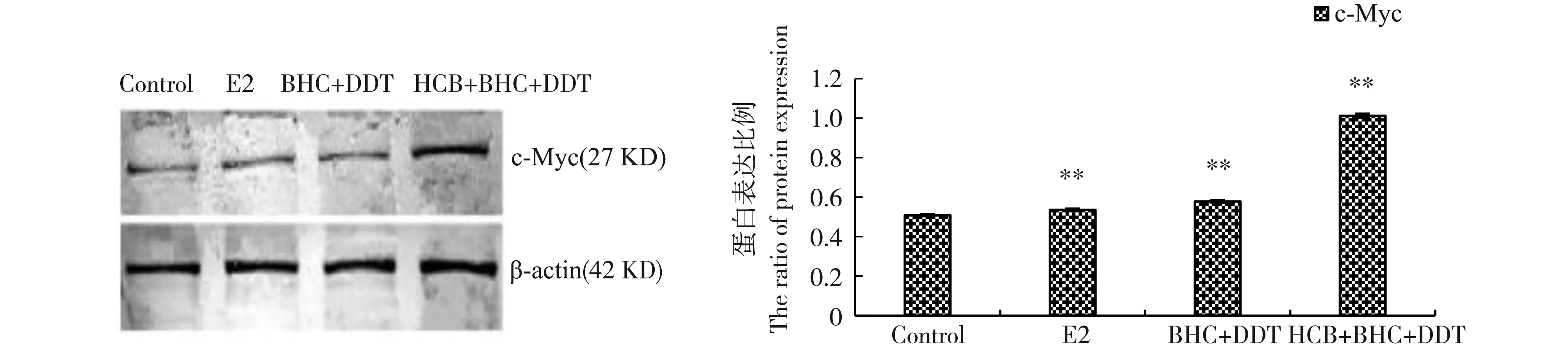
图7 残留剂量下有机氯类农药对乳腺癌MCF-7细胞中c-Myc蛋白的影响(n=3)注:与对照组相比,** P<0.01。Fig. 7 Effect of organochlorine pesticides on c-Myc protein in breast cancer MCF-7 cells at the residual dose (n=3) Note: compared with control, ** P<0.01.
3 讨论(Discussion)
笔者课题组前期研究中,检测出东北地区中药材中残留的有机氯类农药主要包括HCB、β-BHC和p,p’-DDT等3种,当单一存在时,残留剂量均低于《中国药典》的最低残留量的参考值,未能诱导乳腺癌MCF-7细胞的增殖。但当3种农药在此残留剂量下两两联合、三者联合作用时,β-BHC+p,p’-DDT、HCB+β-BHC+p,p’-DDT组能促进细胞增殖,其他组与对照组比较则无明显变化,且HCB+β-BHC+p,p’-DDT组的增殖效果高于β-BHC+p,p’-DDT组。可推测β-BHC+p,p’-DDT组对乳腺癌MCF-7细胞的影响存在着交互作用,使增殖效果显著,而当三者联合作用时,HCB可能促进了这种交互作用,此时增殖效果要强于β-BHC+p,p’-DDT组。
有机氯类农药作为一类典型的具有雌激素活性的污染物,不仅能与雌激素核受体(nuclear estrogen receptor, nER)直接结合,激活下游靶基因的表达,还可通过活化雌激素膜受体(membrane estrogen receptor, mER)激活ERK/MAPK信号转导通路,发挥雌激素作用,进而产生生物学效应[4]。当3种农药在残留剂量下,β-BHC+p,p’-DDT组与HCB+β-BHC+p,p’-DDT组作用于乳腺癌MCF-7细胞后,雌激素信号首先通过活化mER使其与信号分子c-Src或转接蛋白(adaptor)等结合,激活ERK/MAPK通路,促进细胞中的p-ERK1/2的表达,p-ERK将雌激素信号转至核内,与nER结合后使Hsp90游离,导致ER结构发生变化,进而调控下游基因的变化。除此之外,雌激素信号分子还会与nER直接结合,以二聚体形式与靶基因ERE结合,调节下游靶基因的转录和相关基因或蛋白的表达。ERα和ERβ分别为ER受体的2种亚型,ERα可通过调节胞内细胞周期因子或其他生长因子影响细胞增殖。ERβ可结合雌激素激活mRNA转录,对调控信号转导、细胞周期及细胞凋亡有重要意义[5-7]。在两者同时表达的状态下,ERβ能够抑制ERα的转录与表达,降低ERα对雌二醇的敏感性[8],所以β-BHC+p,p’-DDT组与HCB+β-BHC+p,p’-DDT组作用于细胞后,使ERα表达量降低,ERβ表达量升高。c-Myc和Ki67是位于细胞核内的增殖相关蛋白,c-Myc作为一种原癌基因有着调控细胞周期的重要作用。Ki67常在增殖细胞中表达,受细胞周期调控[9]。c-Myc和Ki67作为细胞周期因子,可通过ERα、ERβ激活并表达。CyclinD1作为一种周期蛋白,能促进细胞增殖。c-Myc、Ki67的表达与CyclinD1表达存在正相关性,也就是说c-Myc、Ki67表达量的升高能够促进CyclinD1的表达量的升高,而CyclinD1的过度表达将会诱导细胞向S期转化,促进细胞增殖。结合本实验结果,残留的有机氯类农药能够激活ERK/MAPK信号通路,促进p-ERK的表达,转导雌激素信号入核,活化ERα、ERβ蛋白,进而激活下游的转录因子c-Myc、Ki67和CyclinD1蛋白表达,促进细胞增殖。本研究为有机氯类农药雌激素活性作用机制研究提供了理论依据。
综上所述:(1)残留剂量下,HCB、β-BHC和p,p’-DDT这3种农药单一作用于乳腺癌MCF-7细胞时,由于剂量较低未能促进细胞增殖,β-BHC+p,p’-DDT组与HCB+β-BHC+p,p’-DDT组因存在着交互作用使增殖作用更显著,且HCB+β-BHC+p,p’-DDT组增殖作用强于β-BHC+p,p’-DDT组。
(2)残留剂量下,β-BHC+p,p’-DDT组和HCB+β-BHC+p,p’-DDT组作用于乳腺癌MCF-7细胞,使S期细胞比例明显高于对照组,细胞呈明显的增殖状态。
(3)残留剂量下,β-BHC+p,p’-DDT组和HCB+β-BHC+p,p’-DDT组激活经典的ERK-MAPK信号转导途径,受体酪氨酸激酶和适配体蛋白→Ras→Raf→MEK→ERK1/ERK2→转录因子→细胞增殖、转化等相关基因表达,使细胞S期细胞数上升,最终诱导细胞增殖。

