一株新城疫病毒F基因的克隆及其遗传进化分析
徐萍 徐小博 TATIANA Fotina 王三虎 赵坤
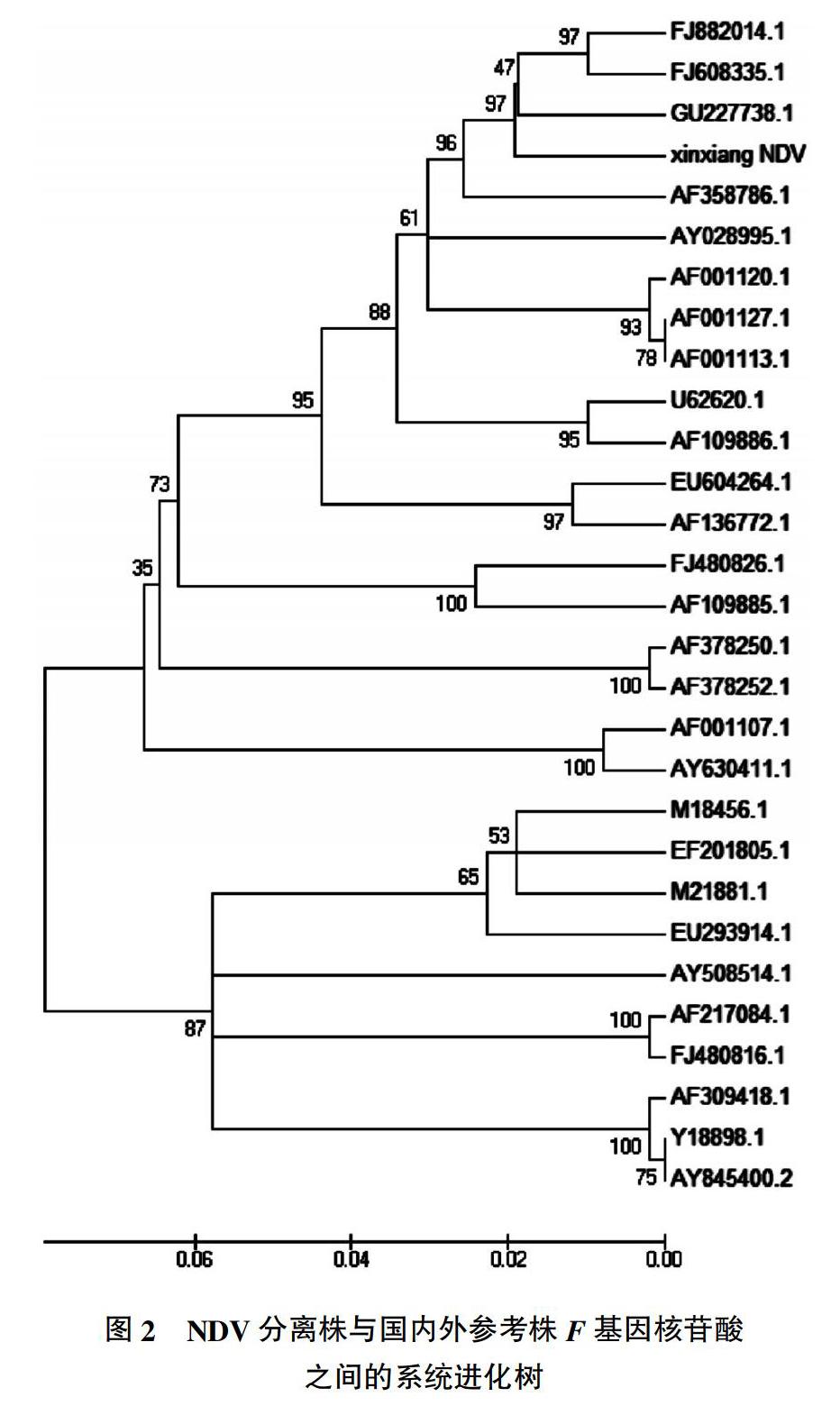
摘要:从新乡市某养鸡场的疑似新城疫病鸡群中分离到1株新城疫病毒,并对该病毒分离株进行F基因的扩增、序列测定和遗传进化分析。结果表明,该新城疫病毒分离株的F基因全长为1 662 bp,F蛋白裂解位点区的氨基酸序列为112R-R-Q-K-R-F117,具备强毒株的特征;同源性分析表明,该新城疫病毒分离株与国内外流行的基因Ⅶ型强毒株之间的同源性较高,为87.5%~97.7%,其中与国内流行的基因Ⅶd型的参考毒株同源性最高,为95.4%~97.7%,而与现用疫苗株La Sota、Clone-30、B1、Mukteswar等同源性较低,84.2%~86.6%;系统进化树分析表明,该新城疫病毒分离株与基因Ⅶd型参考毒株FJ882014、FJ608335和GU227738处在同一个进化分支上,亲缘关系最近。
关键词:新城疫病毒;F基因;克隆;序列分析;遗传进化;鸡
中图分类号:Q78 文献标识码:A
文章编号:0439-8114(2019)15-0132-04
DOI:10.14088/j.cnki.issn0439-8114.2019.15.031 开放科学(资源服务)标识码(OSID):
Cloning and genetic evolution analysis of one strain of newcastle disease virus
XU Ping1,2,XU Xiao-bo1,TATIANA Fotina2,WANG San-hu3,ZHAO Kun3
(1.College of Life Science and Technology,Xinxiang University,Xinxiang 453003,Henan,China;2.Department of Veterinary Medicine,Sumy National Agrarian University,Sumy 40021,Ukraine;3.College of Animal Science and Technology, Henan Institute Science and Technology,Xinxiang 453003,Henan,China)
Abstract: A Newcastle disease virus(NDV) was isolated from ND suspected chickens of a scale chicken farm in Xinxiang. The F gene of the isolated Newcastle disease virus(NDV) was amplified and analyzed by genetic evolution. The results showed that the whole nucleotied sequence length of F gene was 1 662 bp. The sequence of amino acid of F gene at the cleavage site is 112R-R-Q-K-R-F117, which is consistent with the characteristics of strong NDV strain. Comparison of the NDV with the strong NDV of gene Ⅶ of epidemic strains from different countries, results showed that the nucleotide homology was 87.5%~97.7%, and in which the comparison with the Ⅶd was 95.4%~97.7%. Comparison of the NDV isolated with the current vaccine strains such as La Sota, Clone-30, B1, Mukteswar and so on, the nucleotide homology was 84.2%~86.6%. The phylogenetic tree analysis demonstrated that the NDV isolated and Ⅶd strains of FJ882014,FJ608335 and GU227738 were located in the same cladogram branch.
Key words: Newcastle disease virus;F gene;cloning;sequence analysis;genetic evolution;chicken
新城疫病毒(Newcastle disease virus,NDV)是引起禽類新城疫(Newcastle Disease,ND)高度接触性、急性、败血性传染病的病原[1]。该病原属于副黏病毒科禽腮腺炎病毒属,为有囊膜的单股负链RNA病毒[2]。NDV基因组全长约15 kb,编码6种结构蛋白,分别为NP、P、M、F、HN和L蛋白,其中融合蛋白(F)和血凝素-神经氨酸酶蛋白(HN)为NDV的功能性糖蛋白[3]。两种蛋白在机体免疫应答和致病过程中起着极其重要的作用。HN蛋白在病毒侵染过程中起识别受体的作用,而F蛋白则参与病毒与宿主细胞及宿主细胞间融合过程,两种蛋白均为NDV的保护性抗原。F蛋白裂解位点处的氨基酸序列对病毒毒力有着非常重要的影响,被看作判定NDV毒力的重要标准[4-6]。此外,根据F基因的高变区序列将NDV划分为不同的基因型。对NDV分离株F蛋白的研究,有助于了解鸡新城疫的发病原因。本研究从新乡市某鸡场分离得到的新城疫病毒对其F基因进行克隆和分析,从分子水平阐明该毒株与其他各毒株间的差异,为该病的防控及分子流行病学研究奠定基础。
1 材料与方法
1.1 材料及试剂
NDV病毒,分离自新乡市某鸡场;无特定病原的鸡胚(SPF)购自北京梅里亚维通实验动物技术有限公司;大肠杆菌E.coli DH5ɑ感受态细胞购自北京全式金生物技术有限公司;pMD18-T vector克隆载体、Ex Taq酶、T4 DNA连接酶、限制性内切酶、miRCURY RNA Isolation Kit、PrimeScript 1st Strand cDNA Synthesis Kit、普通琼脂糖凝胶回收纯化试剂盒和质粒提取试剂盒购自宝生物工程(大连)有限公司;Amp、Kan+、X-gal、IPTG、琼脂粉购自Sigma公司;琼脂糖、酵母粉和蛋白胨购自OXOID公司。
1.2 病毒的繁殖
病毒经过分离纯化后,尿囊腔接种10日龄SPF鸡胚,每胚0.2 mL,37 ℃孵育72 h。无菌收集24 h后死亡鸡胚尿囊液,并测定其血凝性。
1.3 引物的设计与合成
根据GenBank已收录的NDV F基因序列,利用Primer Premier 5.0设计引物,P1:5-ATGGGCTC
CAAACCTTCTACCA-3;P2:5-TCATGCTCTTGCAG
TGGCTCTCAT-3,引物序列由Invitrogen(上海)贸易有限公司合成。
1.4 F基因的克隆及序列测定
1.4.1 NDV基因组RNA的提取 按TRIzol法提取La Sota毒株(阳性对照)和病料尿囊液的病毒基因组RNA,保存于-80 ℃。
1.4.2 RT-PCR擴增及目的基因的回收纯化 采用NDV特异性引物,经RT-PCR扩增F基因。20 μL反转录体系为dNTP mixture 1 μL、Random 6 mers 1 μL、RNA 8 μL。65 ℃水浴5 min,再加入Rnme script II Rtose 0.5 μL、5×Prime script II Buffer 4 μL、Rnase Inhibitor 0.5 μL、Rnase H2O 5 μL。样品加好混匀后30 ℃ 12 min,42 ℃ 30 min,95 ℃ 5 min,即获得反转录的cDNA。PCR扩增反应体系为2×Taq MasterMix 25 μL、P1 2 μL、P2 2 μL、ddH2O 19 μL、模板cDNA 2 μL,混匀;PCR反应条件为94 ℃预变性10 min;94 ℃变性30 s,53 ℃退火30 s,72 ℃延伸120 s,30个循环;72 ℃延伸10 min后4 ℃保存。PCR产物经1%琼脂糖凝胶电泳检测后,用普通琼脂糖凝胶回收纯化试剂盒回收纯化PCR产物,产物再次电泳检测。
1.4.3 NDV F基因的克隆与鉴定 将回收纯化的F基因与pMD18-T载体进行连接,连接产物转化大肠杆菌DH5ɑ感受态细胞,于LB培养基中37 ℃培养过夜,挑取单克隆于含Amp的LB液体培养液中37 ℃振荡过夜,提取质粒DNA进行PCR鉴定。将阳性质粒送北京六合华大基因科技股份有限公司测序。
1.5 NDV F基因的分子遗传变异分析
采用DNA Star等软件,对分离株与国内外NDV参考株F基因序列进行分析,并绘制进化树[7-11]。
2 结果与分析
2.1 尿囊液血凝性检测结果
将无菌收集的鸡胚尿囊液经鸡红细胞悬液进行直接血凝试验测定。结果表明,尿囊液具有明显的血凝性。
2.2 NDV F基因的RT-PCR检测结果
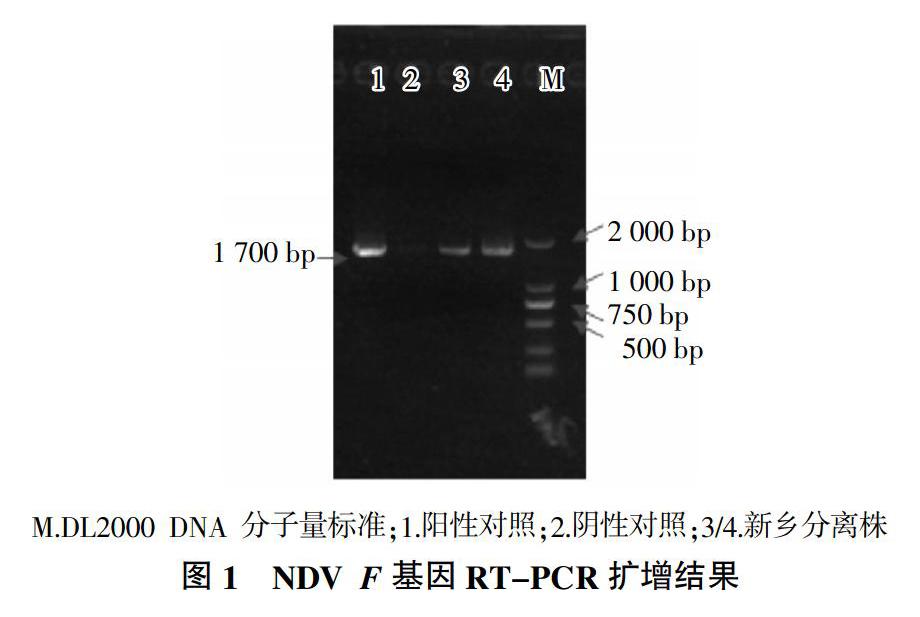
利用F基因特异性引物对尿囊液进行检测。结果表明,从尿囊液中扩增出1 700 bp的目的条带,与预期结果相符(图1)。
2.3 NDV F基因的序列测定及结果分析
由测序结果可知,该新城疫病毒分离株全长1 662 bp,其编码的氨基酸序列分析可知,其序列长度符合NDV病毒F基因序列长度,氨基酸裂解位点与NDV强毒株的特征相符。该毒株F蛋白裂解位点区的氨基酸序列为112R-R-Q-K-R-F117,在氨基酸序列101位和121位为赖氨酸(K)和缬氨酸(V),和基因Ⅶ NDV强毒株的特征性氨基酸一致。
2.4 核苷酸序列同源性及系统进化树分析
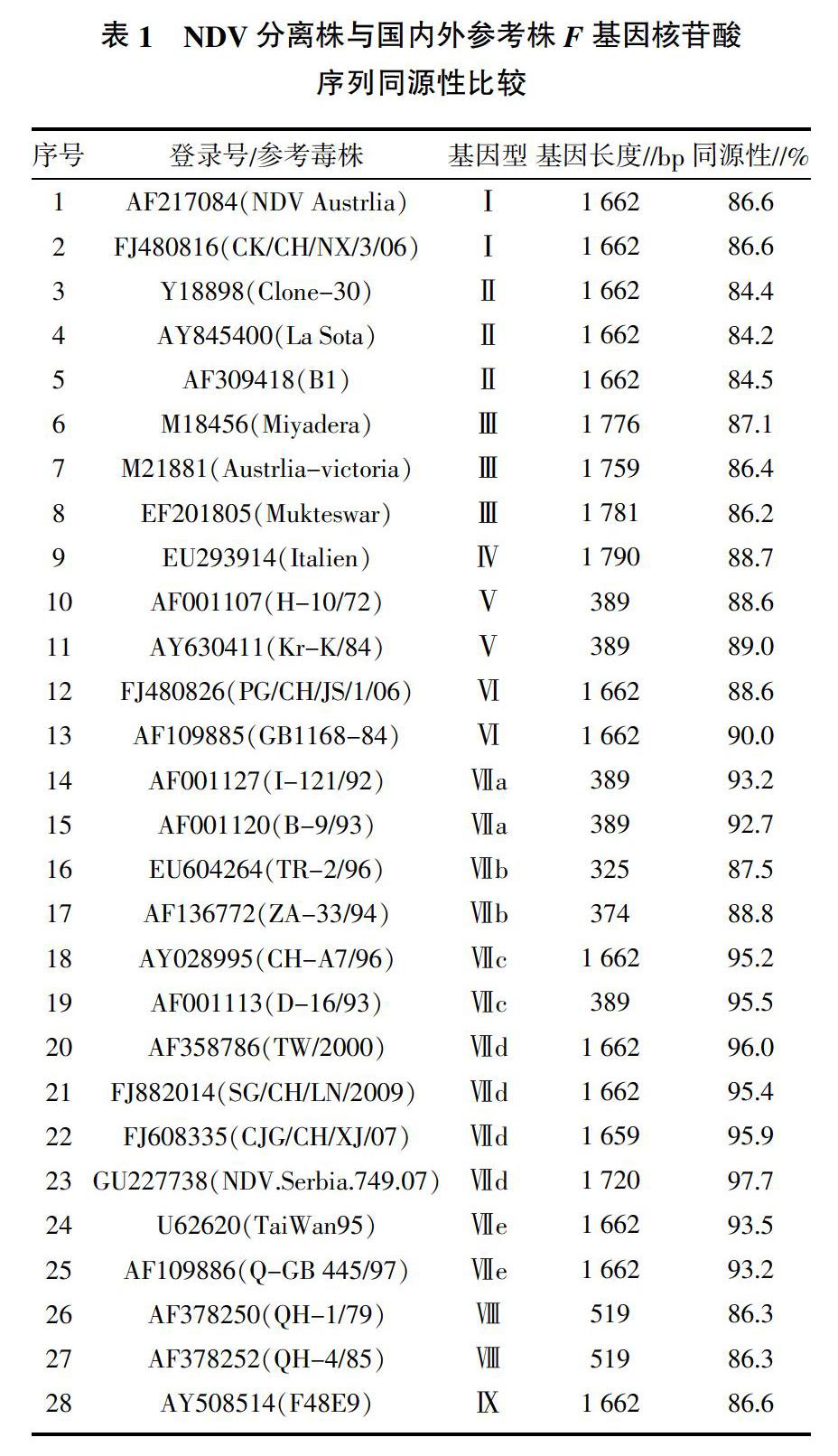
NDV分离株与国内外参考株F基因的核苷酸序列同源性在84.2%~97.7%(表1)。其系统进化树分析结果表明,分离株基因序列与基因Ⅶ型参考毒株同源性在87.5%~97.7%,其中与基因Ⅶd型的参考毒株同源性最高为95.4%~97.7%,处于同一分支(图2);而与现用疫苗株(La Sota、Clone-30、B1、Mukteswar等)之间的亲缘关系较远,同源性较低,在84.2%~86.6%之间。
3 讨论
F蛋白是NDV感染细胞所必需的,可以促进病毒囊膜与细胞膜的融合,从而使病毒穿入细胞膜,并脱去核衣壳进行复制。研究表明,NDV感染细胞的前提是F蛋白首先被裂解为F1和F2,而F蛋白能否被裂解,取决于F蛋白裂解位点(112-117aa)氨基酸组成和宿主细胞的特性,定点突变技术发现,F蛋白裂解区域的碱性氨基酸残基数决定了它的裂解能力和毒力,是区分毒力强弱的重要标志[12]。研究表明,所有强毒株的裂解位点一般为112R/K-R-Q-K/R-R-F117,弱毒株的裂解位点一般为112G/E-K/R-Q-G/E-R-L117[13-15]。序列分析表明,本研究分离的NDV毒株F基因的裂解位点氨基酸排列顺序为R-R-Q-K-R-F,是典型的强毒株裂解位点模式。通过NDV新乡分离株F基因的分子遗传进化分析表明,该强毒株属于基因Ⅶ型,且与国内流行的基因Ⅶd型毒株同源性高于95.4%,但是却与现用疫苗株之间的同源性较低,也是中国新城疫免疫效果差的原因。中国目前流行的新城疫毒株主要为基因Ⅶ型,而这其中基因Ⅶd型新城疫毒株发病率占60%[16-19]。通过本研究结果可知,新城疫新型疫苗的制备需筛选与当前流行株密切相关的毒株作为候选疫苗株,配合常规疫苗免疫,才能更好地控制新城疫的流行,进而减少对中国养禽业的危害。
参考文献:
[1] 秦卓明,马保臣,崔治中,等.新城疫病毒HN和F基因遗传变异相关性的研究[J].微生物学报,2006,46(2):227-232.
[2] WISE M G,SELLERSL H S,ALVAREZ R,et al. RNA-dependent RNA polymerase gene analysis of worldwide Newcastle disease virus isolates representing different virulence types and their phylogenetic relationship with other members of the paramyxoviridae[J].Virus research,2004,104:71-80.
[3] 王运湘,王珣章,余为一.新城疫病毒分子生物学研究进展[J].安徽大学学报,1997,24(3):320-322.
[4] CHAMBERS P,MILLAR N S,EMMERSON P T. Nucleotide sequence of the gene encoding the fusion glycopmtein of Newcastle disease virus[J].J Gen Virol,1986,67:2685-2694.
[5] RICHARDSON C D,SCHEID A,CHOPPIN P W. Specific inhibition of paramyxovirus and myxovirus replication by oligopeptides with amino acid sequences similar to those at the N-terminal of the F1 or HA2 viral peptidies[J].Virol,1980,105:205-222.
[6] COLLINS M S,STRONG I,ALEXANDER D J. Evaluation of the molecular basis of pathogenicity of the variant Newcastle disease virus termed pigeon PMV-1 viruses[J].Arch Virol,1994, 134(3-4):403-411.
[7] 嚴维巍,王永刊,田慧芳,等.一株鸡副黏病毒的分子特性研究[J].扬州大学学报:自然科学版,2000,3(1):27-31.
[8] 曹殿军,郭 鑫,梁 荣,等.我国部分地区NDV的分子流行病学研究[J].中国预防兽医学报,2001,23(1):29-32.
[9] 吴艳涛,倪雪霞,刘其全,等.我国部分地区不同动物来源新城疫病毒的分子流行病学研究[J].病毒学报,2002,18(3):264-269.
[10] 韩春元,王利勤,张三东.一株鸡新城疫病毒陕西分离株F基因的遗传进化分析[J].动物医学进展,2013,34(11):51-54.
[11] 沙依兰古丽,汪 萍,巴特力,等.鸡新城疫病毒新疆分离株F基因遗传进化分析[J].动物医学进展,2011,32(12):25-30.
[12] WATERS M G,HUGHSON F M. Membrane tethering and fusion in the secretary and endocytotic pathways[J].Traffic,2000,1:588-597.
[13] BENTZ J. Membrane fusion mediated by coiled coils:a hypothesis[J].Biophysical journal,2001,78:886-900.
[14] PEETERS B P,DE LEEUW O S,KOCH G,et al. Rescue of Newcastle disease virus from cloned cDNA:Evidence that cleavability of the fusion protein is a major determinant for virulence[J].J Virol,1999,73(6):5001-5009.
[15] MIRZA A M,IORIO R M. A mutation in the stalk of the NDV HN protein prevents triggering of the F protein despite allowing efficient HN-F complex formation[J].J Virol,2013, 87(15):8813-8815.
[16] YANG C Y,SHIEH H K,LIN Y L,et al. Newcastle disease virus isolated from recent outbreaks in Taiwan phylogenetically related to viruses(genotype VⅡ) from recent outbreaks in western Europe[J].Avian Dis,1999,43(1):125-130.
[17] 孙敏华,胡奇林.新城疫病毒分子流行病学研究进展[J].动物医学进展,2010,31(12):95-99.
[18] ZHANG S,WANG X,ZHAO C,et al. Phylogenetic and pathotypical analysis of two virulent Newcastle disease viruses isolated from domestic ducks in China[J].PLoS one,2011,6(9): e25000.
[19] WANG Z,LIU H,XU J,et al. Genotyping of Newcastle disease viruses isolated from 2002 to 2004 in China[J].Ann N Y Acad Sci,2006,1081:228-239.

