珍黄胃片质量标准提升的研究
1.广东省药品检验所,广东 广州 510663;2.南方医科大学,广东 广州 510080
珍黄胃片是在常用临床制剂“珍子王”基础上研制的中药复方制剂,在多年的临床应用中具有显著的治疗效果[1]。其处方系由大黄、三七、木香、珍珠层粉、碳酸钙等十味药组成,诸药配伍,有健胃行气、制酸止痛、止血生肌之功,可用于气滞血瘀、湿浊中阻所致的胃脘胀痛、纳差吞酸、慢性胃炎见上述症候者。珍黄胃片的现行质量标准收载于卫生部药品标准第十八册[2],检验项目仅包括:显微鉴别、2个化学反应鉴别以及以大黄对照药材和大黄酸、大黄素甲醚、大黄酚、大黄素对照品作为对照参照的大黄薄层色谱鉴别。对于由十种药味组合而成的中药复方制剂来说,质量标准过于简单,且缺少对处方中君药的定量检测项目,质量标准的可控性较差,有待进一步完善。欧国萍等[3]对珍黄胃片中的三七和木香进行了薄层色谱鉴别的研究,对于珍黄胃片质量标准的研究基础较为薄弱。研究采用回滴定的方法测定珍黄胃片的制酸力,用于检测其消耗过多胃酸的能力;采用高效液相色谱法,以大黄素和大黄酚为检测指标,建立方中主药大黄的定量测定方法。为完善珍黄胃片的质量标准提供可靠的技术支撑,对保障珍黄胃片的临床疗效具有重要的意义。
1 仪器与材料
1.1 仪器 1100 Infinity型高效液相色谱仪(Agilent Technologies色谱工作站,美国安捷伦公司);LC-10AT高效液相色谱仪(Lab Solution色谱数据处理软件,日本岛津公司);JulaboSW22恒温水浴摇床(德国优莱博);Sartorius PB-10酸度计(德国赛多利斯);Sartorius CP225D万分之一电子天平、Sartorius BT125D十万分之一电子天平(德国赛多利斯);KQ-300DA型数控超声波清洗仪(昆山市超声仪器公司)。
1.2 材料 大黄素(批号:110756-201512,含量以98.7%计),大黄酚(批号:110796-201621,含量以99.2%计)均购于中国食品药品检定研究院。25批次的珍黄胃片样品(规格:0.7 g/片)。氢氧化钠(NaOH)滴定液(0.1 mol/L,F=1.004)、氢氧化钠(NaOH)溶液(0.1 mol/L)、盐酸溶液(0.1 mol/L)均按中国药典2015年版通则8006要求制备;甲基橙指示液、溴酚蓝指示液均按中国药典2015年版通则8005要求制备;甲醇为色谱纯,水为超纯水;溴酚蓝、甲基橙均为分析纯,其它试剂均为分析纯。
2 方法与结果
2.1 制酸力
2.1.1 试验方法 取重量差异项下的本品,研细,取约0.18 g,精密称定,置250 mL的具塞锥形瓶中,精密加入盐酸滴定液(0.1 mol/L)50 mL,密塞,在37℃不断振摇1小时(振摇速度为150 r/min),放冷,滤过,精密量取续滤液25 mL,加溴酚蓝指示液6滴,用氢氧化钠滴定液(0.1 mol/L)滴定至溶液由黄色变为蓝紫色。
2.1.2 反应原理 CaCO3+2HCl→CaCl2+H2O+CO2↑,理论上每片最小消耗盐酸溶液(0.1 mol/L)的体积应为30 mL。
2.1.3 指示剂的选择 参考英、美、日等国家的药典,制酸力的终点指示常使用酸度计,并规定pH值在3.5时为终点[4]。试验用酸度计测定滴定终点,当pH值在3.5左右时突跃明显,故确定pH值在3.5时为滴定终点。根据指示液的变色范围,可选择甲基橙指示液或溴酚蓝指示液,但由于甲基橙指示液的终点突跃颜色不明显而溴酚蓝指示液的终点突跃颜色明显,且采用酸度计指示终点与采用溴酚蓝指示液指示终点时,样品制酸力测定的结果基本一致,故确定溴酚蓝指示液指示滴定终点。
2.1.4 取样量的考察 取重量差异项下的本品(样本09),研细,分别取0.18 g、0.35 g、0.70 g,精密称定,置250 mL的具塞锥形瓶中,按“2.1.1”项下的方法进行试验,测得制酸力的结果分别为36 mL/片、36 mL/片和35 mL/片,认为上述三种取样量对制酸力的测定结果无显著差异,但由于取样量为0.18 g时供试品溶液的底色较0.35 g和0.70 g浅,终点突跃颜色较明显,且消耗滴定液的量适中,故确定取样量为0.18 g。
2.1.5 振摇速度的考察 取重量差异项下的本品(批号:190109),研细,取0.18 g(共四份),精密称定,置250 mL的具塞锥形瓶中,精密加入盐酸滴定液(0.1 mol/L)50 mL,密塞,在37℃不断振摇30 min(振摇速度分别为50 r/min、100 r/min、150 r/min、200 r/min),放冷,按“2.1.1”项下的方法进行试验,测得制酸力的结果分别为34.8 mL/片、34.5 mL/片、35.5 mL/片和34.8 mL/片,认为上述四种振摇速度对制酸力的测定结果无显著差异,且当振摇速度为150 r/min时测得制酸力最大,故确定振摇速度为150 r/min。
2.1.6 振摇时间的考察 取重量差异项下的本品(样本09),研细,取0.18 g(共三份),精密称定,置250 mL的具塞锥形瓶中,精密加入盐酸滴定液(0.1 mol/L)50 mL,密塞,在37℃分别不断振摇30、60、90 min(振摇速度为150 r/min),放冷,按“2.1.1”项下的方法进行试验,测得制酸力的结果分别为35.8 mL/片、36.4 mL/片和36.6 mL/片,结果:当振摇时间为60 min时测得制酸力与90 min时的基本一致,故确定振摇是时间为60 min。
2.1.7 样品测定 照“2.1.1”项下的方法测定了12批样品的制酸力,结果见表1。

表1 12批样品的制酸力测定结果
2.2 含量测定
2.2.1 色谱条件与系统适用性试验 色谱柱:phenomenex luna C18(250 mm×4.6 mm,5 μm);流动相:甲醇-0.1%磷酸溶液(82∶18);检测波长:439 nm;流速:1.0 mL/ min;柱温:30 ℃;进样量为20 μL。理论板数按大黄素峰计算应不低于3000。
2.2.2 对照品溶液的制备 分别精密称取大黄素对照品和大黄酚对照品适量,加甲醇制成每1 mL含大黄素10 μg、大黄酚20 μg的混合溶液,即得。
2.2.3 供试品溶液的制备 取重量差异项下的本品,研细,取约3 g,精密称定,置具塞锥形瓶中,精密加入甲醇25 mL,称定重量,加热回流1 h,放冷,再称定重量,用甲醇补足减失的重量,摇匀,滤过,精密量取续滤液10 mL,置锥形瓶中,减压回收溶剂,加盐酸-水(1∶10)的混合溶液20 mL,超声处理5 min,再加二氯甲烷30 mL,加热回流1 h,放冷,置分液漏斗中,用少量二氯甲烷分次洗涤容器,并入分液漏斗中,分取二氯甲烷液,酸液用二氯甲烷振摇提取3次,每次20 mL,合并二氯甲烷液,减压回收溶剂至干,残渣加甲醇使溶解,转移至25 mL容量瓶中,加甲醇至刻度,摇匀,滤过,取续滤液,即得。
2.2.4 阴性样品溶液的制备 按珍黄胃片处方、工艺制备成缺大黄阴性样品,再按“2.2.3”项下方法制成缺大黄阴性样品溶液。
2.2.5 专属性考察 分别精密吸取对照品溶液、供试品溶液与阴性样品溶液各20 μL,按“2.2.1”项下的色谱条件注入液相色谱仪,记录色谱图,结果见图1,表明缺大黄阴性样品无干扰。
2.2.6 线性关系的考察 精密称取大黄素对照品10 mg、大黄酚对照品20 mg,置100 mL容量瓶中,加甲醇适量使溶解并至刻度适量,摇匀,得对照品储备液。分别精密吸取上述对照品储备液1、3、5、10、20 mL,置50 mL容量瓶中,加甲醇稀释至刻度,制成系列浓度的混合对照品溶液,分别吸取20 μL,按“2.2.1”项下色谱条件测定,以进样量(μg)(X)为横坐标,峰面积(Y)为纵坐标,绘制标准曲线(见图2),其线性回归方程为:大黄素y=1125183.4978x-212.2040,R2=1.0000;大黄酚y=1147555.0878x-2661.7684,R2=1.0000。结果表明:大黄素在0.0406~0.812 μg、大黄酚在0.0808~1.616 μg的范围内,线性关系良好。
2.2.7 精密度试验 精密吸取“2.2.2”项下的对照品溶液,按“2.2.1”项下色谱条件,连续进样6次,记录峰面积。结果:大黄素峰面积的RSD为0.15%(n=6),大黄酚峰面积的RSD为0.4%(n=6),表明仪器精密度良好。
2.2.8 重复性试验 取同一批样品(样本013),研细,取约3 g,共6份,精密称定,按“2.2.3”项下方法制备供试品溶液,按“2.2.1”项下色谱条件测定,结果:大黄素的平均含量为0.11874 mg/g,RSD为2.0%(n=6)、大黄酚的平均含量为0.70558 mg/g,RSD为1.5%(n=6),表明本方法重复性良好。
2.2.9 加样回收率试验 取已测定含量的样品(样本013)研细,取约1.5 g,共9份,精密称定,其中:低浓度3份精密加入每1 mL含大黄素3.16 μg、大黄酚19.82 μg的混合对照品溶液25 mL;中浓度3份精密加入每1 mL含大黄素6.33 μg、大黄酚40.00 μg的混合对照品溶液25 mL;高浓度3份精密加入每1 mL含大黄素9.50 μg、大黄酚57.29 μg的混合对照品溶液25 mL,按“2.2.3”项下的方法制成回收供试品溶液,按“2.2.1”项下的色谱条件测定,计算大黄素和大黄酚的回收率。结果见表2~3,表明本方法的准确度较好。
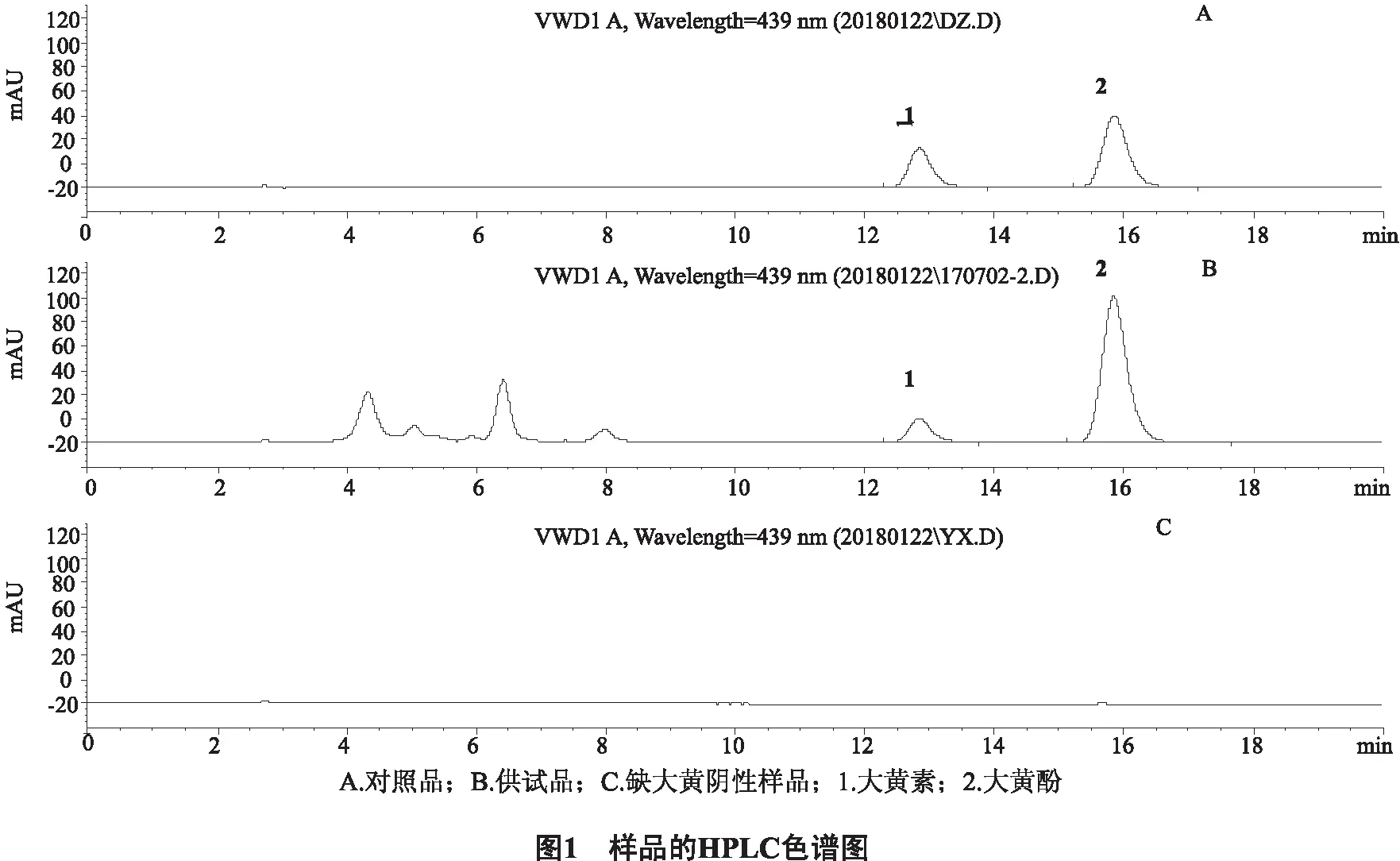
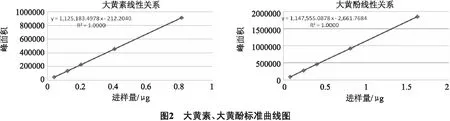
表2 大黄素准确度(加样回收)试验结果

序号供试品取量/g供试品含量/mg对照品加入量/mg实测结果/mg回收率/%平均值/%RSD/%11.50330.178500.25806100.5321.50360.178540.079140.2551496.79100.02.931.50050.178170.25936102.5941.50080.178200.3308096.4051.50310.178480.158290.3248192.4495.63.061.50330.178500.3336298.0071.50130.178260.4117298.3281.50020.178130.237440.41840101.19100.01.591.50190.178340.41726100.62
2.2.10 稳定性试验 取样品(样本016),按 “2.2.3”项下的供试品制备方法制成供试品溶液,精密吸取20 μL,按 “2.2.1”项下的色谱条件,分别在0、2、4、8、10和24 h,注入液相色谱仪测定其含量。结果:大黄素峰面积的RSD为0.9%(n=6);大黄酚峰面积的RSD为0.4%(n=6),表明样品在24 h内基本稳定。
2.2.11 样品测定 按上述的方法测定了25批样品中大黄素和大黄酚的总量,结果见表4。
表3 大黄酚准确度(加样回收)试验结果
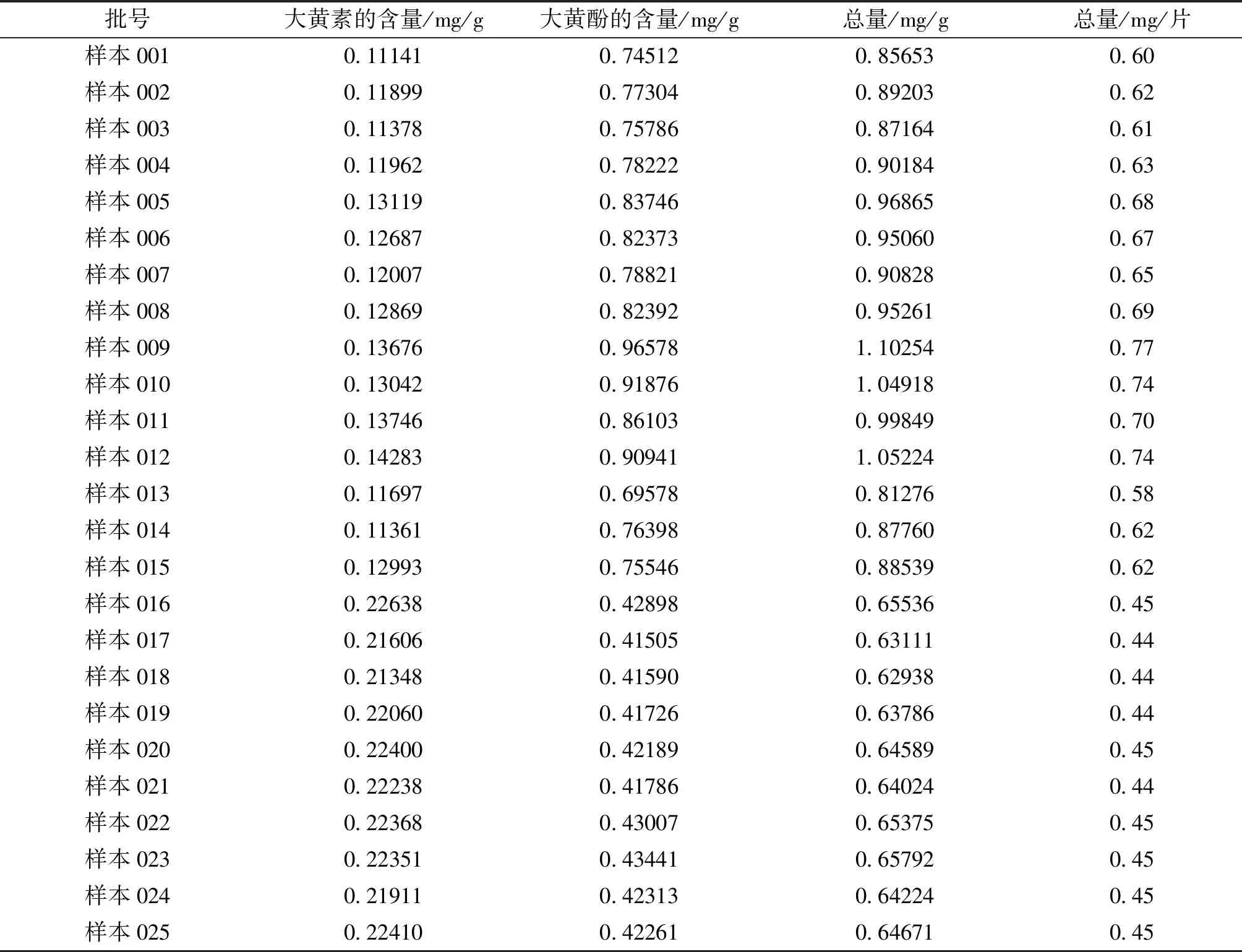
表4 25批样品的含量测定结果
3 讨论
3.1 制酸力 珍黄胃片为治疗胃酸过多的抗酸药,处方中珍珠层粉和碳酸钙具有制酸止痛的效果,通过与胃酸反应,减轻甚至消除过酸的胃液对胃黏膜的刺激和腐蚀作用,进而达到治疗胃溃疡或慢性胃炎中胃酸分泌过多的症状。检测抗酸药对胃酸的作用效果,限定药物对胃酸的中和能力,能够更好的保证抗酸药对于人体的用药安全和有效,避免出现碱血症、腹泻、便秘等副作用[4]。因此,制酸力检查项是一项对于抗酸类药物必不可少的检验项目。
3.2 含量测定
3.2.1 指标成分的选定 大黄为珍黄胃片处方中的主药,其具有泻下攻积,清热解毒等功效,含有多类活性成分,其中以蒽醌类、蒽酮类成分为主。王玲[5]研究表明,大黄中的蒽醌类化合物及其衍生物具有良好的止血、活血、抗溃疡、抗菌作用,孙冉[6]研究表明大黄中蒽醌类化合物及其衍生物对药效起作用的主要包含大黄素、大黄酚、芦荟大黄素、大黄酸和大黄素甲醚。其中大黄素具有抗炎、抑菌、抗病毒作用,对于胃肠道的炎症具备显著疗效,是检测大黄含量测定的常用组分之一[7]。大黄酚则是对多种细菌具有抑制作用,可促进肠管运动,对于清除胃溃疡或慢性胃炎患者胃肠道内多余的幽门螺杆菌具有显著效果,也是大黄中的常用检测指标成分[8]。基于上述原因,本次对于珍黄胃片中大黄含量测定的研究选定大黄素和大黄酚作为含量测定指标成分。
3.2.2 检测波长的确定 大黄素和大黄酚的紫外吸收光谱测定结果显示大黄素在439 nm 、288 nm、266 nm、253 nm波长处有最大吸收,大黄酚在430 nm、287 nm、277 nm、257 nm波长处有最大吸收,当选用439 nm为检测波长时,大黄素和大黄酚的检测灵敏度较高,杂质峰较少,基线平稳,杂质均不干扰测定,故选用439 nm为测测波长。
3.2.3 提取方法的选择 参考中国药典2015年版一部收载的“大黄”含量测定方法[9],采用25 mL甲醇作为提取溶剂,分别加热回流提取0.5 h、1 h、1.5 h,经比较加热回流1 h和1.5 h测得结果无明显差异,且高于0.5 h,故采用加热回流1 h的提取方法。
综上所述,建立的珍黄胃片的制酸力检查方法和主药大黄的定量检测方法操作简单,具有良好的重复性和准确性,且专属性强,能有效提高其质量可控性,为该品种质量标准的提高提供可靠的技术支持。

