NSCLC肿瘤及癌旁组织CD4+和CD8+T细胞PD- 1的表达及意义
袁 飞,王新乐,张 灿,吴显宁,徐美青
程序性死亡分子- 1(programmed death- 1,PD- 1)为B7家族新成员[1- 2],常表达于活化的T细胞、B细胞等表面。PD- L1为其配体之一,是由CD274基因编码的CD28/CTLA4家族的免疫抑制蛋白。PD- 1与肿瘤表面的PD- L1结合后,既可抑制T细胞活化信号,也可向激活的T细胞传导抑制信号,达到抑制T细胞杀伤功能的目的,从而在肿瘤的免疫逃逸中发挥重要作用[3- 4]。肿瘤抗原特异性T细胞无反应性及诱导凋亡是肿瘤免疫逃逸的主要机制,促进肿瘤的发生发展[5]。阻断PD- 1和PD- L1的结合可部分恢复T细胞功能,抗PD- 1/PD- L1单克隆抗体在多种肿瘤的治疗中也已显示出巨大优势,这使PD- 1/PD- L1信号通路的研究成为近年热点。该研究采用流式细胞技术分析检测79例非小细胞肺癌(non- small cell lung cancer,NSCLC)患者肿瘤组织和癌旁组织CD4+T细胞及CD8+T细胞表面PD- 1的表达水平,并分析其与患者临床病理特征的相关性,以期为肺癌的研究提供一定的参考依据。
1 材料与方法
1.1 病例资料选取2017年8月~2018年6月在安徽省立医院接受手术的NSCLC患者79例,其中男56例,女23例,年龄38~82(66.01±9.72)岁。均经术后病理检查证实。病理类型腺癌46例,鳞癌33例;肿瘤直径≤3 cm患者42例,>3 cm患者37例;病理分期I/II期56例,III期23例;有淋巴结转移29例,无淋巴结转移50例。患者均接受标准肺癌根治性手术;有完整临床资料;术前均未进行抗肿瘤治疗。取79例患者的肺癌肿瘤组织及对应的78例患者的肿瘤远端2 cm以上癌旁组织(其中1例癌旁组织标本损坏)待测。
1.2 仪器和试剂Attune NxT 流式细胞仪购自美国ThermoFisher公司;肿瘤消化仪、肿瘤消化试剂盒(货号:130- 095- 929)购自德国Milteny公司;红细胞裂解液(货号:R7757)购自美国Sigma公司;死活细胞鉴定染料(Fixable Viability Stain 780,FVS780,货号:565388)、Fc受体阻断剂(Human BD Fc Block,货号:564219)、流式缓冲液(Brilliant stain buffer,货号:563794)、转录因子和核蛋白试剂(Transcription Factor Buffer Set,货号:562574)购自美国BD公司。
1.3 方法
1.3.1肿瘤样本的处理 ① 手术采集的肿瘤样本称重、记录;② 根据肿瘤消化试剂盒的说明书操作,将肿瘤组织消化分解成单个细胞悬液;细胞悬液用70 μm滤网过滤后洗涤,1 400 r/min离心10 min,弃上清液;③ 加入红细胞裂解液(5 ml/g肿瘤)室温裂解红细胞3~5 min,用含血清培养基终止裂解红细胞;加入PBS充分洗涤及离心,弃上清液。
1.3.2流式染色 ① 加入培养基重悬细胞后用台盼蓝染色计数,记录细胞密度与活力;② 根据染色方案,每孔转移1×106个细胞入96孔V底板;③ 加入PBS充分洗涤及离心,弃上清液;④ 死活染料FVS780用PBS 1 ∶1 000稀释后每孔加入100 μl,室温避光放置10~15 min;加入PBS充分洗涤2次,4 ℃、1 400 r/min离心5 min,弃上清液;⑤ Fc受体阻断剂用流式缓冲液1 ∶200稀释后每孔加入100 μl,4 ℃避光孵育20 min;加入流式缓冲液充分洗涤及离心,弃上清液;⑥ 每孔100 μl加入对应的抗体混合物进行细胞膜染,4 ℃避光孵育40 min;加入流式缓冲液充分洗涤及离心,弃上清液;⑦ 根据染色方案,需要核内染色的样品孔用转录因子和核蛋白试剂进行固定、破膜与染色。加入破膜缓冲液充分洗涤及离心,弃上清液。最后加入流式缓冲液充分洗涤及离心,弃上清液;⑧ 细胞用4%多聚甲醛固定,4 ℃避光孵育30 min;加入流式缓冲液充分洗涤及离心,弃上清液;⑨ 每孔细胞加入200 μl流式缓冲液重悬,4 ℃避光储存,上流式机检测。

2 结果
2.1 NSCLC患者肿瘤组织与癌旁组织PD- 1+细胞及CD4+T细胞、CD8+T细胞表达水平比较肿瘤组织PD- 1+细胞占所有细胞百分比显著高于癌旁组织(P<0.01)。肿瘤组织CD4+T细胞、CD8+T细胞占肿瘤浸润淋巴细胞百分比均显著高于癌旁组织(P<0.01),见表1。
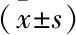

项目肿瘤组织癌旁组织t值P值PD-1+细胞(%)4.80±4.101.47±2.036.463<0.01CD4+T细胞(%)24.13±11.8711.94±8.137.514<0.01CD8+T细胞(%)15.25±8.9710.98±7.493.236<0.01
2.2 NSCLC患者肿瘤组织与癌旁组织CD4+和CD8+T细胞上PD- 1表达水平的比较肿瘤组织CD4+T细胞PD- 1表达水平显著高于癌旁组织(P<0.01)。肿瘤组织CD8+T细胞PD- 1表达水平较癌旁组织也显著增高(P<0.01),见表2、图1、2。
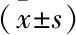
表2 PD- 1在肿瘤及癌旁组织T细胞表达水平比较
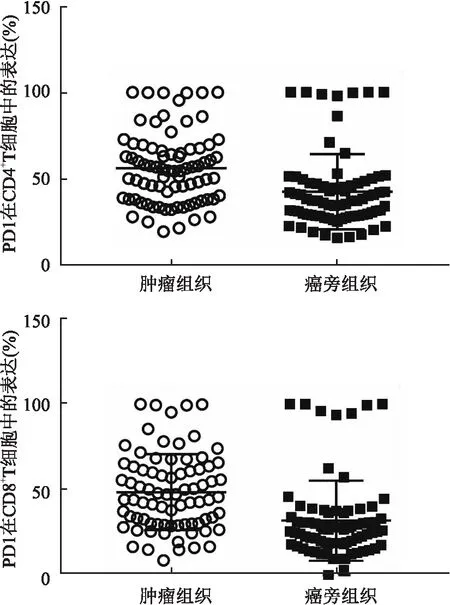
图1 PD- 1在肿瘤及癌旁组织T细胞表达水平散点图
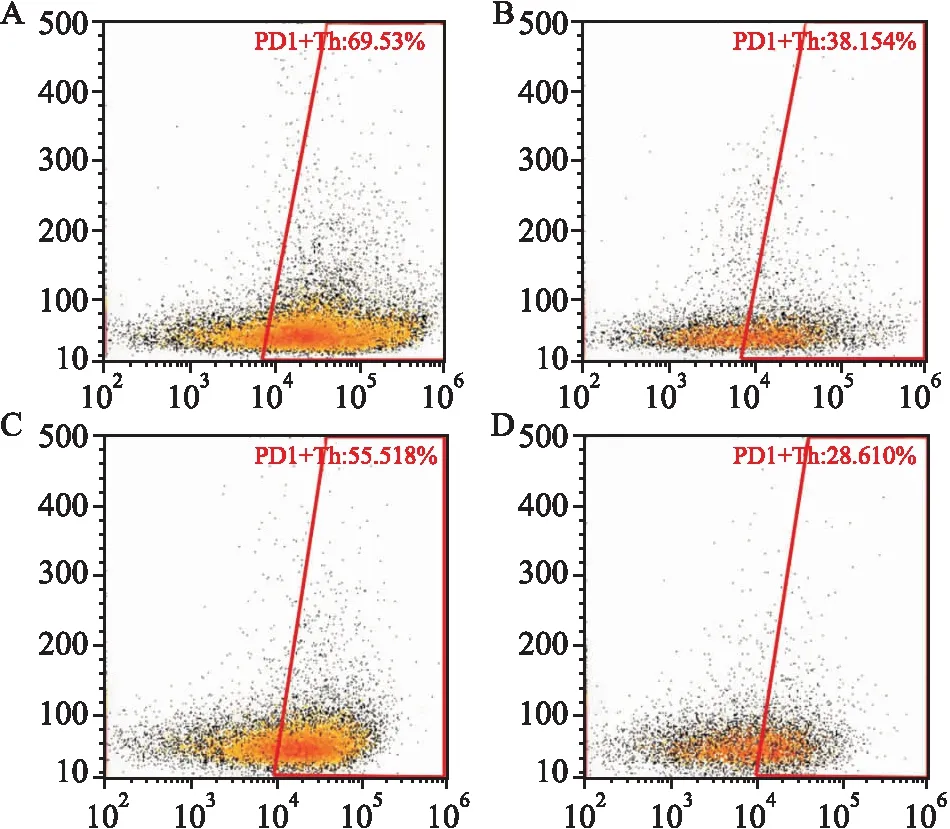
图2 PD- 1在肿瘤及癌旁组织T细胞表达水平流式细胞检测图
A:肿瘤组织CD4+T细胞中PD- 1表达情况;B:癌旁组织CD4+T细胞中PD- 1表达情况;C:肿瘤组织CD8+T细胞中PD- 1表达情况;D:癌旁组织CD8+T细胞中PD- 1表达情况
2.3 不同临床病理特征的NSCLC患者肿瘤组织CD4+和CD8+T细胞表面PD- 1表达水平的比较PD- 1在肿瘤组织中CD4+和CD8+T细胞的表达与性别、年龄、分期、有无淋巴结转移无关,差异无统计学意义(P>0.05)。PD- 1在肿瘤组织CD4+T细胞表达与肺癌病理类型无关,差异无统计学意义(P>0.05),PD- 1在肿瘤组织CD8+T细胞表达与病理类型有关,差异有统计学意义(P<0.05)。PD- 1在肿瘤组织中CD4+和CD8+T细胞的表达与肿瘤大小有关,差异有统计学意义(P<0.05),见表3。
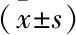
表3 肿瘤组织PD- 1表达水平与临床病理参数关系
3 讨论
NSCLC占原发性肺癌的85%以上[6],且发病率逐年上升,其发病原因与吸烟、环境污染、遗传等因素有关,但肺癌发生发展的机制目前仍不十分清楚。
恶性肿瘤的发生发展是多因素参与的复杂过程,肿瘤免疫抑制是其中重要一环,PD- 1与配体的结合在正常情况下可抑制自身免疫应答从而避免自身免疫性疾病的发生,当恶性肿瘤患者PD- 1表达水平升高并与其配体结合后可营造高度免疫抑制的肿瘤微环境,削弱机体的免疫应答,并可分泌抑制性分子,同时介导负性共刺激信号达到免疫逃逸目的[7],从而促进肿瘤的发生发展。近年来有研究显示,在一些恶性肿瘤组织中,PD- 1表达明显高于相对应的癌旁组织,恶性肿瘤患者外周血PD- 1较健康人表达也明显升高,提示了PD- 1在恶性肿瘤的发生发展中可能起重要作用。吕淑贞 等[8]对93例乳腺癌肿瘤组织标本PD- 1的表达进行检测,并对生存期进行随访,结果表明,PD- 1在癌组织中表达阳性率明显高于癌旁组织,且PD- 1阳性表达患者术后生存时间低于PD- 1阴性患者,表明PD- 1高表达可能与乳腺癌的发生发展及不良预后有关。张峰 等[9]报道食管癌组织中PD- 1阳性表达率高于癌旁组织,PD- 1阳性表达率与肿瘤大小、淋巴转移有关。针对于NSCLC,采取外周血并应用免疫组化法检测患者CD4+和CD8+T细胞PD- 1表达水平的研究有相关文献报道,其结果与乳腺癌、食管癌等研究结果基本一致[10],但应用流式细胞术直接检测肺癌肿瘤标本的研究较少,相对于外周血检测,本研究能够更加直接的反映肿瘤微环境中的状态,结果显示,NSCLC患者肿瘤组织CD4+T细胞和CD8+T细胞上PD- 1表达水平显著高于癌旁组织,表明肿瘤可能通过诱导PD- 1高表达抑制肿瘤组织的CD4+T细胞和CD8+T细胞的功能,营造低免疫状态的肿瘤微环境,从而有利于肿瘤的发生发展。本研究同时发现肿瘤>3 cm患者PD- 1表达水平显著高于肿瘤≤3 cm患者,关于肿瘤大小与PD- 1的关系,Huang et al[11]相关研究表明,尽管PD- 1疗法在人类黑色素瘤中取得了成功,但是部分患者没有明显获益,这些患者的治疗失败不仅仅是不能诱导免疫恢复,而是由于T细胞恢复和肿瘤负担之间的不平衡。与治疗前肿瘤负担相关的循环CD8+T细胞再生程度与临床反应相关,结合本研究表明,肿瘤大小影响PD- 1表达水平,同时亦是影响PD- 1抗体免疫治疗效果的因素之一。另外,本研究发现肺鳞癌CD8+T细胞表面PD- 1表达高于肺腺癌,而在CD4+T细胞上的表达与病理类型无关,提示肺鳞癌细胞对于直接杀伤肿瘤的细胞毒性T细胞即CD8+T细胞的抑制强于肺腺癌,目前,相关研究报道不多,进一步的探索或许对于免疫治疗有一定参考价值。PD- 1表达水平与性别、年龄、分期及淋巴结转移无关。
综上所述,PD- 1在NSCLC患者肿瘤组织T细胞表面高表达,参与肿瘤的免疫逃逸,促进肿瘤的发生发展,其与肿瘤大小等临床因素有关,这些可能为肺癌的研究提供一定的参考依据。

