不同实验方法对5种绿绒蒿种子萌发的影响研究
严朋飞, 冷秋思, 李斯濛, 万星月, 屈 燕, 区 智
(西南林业大学园林园艺学院, 昆明 650224)
种子萌发是植物生命中非常重要的过程[1]。绿绒蒿为罂粟科中绿绒蒿属(Meconopsis)植物的总称,全属共49种, 中国有38个种,该属建立于1814年,属于北温带植物区系成分[2]。绿绒蒿是颜色十分丰富且花大色艳的高山野生花卉,人称“高山牡丹”,是云南八大名花之一,欧洲人推崇为“世界名花”,也是传统的藏医药用植物[2]。目前,绿绒蒿属植物大多数种已经处于濒危状态[2]。绿绒蒿大部分种类都存在相似的休眠方式。GA3可以促进种子发芽,所以一般利用GA3提高绿绒蒿种子的发芽率[3]。在每天10 h的光照以及(20±2) ℃的条件下,用100 mg·L-1的GA3处理能有效提高锥花绿绒蒿和单叶绿绒蒿种子的萌发率[2]。王朝文等[4]研究了不同温度条件对总状绿绒蒿种子萌发特性的影响,结果表明,GA3能明显加快种子的萌发进程。另有研究表明,采用不同浓度赤霉素处理不同的总状绿绒蒿居群,对种子萌发有不同程度的影响[5]。但是不同预处理对多刺绿绒蒿(M.horridula)、总状绿绒蒿(M.racemosa)、贝利叶绿绒蒿(M.baileyi)、尼泊尔绿绒蒿(M.napaulensis)以及草甸绿绒蒿(M.prattii)5种绿绒蒿种子萌发差异性的研究还未见文献;而采用MS基本培养基对绿绒蒿属植物进行种子萌发的研究也很少,尤其是探究不同浓度基础培养基对绿绒蒿属植物种子萌发差异性的研究还未见报道。绿绒蒿种子在自然条件下萌发存在很多问题[6],而植物组织培养是实现苗木快繁以及规模化生产的主要途径之一[7]。如果可以利用植物组织培养技术诱导其高频率萌发,获得大量试管苗,这将为绿绒蒿可持续利用奠定基础[8]。本研究以多刺绿绒蒿、总状绿绒蒿、贝利叶绿绒蒿、尼泊尔绿绒蒿以及草甸绿绒蒿5种绿绒蒿种子为试材,探讨不同实验方法对绿绒蒿种子萌发特性的影响。
1 材料和方法
1.1 材 料
试验中所用的多刺绿绒蒿种子采自云南德钦白马雪山,总状绿绒蒿种子采自云南丽江玉龙雪山,而贝利叶绿绒蒿、尼泊尔绿绒蒿以及草甸绿绒蒿种子采自英国爱丁堡皇家植物园。种子在实验室自然干燥后除去杂质。
1.2 2种前处理实验方法
随机选取5种绿绒蒿种子各150粒,每30粒作为1个重复。种子用0.1%过氧化氢浸泡30 s后,蒸馏水清洗数遍。 1)赤霉素(GA3)前处理:在150 mg·L-1GA3中浸泡24 h后,经蒸馏水清洗数遍,放置在铺有2层润湿滤纸的培养皿中; 2)暗处理:放置在铺有2层润湿滤纸的培养皿中,暗处理48 h; 3)对照(ck):不经任何前处理,放置在铺有2层润湿滤纸的培养皿中。随后均置于培养箱中进行模拟自然条件下的种子萌发实验[9]。模拟自然条件进行培养箱条件设定(见表1)。
表1 培养箱模拟自然条件的光照、温度和湿度设定

条件 时 间00:0003:0006:0009:0012:0015:0018:0021:00光照/lx00200020002000200020000温度/℃1515152020202010湿度/%7575757575757575
1.3 不同浓度培养基对多刺绿绒蒿种子萌发的影响
蒸馏水加入6 g琼脂、30 g蔗糖以及基本培养基(MS、1/2 MS、1/3 MS),pH值调至5.8±0.2,然后放入高压灭菌锅中灭菌,时间设定为25 min,温度设定为121 ℃。随机选取多刺绿绒蒿种子300粒,每个处理100粒,每25粒作为1个重复。种子采用0.1%氯化汞浸泡7 min,再用蒸馏水漂洗5次后接入培养基中,于培养箱中进行模拟自然条件下的种子萌发实验。
1.4 数据统计与处理
每隔24 h记录种子的发芽情况,以根长等于种子长度为发芽标准,分别计算种子的发芽指数、发芽率、发芽势、平均发芽时间和发芽启动时间[9]。
发芽势为种子发芽达到高峰期时正常发芽种子数与供试种子总数的百分比,本实验发芽高峰的时间为第20天,即。
发芽势(%)=(第20天发芽种子数/供试种子总数)×100%。
发芽率为种子萌发结束时所有发芽种子数占供试种子总数的百分率。本萌发试验共用时间60 d,即:
发芽率(%)=(已发芽种子数/供试种子总数)×100%。
发芽指数=∑Gt/Dt;Gt为t日发芽数,Dt为相应天数。
平均发芽时间=∑D×n/∑n;D为从种子置床起算的天数;n为相应各天的发芽粒数。
平均发芽时间是指供试种子发芽所需的平均时间。
平均发芽速度是衡量种子发芽快慢的一个指标,其值越小,表示种子发芽迅速,发芽能力强。
试验中所有的数据处理都用SPSS 19.0软件完成,显著水平为p<0.05[9]。
2 结果和分析
2.1 2种前处理对5种绿绒蒿种子萌发的影响
种子质量的常规检验指标是发芽率和发芽势,而发芽指数既反映发芽率高低又反映种子的发芽速度[10]。由图1可见,经GA3浸种处理的多刺绿绒蒿、总状绿绒蒿和草甸绿绒蒿的发芽率、发芽势明显低于对照处理的种子(p<0.05)(见图1),其中发芽率降低5.3%~13.8%,发芽势降低0.6%~2.7%。同时平均发芽时间均比对照组处理的种子长1~3 d,发芽启动时间均比对照组处理的种子长1~2 d。尼泊尔绿绒蒿在对照组处理和150 mg·L-1GA3处理下发芽率均不足10%,在GA3浸种处理下,发芽率、发芽势和发芽指数较对照处理均无显著差异(p>0.05)(见图1),发芽启动时间明显延后13 d,平均发芽时间则延长11 d。而150 mg·L-1GA3处理对贝利叶绿绒蒿种子发芽有促进作用,其发芽势明显高于对照处理种子(p<0.05)(见图1),发芽启动时间较对照处理提前3 d,GA3处理下的种子平均发芽时间缩短6 d。
在暗处理条件下,多刺绿绒蒿、总状绿绒蒿、尼泊尔绿绒蒿以及草甸绿绒蒿的种子发芽率、发芽势均高于对照处理的种子(见图1),其中发芽率增加4%~28.7%,发芽势增加0.7%~17.4%,发芽指数增加0.06~1.64。同时平均发芽时间均比对照组处理的种子缩短1~3 d,发芽启动时间均比对照组处理的种子缩短2~6 d。尼泊尔绿绒蒿种子在暗处理条件下仍低于20%。虽然在暗处理下,发芽率和发芽指数均为最高,但发芽启动时间延后4 d,平均发芽时间延长2 d。而贝利叶绿绒蒿暗处理下,发芽率低于对照处理种子,
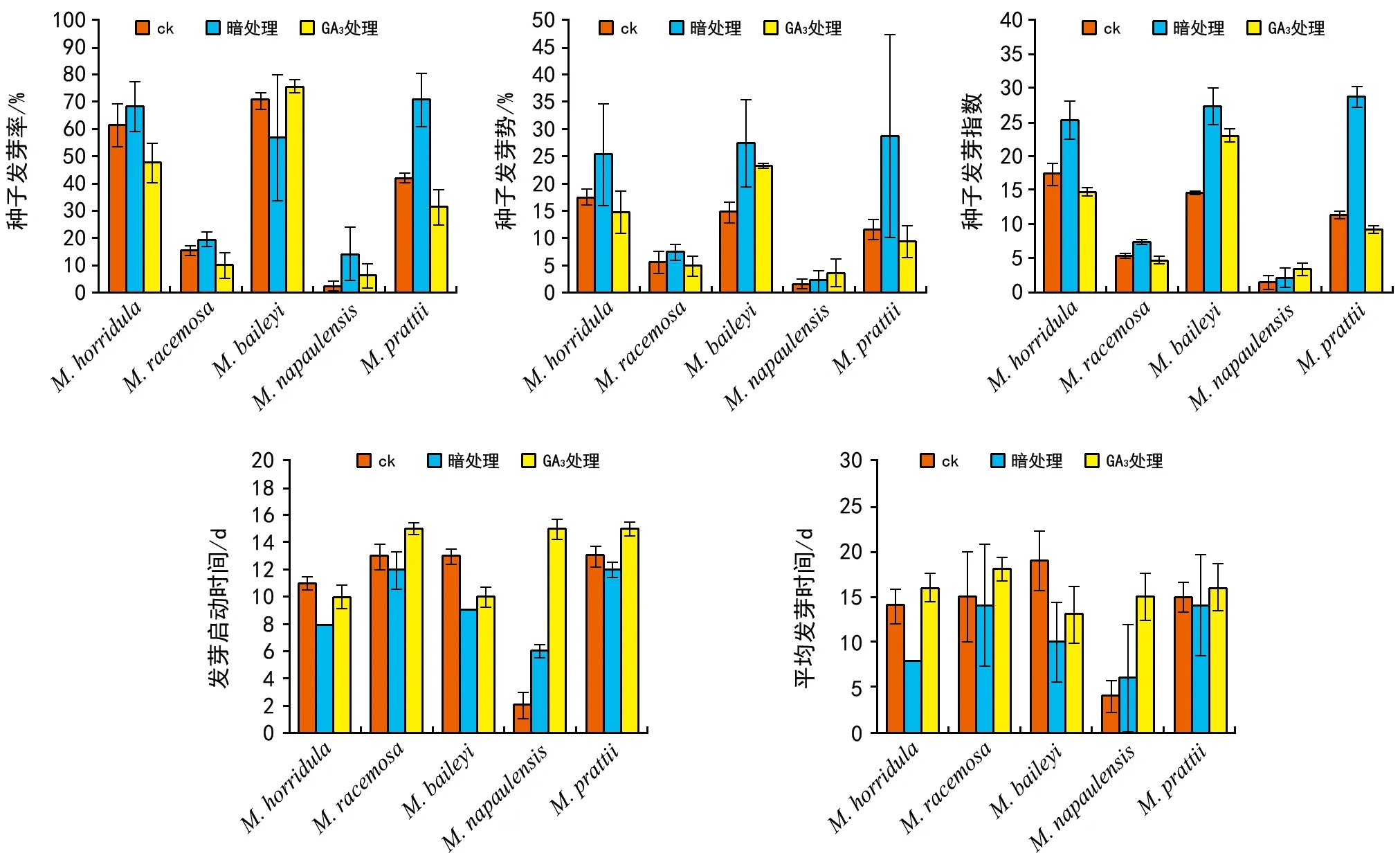
图1 2种前处理下5种绿绒蒿种子的萌发特性
但发芽势和发芽指数均显著高于对照(p<0.05)(见图1),发芽启动时间和平均发芽时间明显缩短。
2.2 不同培养基对多刺绿绒蒿种子萌发的影响
多刺绿绒蒿种子在1/2 MS培养基条件下,其发芽率高于对照处理种子8.7%;在MS培养基和1/3 MS培养基条件下明显低于对照组种子发芽率(p<0.05)(见图2),其发芽率降低17.1%~29.7%。
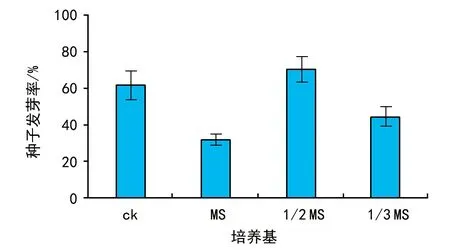
图2 不同培养基对多刺绿绒蒿种子萌发的影响
3 讨 论
有关GA3可以促进种子萌发、打破种子休眠的报道较多[11-15],GA3可通过诱导种子内部的淀粉酶等水解酶的合成促进种子萌发[5],可通过代替低温层积打破种子休眠,提早种子发芽[16]。暗处理会诱导植物进入衰老阶段[17],植物衰老是一系列复杂有序的过程,包括叶绿素降解、光合活性降低、蛋白质降解、脂质过氧化反应增加、与衰老相关的酶活性的增强[18-20]。本试验表明:经150 mg·L-1GA3浸种处理的4种绿绒蒿(除贝利叶绿绒蒿以外)种子萌发较对照处理差。在暗处理条件下,这4种绿绒蒿种子的发芽率、发芽势和发芽指数均有不同程度的提高,发芽启动时间和平均发芽时间均有不同程度的缩短。贝利叶绿绒蒿种子萌发在150 mg·L-1GA3处理下得到促进,但并没有形成显著差异,同时种子的发芽指数有所提高,发芽启动时间和平均发芽时间都明显缩短。绿绒蒿种子萌发经暗处理的总体效果优于150 mg·L-1GA3处理下的发芽情况。
研究表明,GA3浸种处理对种子萌发有促进作用。但是屈燕等研究发现,不同居群的总状绿绒蒿种子对GA3处理的反应是有差异的[9];本研究结果显示,150 mg·L-1GA3没有明显的促进这5种绿绒蒿的种子萌发,这可能是由于不同浓度的GA3对不同种绿绒蒿种子的处理效果存在差异。
本研究表明,在5个种中,多刺绿绒蒿、总状绿绒蒿和草甸绿绒蒿同属于Cumminsia亚属,较之另外2种,贝利叶绿绒蒿(Grandes亚属)和尼泊尔绿绒蒿(Meconopsis亚属)的萌发情况综合情况最好,发芽率较高,且平均发芽时间短。虽然同一亚属的种子的萌发情况较一致,但是同属性的种子之间的萌发情况也可能存在一定的差异,还有待对该属的其它种进行更全面的研究。
总之,本研究中在暗处理下对绿绒蒿种子萌发有促进作用,150 mg·L-1GA3处理一定程度抑制多刺绿绒蒿、总状绿绒蒿和草甸绿绒蒿种子的萌发,但能促进贝利叶绿绒蒿种子的萌发。绿绒蒿属植物种子的萌发特性与不同种类和不同浓度的植物生长调节剂之间的关系有待进一步研究。

