丝素肽络合Ca2+含量影响细胞生长的研究
魏如男 王富平 张媚 陈忠敏

摘要: 研究丝素肽(SFP)络合Ca2+含量对人正常肝细胞L02生长的影响。采用CaCl2-乙醇-水三元体系制备丝素蛋白(SF),并获得不同Ca2+含量的SFP后进行相对分子质量分级;采用EDTA滴定法测定SFP中Ca2+含量,细胞增殖率评价其细胞毒性,圆二色谱(CD)检测二级结构。结果表明:随透析时间(12、24、36h)增加,SFP中Ca2+含量分别为16.00%、9.60%、0.40%,逐渐减小,对L02的生长作用由促进转变为抑制,其中在SFP相对分子质量大于8kD时尤为明显,L02细胞增殖率从(11868%±3.65%)减小到(59.78%±1.70%),对应SFP二级结构中3.43%的α螺旋和5.35%的无规则卷曲转变为β折叠。当SFP应用于组织工程支架领域时,络合较高Ca2+含量的SFP更有利于细胞的增殖。
关键词: 丝素肽;钙离子含量;细胞生长作用;相对分子质量;二级结构
中图分类号: R318.08
文献标志码: A
文章编号: 1001-7003(2019)03-0007-05
引用页码: 031102
Study on the effect of silk fibroin peptide complex Ca2+ content on cell growth
WEI Ru’nan, WANG Fuping, ZHANG Mei, CHEN Zhongmin
(College of Pharmacy and Bioengineering, Chongqing University of Technology, Chongqing 400054, China)
Abstract: The effects of silk fibroin peptide (SFP) complex Ca2+ content on the growth of human normal hepatocyte L02 were studied. The CaCl2-ethanol-water system was used to prepare silk fibroin (SF), and SFP with different Ca2+ content was obtained. Then, the relative molecular mass of SFP was classified. The content of Ca2+ in SFP was measured by EDTA titration. The cytotoxicity of L02 cells was evaluated by the proliferation rate, and circular dichroism (CD) was used to detect the secondary structure of SFP. The results show that as the time of dialysis (12, 24, 36h) increased, Ca2+ content of SFP (16.00%, 9.60%, 0.40%) gradually decreased, and the growth of L02 changed from promotion to inhibition. Especially when the relative molecular mass of SFP was greater than 8kD, the cell proliferation rate of L02 decreased from (118.68%±3.65%) to (59.78%±1.70%). In the secondary structure of the corresponding SFP, 3.43% of alpha-helix and 5.35% of irregular curl transformed to beta-folding. In the field of tissue engineering scaffolds, SFP with higher content of complex Ca2+ is more conducive to cell proliferation.
Key words: silk fibroin peptide; Ca2+ content; cell growth; relative molecular mass; secondary structure
收稿日期: 2018-07-05;
修回日期: 2019-01-10
基金項目: 重庆市基础与前沿研究计划项目(cstc2014jcyjA10018)
作者简介: 魏如男(1994),女,硕士研究生,研究方向为生物材料、功能高分子材料。通信作者:陈忠敏,教授,chenzhongmin@cqut.edu.cn
丝素蛋白(silk fibroin, SF)具有缓慢且可控的生物降解性,良好的生物相容性,能促进多种细胞的黏附、生长和增殖,现已广泛应用于组织工程支架材料[1]。支架材料中SF在体内生理环境下主要通过酶解的方式降解为游离氨基酸和小分子的丝素肽(silk fibroin peptide, SFP)[2],被细胞新陈代谢利用,对细胞增殖起到了提供营养物质的作用[3],即SFP具有生长因子相似的作用,作为生物材料呈现出较为优秀的应用价值。
但是,近年来有一些研究发现了丝素蛋白生物相容性方面有争议的一面,如黄慧明等[4]研究发现SFP可抑制人胰腺癌细胞SW1990生长,Yamada H等[5]发现SFP可促进成纤维细胞的生长,在其对细胞生长影响方面两者存在争议。本课题组也发现SFP可抑制人肝癌细胞HepG2生长,且存在浓度依赖性[6],同时,将SFP应用于肝脏组织工程支架中显示,SFP有促进HepG2细胞生长的作用[7]。分析认为:SFP对细胞生长影响与其结构有关,而SFP由SF酶解获得,是一种混合物,其结构及其相对分子质量大小分布因提取方式、处理(如温度、pH值变化、有机溶剂处理、金属离子作用及应力作用等)存在较大差异,从而影响了其对细胞的作用。研究表明:随着肽段分子链的加长,丝素的二级结构中无规则卷曲减少,α螺旋增加[8]。SF极易受外界条件影响,二级结构易由无规则卷曲向折叠结构的构象转变[9],如甲醇可使SF中的无规则卷曲或Silk Ⅰ结构向β折叠转变[10];pH值改变可致丝素蛋白从无规线团到折叠结构转变[11]。在采用CaCl2-乙醇-水三元体系再生SF时,随着时间的延长,Ca2+与SF分子内部的氢键和范德华力等作用并将其破坏,与丝氨酸(Ser)、酪氨酸(Tyr)侧链羟基进行配位形成螯合物,致分子构象由β折叠向无规线团转变[12],因此,Ca2+含量不同,SF二级结构存在一定差异。
在SFP制备过程中会大量使用Ca2+,Ca2+可通过透析除去,SFP中Ca2+含量差异与透析时间相关。由于Ca2+络合作用力和透析的渗透压平衡,所得SFP中仍然存在一定含量的Ca2+,Ca2+含量与SFP的二级结构存在相关性[13],同时会影响酶切位点。因此Ca2+含量可能会影响SFP的相对分子质量大小分布及其结构,从而导致其对细胞作用存在差异。而相关研究尚未见报道,因此通过对透析时间的控制来获得不同络合Ca2+含量的SFP,利用卷式膜将其分为不同相对分子质量级别,基于肝脏组织工程中有使用人正常肝细胞作为种子细胞的研究[14]。所以利用L02对其进行细胞毒性评价,并用圆二色谱(circular dichroism, CD)进行二级结构的分析,从而分析SFP络合Ca2+改变SFP二级结构后对细胞生长作用的影响。
1实验
1.1材料和试剂
茧壳(重庆市纤维织品检验所),卷式膜小型实验机JM18812-1、卷式超滤膜元件PA-NF-1812,PA-NF8-1812,PES3-1812,PES8-1812(大连屹东膜工程设备有限公司),细胞培养箱(FORMA3111,美国Thermo公司),酶标仪(Multiskan GO,美国Thermo公司),圆二色谱仪(英国APL Chiascan),透析袋(USA進口分装,标定截留相对分子质量MW为8000~14000),中性蛋白酶(酶活力20×104U/g,南宁庞博生物有限公司),人正常肝细胞L02(上海中乔新舟生物科技有限公司),胎牛血清(杭州四季青生物工程材料有限公司),RPMI-1640培养基、DMEM培养基、HyClone(赛默飞世尔生物化学制品有限公司),氨苄青霉素、硫酸链霉素、MTT(北京Solarbio生物科技有限公司),所用试剂Na2HPO4·2H2O、KH2PO4、二甲亚砜(DMSO)、EDTA-2Na等均为分析纯(市售)。
1.2不同相对分子质量Ca2+-SFP的分级制备
选用中等级蚕茧除杂后,置于Na2CO3溶液(0.4mg/mL)沸煮2.5h,浴比1︰25,水洗干净,烘干得到纯丝素;将纯丝素置于CaCl2-C2H5OH-H2O(摩尔比为1︰2︰8)三元体系溶液中于80℃溶解30min,冷却至室温,抽滤;将滤液置于透析袋中(截留相对分子质量为8kD~14kD),每隔12h换一次蒸馏水,分别透析12、24h和36h,得到不同Ca2+浓度的丝素溶液;采用卷式膜实验机浓缩丝素溶液后,按照m纯丝素︰m中性蛋白酶=20︰1在pH值为6.0~7.0条件下55℃水浴酶解1.5h;卷式膜实验机将丝素溶液分为2kD以下、2kD~3kD、3kD~5kD、5kD~8kD、8kD以上的不同相对分子质量丝素溶液;真空冷冻干燥获得各相对分子质量Ca2+-SFP,密封保存备用[15]。
1.3Ca2+含量检测
采用GB/T7476—1987《水质钙的测定EDTA滴定法》,用移液管分别移取透析12、24、36h丝素蛋白溶液50.00mL,置于250mL锥形瓶中,再加入2mL10%氢氧化钠溶液,摇匀后加钙指示剂少许(约0.1g),用0.01mol/L EDTA-2Na溶液滴定至溶液由酒红色变为纯蓝色,记录EDTA-2Na溶液的用量,滴定3次取平均值。并按照下式计算Ca2+浓度:
X=C×V1×MV2×1000(1)
式中:X为水样的钙离子含量,mg/L;M为CaCO3的摩尔质量,g/mol;C为EDTA标准溶液的摩尔浓度,mol/L;V1为滴定时消耗的EDTA标准溶液的体积,mL;V2为所取水样的体积,mL。
1.4细胞生长性能检测
L02用RPMI-1640培养基培养。用完全培养基配制质量浓度为4mg/mL的SFP溶液,采用过滤除菌法(微孔滤器,220nm,Millipore,Ireland)处理后,再稀释为质量浓度2mg/mL和1mg/mL的SFP水溶液。待细胞生长适宜后,用血球计数板将细胞浓度分别调整为3×104个/mL,以每孔100μL加入到96孔板(Corning,USA)中,过夜待细胞贴壁后,每孔加入100μL制备好的含不同质量浓度的SFP培养基,空白对照组加100μL完全培养基。实验组每组设置3个复孔,于37℃、5%CO2细胞培养箱中培养,于培养1、2、3、4、5d后每天采用MTT法检测细胞的活性:每孔加20μL MTT溶液,于37℃、5%CO2细胞培养箱中继续培养4h后,弃去96孔板中的液体,每孔加入100μL DMSO,使用酶标仪震荡10min,然后检测其在490nm处的吸光值。并按照下式计算相对增殖率RGR:
RGR/%=实验组吸光值对照组吸光值×100(2)
1.5圆二色谱检测
采用圆二色谱仪测试相对分子质量8kD以上Ca2+含量为16.00%、9.60%、0.40%的SFP的二级结构,测试条件为能带宽度1nm,响应1s,波长190~260nm,扫描速度500nm/min。
1.6统计学处理
使用IBM SPSS Statistics 19进行统计学分析,实验结果用平均数±标准差(x±s)表示,组间两两比较采用单因素方差分析方法,以P<0.05判定差异有统计学意义。
2结果与分析
2.1Ca2+含量检测
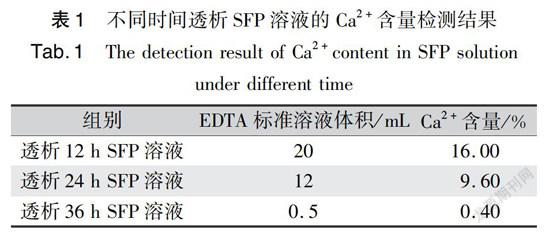
采用水质钙的测定EDTA滴定法(表1),测得并计算得到透析12h的SFP中Ca2+含量为16.00%,透析24h的SFP中Ca2+含量为9.60%,透析36h的SFP中Ca2+含量为0.40%。统计学分析,透析12、24、36h的SFP的Ca2+含量之间存在显著性差异。在透析过程中,随着时间的延长,与丝素蛋白质中酪氨酸、丝氨酸等进行配位络合的Ca2+解离,然后沿浓度梯度扩散透出透析袋,在不更换透析外液情况下,开始时Ca2+含量和透析袋内外浓度差较大,前15h的Ca2+会快速解离,后期变化逐渐减小,30h后SFP中Ca2+含量趋于恒定[16],但本实验中通过每隔12h更换透析外液,可使在透析36h时SFP中Ca2+几近透出。
2.2各相对分子质量级别SFP对L02生长的影响
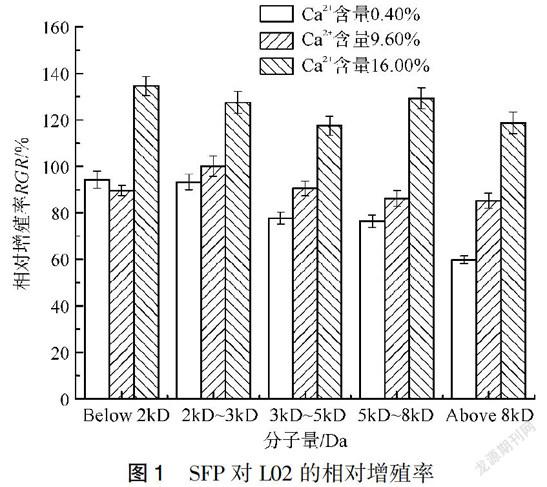
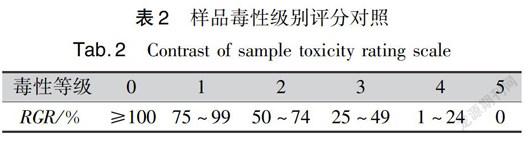
SFP溶液质量浓度0.5mg/mL时(图1),SFP中Ca2+含量為0.40%,RGR值随着相对分子质量的增加而减小,当相对分子质量大于8kD时,对L02的生长呈较强抑制作用,RGR为(59.78%±0.70%),根据样品毒性级别评分对照(表2)进行细胞毒性级别评分[17],细胞毒性级别为2级,其余相对分子质量SFP的细胞毒性等级为1级;Ca2+含量为9.60%时,所有相对分子质量SFP对L02的生长呈较弱抑制作用,细胞毒性等级均为1级;Ca2+含量为16.00%时,所有相对分子质量SFP对L02的生长呈促进作用,RGR均大于(117.45%±2.33%)。统计学分析,相同相对分子质量大小的络合不同Ca2+含量SFP对L02的RGR值均有显著性差异。SFP细胞形态观察(图2)得知,SFP相对分子质量大于8kD时,随着Ca2+含量的减少,细胞数量逐渐减少,且在Ca2+含量0.40%时大量细胞发生变形,体积发生萎缩。综上,说明SFP络合Ca2+含量对细胞生长存在明显差异。
2.3相对分子质量8kD以上SFP二级结构测定和分析
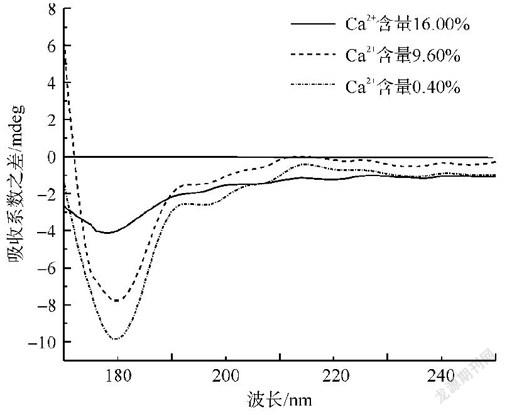
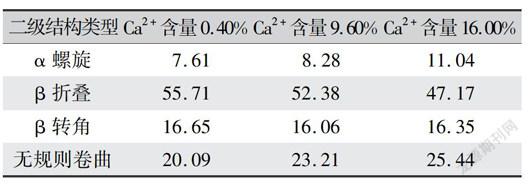
从SFP的相对分子质量大小和Ca2+含量分析,相同相对分子质量大小的SFP时,Ca2+含量不同对细胞生长的影响不同,可见SFP对细胞生长的影响主要取决于Ca2+含量,且在SFP相对分子质量8kD以上时尤为明显。因此对相对分子质量8kD以上SFP进行圆二色谱测定,得到圆二色谱图(图3),并用CONTIN程序及Yang-chen公式计算其各二级结构成分。由表3所示,随着Ca2+含量的升高,β折叠向α螺旋和无规则卷曲转变,当Ca2+含量从0.40%增加到16.00%时,β折叠的含量减少了8.54%,α螺旋和无规则卷曲的含量分别增加了3.43%和535%。
在丝素脱盐过程中,随着脱盐率越高即钙离子含量越低时,丝素蛋白分子构象会由无规则卷曲向β折叠转化[18]。且在丝素蛋白膜的制备中也有研究表明Ca2+含量为3.00%的丝素蛋白膜中β折叠含量比Ca2+含量为1.50%的丝素蛋白膜低[19]。因此,Ca2+在丝素蛋白盐溶过程中改变了丝素蛋白的二级结构,使无规则卷曲和α螺旋向β折叠转变,从而使其对细胞生长影响不同,随着Ca2+含量减少,致β折叠含量增加,对细胞生长的抑制作用增强。有研究表明,α型丝素膜的多孔网状凝胶结构更能够适应细胞的附着、铺展,对增殖极为有利[8]。β淀粉样蛋白对人神经母细胞瘤细胞具有毒性作用,主要原因也是其结构中α螺旋向β折叠的转变[20]。故SFP中α螺旋结构对细胞的增殖有利,而β折叠含量较高则不利于细胞的增殖。
3结论
影响SFP对人正常肝细胞L02生长的主要因素是Ca2+含量,而非相对分子质量大小。SFP络合较高Ca2+含量(16.00%)对细胞生长有促进作用,而SFP络合较低Ca2+含量(0.40%、 9.60%)对细胞生长有抑制作用,在相对分子质量8kD以上时尤为明显。这是由于在SFP络合Ca2+含量减少的过程中,其有较大的二级结构改变,即无规则卷曲和α螺旋转变为β折叠,α螺旋结构对细胞的增殖有利,而β折叠含量较高不利于细胞的增殖。综上所述,在组织工程支架领域,建议使用络合较高Ca2+含量(β折叠含量较少)的SFP更有利于细胞增殖。
参考文献:
[1]MELKE J, MIDHA S, GHOSH S, et al. Silk fibroin as biomaterial for bone tissue engineering [J]. Acta Biomaterialia, 2016, 31:1-16.
[2]VEPARIV C, KAPLAN D L. Silk as a Biomaterial[J]. Progress in Polymer Science, 2007, 32(8): 991-1007.
[3]TEIMOURI A, AZADI M, EMADI R, et al. Preparation, characterization, degradation and biocompatibility of different silk fibroin based composite scaffolds prepared by freeze-drying method for tissue engineering application [J]. Polymer Degradation & Stability, 2015, 121: 18-29.
[4]黄慧明. 蚕丝蛋白肽抗肿瘤与抗氧化作用研究[D]. 泰安: 山东农业大学, 2012.
HUANG Huiming. Antitumor and Antioxidation of Silk Protein Peptide[D]. Taian: Shandong Agricultural University, 2012.
[5]YAMADA H, IGARASHI Y, TAKASU Y, et al. Identification of fibroin-derived peptides enhancing the proliferation of cultured human skin fibroblasts [J]. Biomaterials, 2004, 25(3): 467-472.
[6]王富平, 庞亚妮, 陈忠敏. 丝素降解生成的低分子多肽对细胞生长性能的影响[J]. 丝绸, 2017, 54(4):1-4.
WANG Fuping, PANG Yani, CHEN Zhongmin. Effect of low-molecular-weight silk fibroin peptides on cell growth property [J]. Journal of Silk, 2017, 54(4): 1-4.
[7]LUO Q, CHEN Z, HAO X, et al. Preparation and properties of nanometer silk fibroin peptide/polyvinyl alcohol blend films for cell growth [J]. International Journal of Biological Macromolecules, 2013, 61(10): 135-141.
[8]武明扬, 吴悦, 杨高强, 等.家蚕丝素重链非重复区肽段在大肠埃希菌中的优化表达[J]. 蚕业科学, 2017, 43(2): 238-244.
WU Mingyang, WU Yue, YANG Gaoqiang, et al. Expression optimization of non-repetitive polypeptide derived from silk fibroin heavy chain in escherichia coli[J]. Science of Sericulture, 2017, 43(2): 238-244.
[9]钟一鸣, 杨宇红, 陈新, 等. 铜离子对水溶液中再生丝素蛋白构象转变的诱导作用[J]. 高分子学报,2009(10): 1056-1061.
ZHONG Yiming, YANG Yuhong, CHEN Xin, et al. CU(Ⅱ)-Induced conformation transition of regenerated silk fibroin in aqueous solutions [J]. Acta Polymerica Sinica, 2009(10): 1056-1061.
[10]SHEN T, WANG T, CHENG G, et al. Dissolution behavior of silk fibroin in a low concentration CaCl2-methanol solvent: from morphology to nanostructure[J]. International Journal of Biological Macromolecules, 2018, 113:458-463.
[11]ZHOU P, XIE X, KNIGHT D P, et al. Effects of pH and calcium ions on the conformational transitions in silk fibroin using 2D Raman correlation spectroscopy and 13C solid-state NMR [J]. Biochemistry, 2004, 43(35):11302.
[12]AJISAWA A. Studies on the dissolution of silk fibroin(Ⅱ): the dissolution of silk fibroin by CaCl2-E2O-R.OH ternary system solution [J]. Fiber, 1969, 24(2):61-64.
[13]刘玉强, 刘鹏翔, 田保中. 碳酸钙-丝素粉体材料结构性能的探究[J]. 丝绸, 2012, 49(6): 1-4.
LIU Yuqiang, LIU Pengxiang, TIAN Baozhong. Exploration on the structure and properties of calcium carbonate-silk fibroin powder material[J]. Journal of Silk, 2012,49(6): 1-4.
[14]刘海林, 王磊. 肝脏组织工程种子细胞来源研究进展[J]. 国际消化病杂志, 2003, 23(S1): 20-21.
LIU Hailin, WANG Lei. Research progress of seed cells in liver tissue engineering [J]. International Journal of Gastroenterology, 2003, 23(S1): 20-21.
[15]陈忠敏, 郝雪菲. 一种纳米蚕丝丝素蛋白粉的制备方法: 200710092969.6[P]. 2011-07-13.
CHEN Zhongmin, HAO Xuefei. Method for preparing nano silk fibroin protein powder: 200710092969.6 [P]. 2011-07-13.
[16]LI M, TAO W, KUGA S, et al. Controlling molecular conformation of regenerated wild silk fibroin by aqueous ethanol treatment [J]. Polymers for Advanced Technologies, 2010, 14(10): 694-698.
[17]中华人民共和国国家质量监督检验检疫总局. GBT 16886.5—2003 医疗器械生物学评价 第5部分: 体外细胞毒性试验[S]. 2003.
People’s Republic of China General Administration of Quality Supervision, Inspection and Quarantine. GBT 16886.5-2003 Biological assessment of medical devices The fifth part: in vitro cytotoxicity test [S]. 2003.
[18]ZHU Z H, ZHU L J, XUAN L U. Research on the technology of degradation and desalination of silk fibroin[J]. Amino Acids & Biotic Resources, 2003, 25(3): 37-40.
[19]于海洋, 王昉, 劉其春, 等. 新型丝素蛋白膜的结构和热分解动力学机理[J]. 物理化学学报, 2017, 33(2): 344-355.
YU Haiyang, WANG Fang, LIU Qichun, et al. Structure and kinetics of thermal decomposition mechanism of novel silk fibroin films [J]. Acta Physico-Chimica Sinica, 2017, 33(2): 344-355.
[20]HE H, DONG W, HUANG F. Anti-amyloidogenic and anti-apoptotic role of melatonin in alzheimer disease [J]. Current Neuropharmacology, 2010, 8(3): 211-217.

