以子房为材料制备烟草染色体标本的方法
杨垚 张艳 党江波 梁国鲁 郭启高 庞静
摘 要:為使烟草染色体标本制备过程中取材更方便,本研究以异源五倍体烟草(2n=5x=58)为材料,观察了不同大小子房、不同预处理方法对烟草染色体制片效果的影响。首先,子房大小按花冠与花萼长度比例分为6类;其次,预处理方法分为2类,即:(1)室温下于0.002 mol/L的8-羟基喹啉中预处理2、4和6 h;(2)7 ℃下于0.002 mol/L的8-羟基喹啉中预处理12、24和36 h。结果显示,当花冠长度小于或等于花萼长度的1/2时,子房中分裂期细胞的比例最大,为97.00±17.82个/1000个。该时期子房于7 ℃经24 h预处理后,染色体数目与形态清晰可辨。利用上述方法制作云烟87(2n=4x=48)和(2n=2x=20)的染色体标本,均获得较好的结果。此外,将上述方法制作的五倍体烟草染色体经5S rDNA-FISH,获得了清晰可辨的5个不同信号,与预期一致。可见,幼嫩子房可用于烟草染色体标本的制作,且用改良的预处理方法制备的染色体标本可用于染色体计数和核型分析,也可用于原位杂交分析。
关键词:烟草;幼嫩子房;染色体制片;原位杂交
中图分类号:S572.03 文章编号:1007-5119(2019)04-0056-06 DOI:10.13496/j.issn.1007-5119.2019.04.009
Study on Chromosome Specimen Preparation Using Ovary
YANG Yao, ZHANG Yan, DANG Jiangbo, LIANG Guolu, GUO Qigao, PANG Jing
(1. College of Horticulture and Landscape, Southwest University, Chongqing 400715, China; 2. Chongqing Tobacco Research Institute, Chongqing Municipal Tobacco Company, Chongqing 400715, China; 3. Zunyi Tobacco Company of Guizhou Province, Meitan Branch, Zunyi, Guizhou 564100, China)
In order to obtain materials of plants easily when preparing chromosome specimens, in this study, allopentaploid tobacco (2n=5x=58) was used as materials to observe the effects of ovary sizes and pretreatment methods on plants chromosome specimen preparation. First, ovaries were divided into 6 types based on corolla length/calyx length; and then, two pretreatments were compared, one was pretreatment in 0.002 mol/L 8-hydroxy-quinoline solution at normal atmospheric temperature for 2, 4 and 6 h, the other one was pretreatment in 0.002 mol/L 8-hydroxy-quinoline solution at 7 ℃ for 12, 24 and 36 h. When the length of the corolla was less than or equal to 1/2 of the calyx, the ratio of mitotic cells reached the highest, being 97.00±17.82 in 1000 cells. When ovaries with the most mitotic cells were pretreated at 7 ℃ for 24 h, the number and configuration of chromosomes were clear and distinguishable. The above mentioned methods were applied in chromosome specimen preparation of Yunyan87 (2n=4x=48) and (2n=2x=20), and nice results were obtained, respectively. In addition, 5S rDNA-FISH was carried out on chromosomes of , and expected recognizable signals were found on 5 different chromosomes. These results indicated that tender ovary could be used to prepare chromosome specimens of plants. Chromosome specimens prepared with modified method were not only beneficial to chromosomes counting and karyotype analysis, but also can be applied to in situ hybridization analysis.
; tender ovary; chromosome specimen preparation; in situ hybridization
染色体是基因的载体,其数目和形态是生物的主要特征。根据染色体的数目和形态,可对生物的进化和分类进行研究。在生物育种中也常涉及对染色体数目、形态的观察。染色体标本制作是染色体观察和研究的基础,对生物研究和育种均较为重要。染色体标本制作时需选取生长旺盛的组织为
材料,如幼嫩根尖、幼嫩茎尖以及幼嫩叶片等,其中,种子萌发的根尖较为常用。
烟草为茄科(Solanaceae)烟草属()植物的通称,烟草染色体制片主要以种子萌发的根尖和幼苗的根尖为材料。然而对于烟草属植物,无论是种子萌发的根尖还是幼苗的根尖均较为细小,取材难度较大,后续处理过程中材料较易丢失,且切取根尖易对植株造成伤害,在单株材料的染色体分析中不宜应用。幼嫩花蕾(子房)在部分植物中被用于染色体标本的制备,而未见在烟草中应用。烟草花量较多,花期较长,取材方便,且取花蕾对植株的伤害较小,也不影响后续的结实以及杂交等环节,这有利于数量较少且较为珍贵的材料的染色体制备。
本研究以烟草属异源五倍体植株为材料,对利用花蕾(子房)进行烟草染色体制片的可行性进行分析,为烟草染色体标本的制作提供参考。
1 材料与方法
1.1 试验材料
烟草四倍体材料云烟87(2n=4x=48)、烟草二倍体材料(2n=2x=20)由国家烟草种质资源中期库提供。烟草异源五倍体(2n=5x=58)材料是以云烟87八倍体(2n=8x=96)为母本与为父本杂交,经组织培养繁育获得。所有材料均种植于西南大学园艺园林学院试验基地。
1.2 方法
1.2.1 不同大小子房中分裂期细胞的比例观察 根据前期的观察与测量,按花冠与花萼长度的比例将异源五倍体烟草的子房分为6类(表1)。于晴天在上午9:00—11:00取下6种不同类型的花蕾,自花托和子房连接处用锋利刀片分割,将子房去花柱后置于卡诺固定液(∶=1∶3)中固定过夜。取出后用蒸馏水清洗2次,并于第3次清洗过程中浸泡约20 min以去除固定液。后将子房分割为约1 mm的组织块,放入混合酶液(3%纤维素酶+0.3%果胶酶)中于37 ℃下孵育1.5 h。蒸馏水轻柔清洗2次以去除酶液,加卡诺固定液固定。采用压片法观察,记录处于分裂期的细胞数量和观察细胞总数量,计算分裂期细胞的比例。每类花蕾5个重复。
1.2.2 不同方法预处理及染色体制备 取有丝分裂细胞占比最大的异源五倍体花蕾类型,按前述方法分割后取子房浸没于0.002 mol/L的8-羟基喹啉中,按以下2类方法进行预处理:
(1)在室温(约25 ℃)条件下分别处理2、4和6 h。
(2)在7 ℃条件下分别处理12、24和36 h。
预处理后用卡诺固定液固定过夜,再按前述方法酶解,以涂片法进行制片,火焰干燥,5%吉姆萨染色。各处理5个重复,经镜检统计中期分裂相细胞的比例,观察染色体形态,并以此对不同预处理方法进行评价。
云烟87和的子房按最佳方法进行预处理。
1.2.3 5S rDNA原位杂交 (1)5S rDNA探针制备:供试探针自拟南芥5S rDNA序列中选取,由上海生工生物工程公司合成,并利用TAMRA(四甲基罗丹明)对其5'端进行修饰。(2)原位杂交方法:参照陈志的方法进行,依次是染色体标本的预处理与固定、探针和染色体的变性、杂交、杂交后洗脱、信号检测与图像处理。其中不同的是:杂交过程中探针终浓度为2 ng/µL,直接以2×SSC溶液配制,不经变性直接进行杂交,杂交时间为2 h;杂交后直接用2×SSC在常温下洗脱2次。
2 结 果
2.1 不同大小子房中分裂期细胞数量
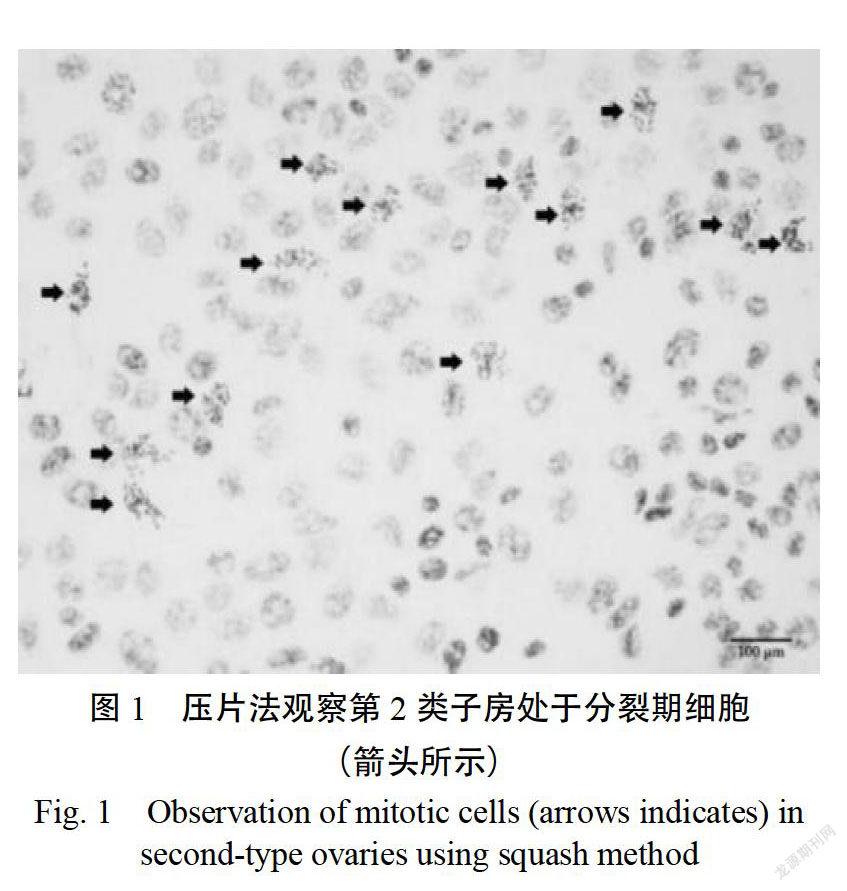
不同大小子房中处于分裂期的细胞比例见表2。由表2中可见,第2类子房即花冠长度小于等于花萼长度的1/2的子房中分裂期细胞占比最大,每1000个细胞中有97.00±17.82个(图1),与其他类型子房中的比例相比差异显著或极显著;其次是第3类和第4类子房。但第3类与第4类子房相比差异不显著。可见,第2类子房最适于染色体标本制备。
2.2 不同方法预处理子房制片效果
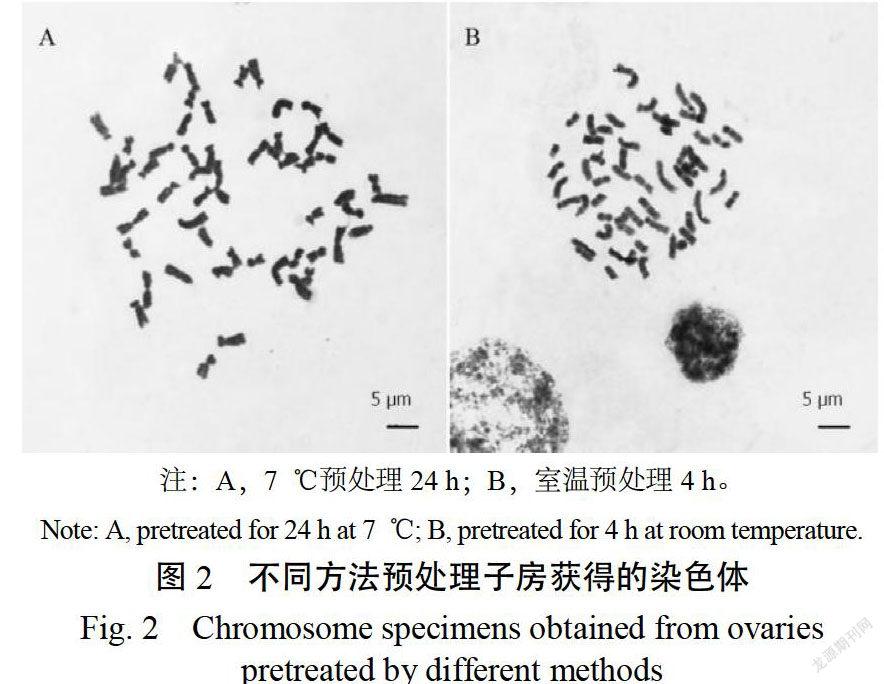
表3所示,同一方法在不同溫度下,随着预处理时间的增加,制片中中期分裂相的细胞数目均增加,最长染色体的长度缩短,染色体的缢痕逐渐明显,着丝点显现出来。
室温条件下,异源五倍体烟草经2 h预处理,最长染色体的长度为10.30~15.24 μm,大部分染色体边缘模糊,着丝点未见,着色较浅。经4 h(图2B)、6 h预处理,虽部分染色体着丝点显现,但边缘较模糊,形态仍较难清晰分辨。在7 ℃下,经12 h预处理,大部分染色体着丝点已经显现,边缘较清晰,但长度稍长;24 h预处理(图2A),所有染色体着丝点清晰可见,边缘清晰,长度适中,且分散性较好。在处理36 h后,大部分可见染色单体,但染色体长度较短,过度凝缩,亦不利于形态识别和测量。
2.3 云烟87和制片
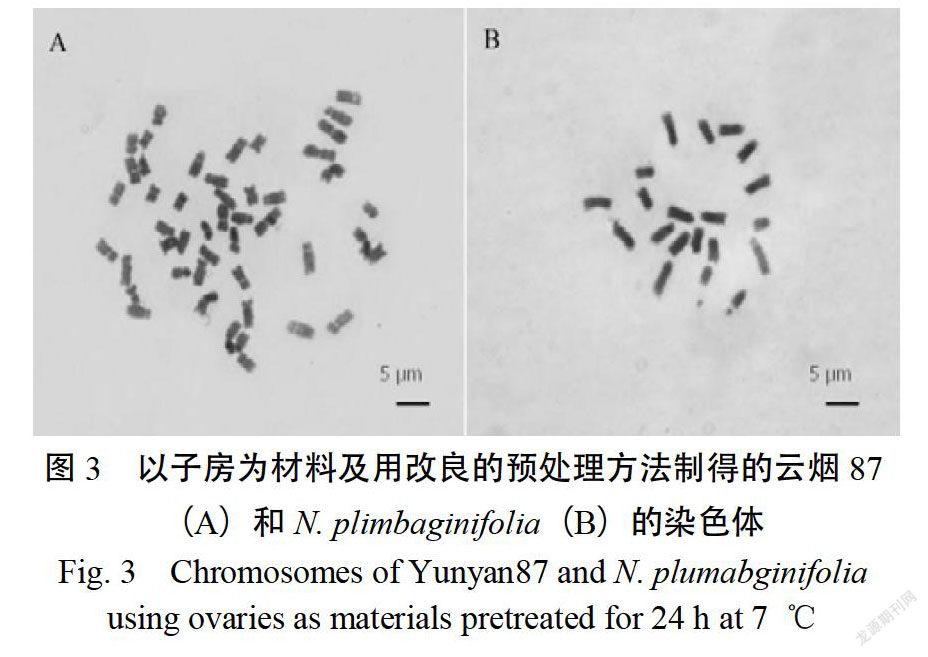
以子房为材料,经7 ℃预处理24 h后对云烟87和进行染色体制片。从制片结果中可以看出,两种烟草的染色体均较分散,形态舒展,边缘清晰,可用于计数和核型分析(图3)。

图3 以子房为材料及用改良的预处理方法制得的云烟87(A)和(B)的染色体
Fig. 3 Chromosomes of Yunyan87 and using ovaries as materials pretreated for 24 h at 7 ℃
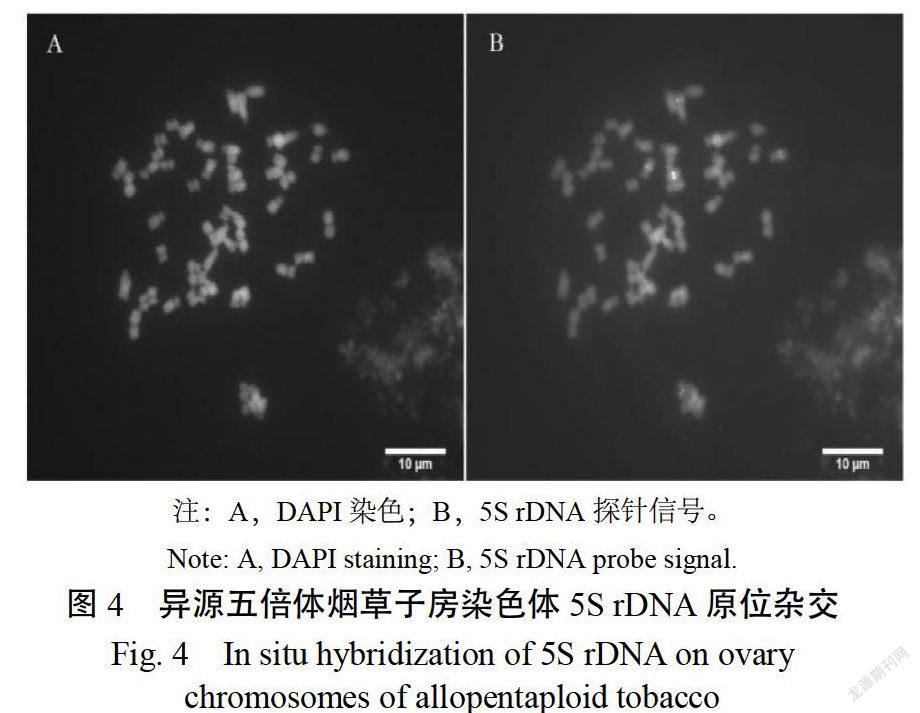
2.4 异源五倍体烟草5S rDNA原位杂交效果
将最佳方法制备的异源五倍体烟草染色体标本用于5S rDNA原位杂交。图4结果显示,杂交信号亮度较明显,易于识别。该中期染色体上共有5个5S rDNA杂交信号,与预期相符合。说明采用上述最佳方法所制的异源五倍体烟草染色体标本可用于原位杂交。
3 讨 论
花蕾由茎尖分生组织分化发育而来,幼嫩花蕾快速生长、膨大,这是幼嫩花蕾可用于进行染色体制片的主要原因。不同时期处于分裂期的细胞比例不同,说明不同时期花蕾的生长速度不同。染色体制片过程中,常采用单一方法进行预处理,其中秋水仙素和8-羟基喹啉较为常用,低温诱导也有见报道。低温处理可间接地对蛋白质的结构起稳定作用,这样有助于后期观察染色体的形态。本研究采用化学试剂结合低温诱导,效果较单一化学试剂处理较好。且低温处理的染色体长度分布范围较常温处理的小,表明低温处理使染色体长度较均一。这可能是低温使整个花蕾在短时间处于同一条件,还延缓了花蕾的生长活动,使8-羟基喹啉更充分地渗入所有细胞,以使更多细胞所处条件更趋于一致。
原位杂交在烟草远缘杂交育种以及烟草属植物的进化、分类中有较多应用。原位杂交要求分裂相背景较少,染色体形态舒展。在本研究中,以20 bp的5S rDNA保守序列为探针,进行杂交,杂交后的分裂相背景浅,染色体形态清晰可辨,所获得的信号也较强,且数量与预期一致。这说明,这种方法获得的染色体适于原位杂交,对较短的探针序列也较为实用,且效果良好。这为后续烟草属植物细胞遗传学分析过程中的染色体制备提供了较好的方法。
烟草育种特别是远缘杂交育种过程中常涉及重要单株材料的染色体鉴定和分析。这类分析过程中,往往面临材料较少的问题,且这类分析对制片的效果要求也较高。本研究所得结果为这类材料的 单株染色体制备提供了较好的方法。该方法在云烟87和N. plumbaginifolia及二者的杂种(异源五倍体) 材料中均有较好效果,表明这种方法有较为广泛 的应用范围。较多野生烟草的子房较小,如本研究 中所用的,处于最佳时期的子房的长度仅1~2 mm。这增加了部分处理过程的难度。为了取材和处理方便,在预处理时可将包含多个花蕾的花序一起放入预处理液中处理。
但是,以花蕾为材料制备染色体标本,不能对材料进行早期鉴定。一方面周期较长,另一方面对场地面积有较多要求。故本方法并不太适于大规模筛选、鉴定以及对纯系材料的早期鉴定。大规模筛选、鉴定可结合其他方法如流式细胞术、气孔保卫细胞观察等进行初选,再用本研究所得方法进行后期鉴定。
综上所述,本研究的最佳方法适于烟草染色体标本的制作,且制片可用于分子细胞遗传学实验中,这为烟草的细胞遗传学分析提供参考。
参考文献
YAO S H. History and current status of research on relationship between chromosomal evolution and biological evolution[J]. Journal of Guizhou Normal University(Natural Sciences), 1993(4): 75-83.
LI M X. Plant chromosomal size variation and evolution[J]. Bulletin of Biology, 1985(5): 14-16.
JIA F X, ZHOU M B, CHEN R, et al. Karyotype and genome size in four bamboo species[J]. Scientia Silvae Sinicae, 2016, 52(9): 57-66.
SHAO B J, WAN S Q, LIU J M, et al. Polyploidy induction and identification of and [J]. Molecular Plant Breeding, 2018, 16(8): 2593-2599.
DAI X M, HUANG Q C, JIA H R, et al. The identification methods of ploidy in rice polyploidy breeding[J]. Acta Agriculturae Boreali-Sinica, 2008(4): 94-96.
WEN X M, ZHANG N, YUE Y, et al. Summary of results and influencing factors of grape polyploidy breeding[J]. Sino-Overseas Grapevine & Wine, 2017(4): 95-99.
- 杜培,张新友,李丽娜,等. 高质量花生根尖细胞染色体制片方法研究[J]. 河南农业科学,2013,42(3):31-35.
DU P, ZHANG X Y, LI L N, et al. Study on slide preparation methods for high quality chromosomes from root tip cells of [J]. Journal of Henan Agricultural Sciences, 2013, 42(3): 31-35.
LI X L, YANG J, WANG H T, et al. Optimization of chromosome mounting technique and karyotype analysis of tree [J]. Journal of Henan Agricultural Sciences, 2009(7): 102-106.
GAO J H, XING S Y, JIANG Y Z, et al. Chromosome karyotype analysis ginkgo ornamental cultivars[J]. Journal of Shandong Agricultural University(Natural Science Edition), 2005(1): 19-24.
- KENTON A, PAROKONNY A S, GLEBA Y Y, et al. Characterization of the L. genome by molecular cytogenetics[J]. Molecular & General Genetics Mgg, 1993, 240(2): 159-169.
- LIM K Y, ROMAN M, LICHTENSTEIN C P, et al. Molecular cytogenetic analyses and phylogenetic studies in the section tomentosae[J]. Chromosoma, 2000, 109(4): 245-258.
- NAKAMURA R, KITAMURA S, INOUE M, et al. Karyotype analysis of Y. Ohashi using DAPI banding and rDNA FISH[J]. Theoretical and Applied Genetics, 2001, 102(6-7): 810-814.
- 王霖娇,任学良,盛茂银,等. 具翼烟草()核型、C带与rDNA染色体定位研究[J]. 中国烟草学报,2017,23(1):95-101.
WANG L J, REN X L, SHENG M Y, et al. Study on karyotype, C-banding and rDNA chromosome locus in[J]. Acta Tabacaria Sinica, 2017, 23(1): 95-101.
ZHOU X H, GUI M, XIA J, et al. Studies on identifying number of chromosome in carnation by using ovary wall[J]. Acta Agriculturae Jiangxi, 2010, 22(1): 61-63.
- 涂伟凤,张洋,汤洁,等. 印度蔊菜()有丝分裂进程观察与核型分析[J]. 江西农业学报,2018,30(11):6-9.
TU W F, ZHANG Y, TANG J, et al. Mitosis process observation and karyotype analysis of [J]. Acta Agriculturae Jiangxi, 2018, 30(11): 6-9.
ZHANG H M. Cytogenetical studies of broccoli and other brassica crops[D]. Nanjing: Nanjing Agricultural University, 2009.
XU C Y, WANG L P, WANG J J. Observation of the chromosome in the somatic cell of natural tetraploid makino[J]. Journal of Anhui Agricultural Sciences, 2010, 38(28): 15503-15509.
- 党江波,赵申清玉,邓红红,等. Lin.- Viv.杂种的鉴定及其育性和黑胫病抗性的初步分析[J]. 中国烟草学报,2016,22(2):93-99.
DANG J B, ZHAO S Q Y, DENG H H, et al. Identification of Lin. and Viv. hybrid and primary analysis of its fertility and resistance to black shank disease[J]. Acta Tabacaria Sinica, 2016, 22(2): 93-99.
DING H, QIU D P, CHEN S X. Research progress in plant chromosome samples preparation and karyotype analysis[J]. Journal of Southern Agriculture, 2012, 43(12): 1958-1962.
ZHAO Q, CHEN Z, YANG X, et al. Chromosome localization of 5S rDNA of natural tetraploids and their corresponding diploids in by fluorescence hybridizatio[J]. Journal of Southwest University(Natural Science Edition), 2016, 38(11): 34-39.
CHEN Z. FISH analysis of 5S rDNA in and close related genera[D]. Chongqing: Southwest University, 2015.
DONG X M, DING K Y, WANG H C, et al. Karyotype of (Boraginaceae), a species endemic to China[J]. Guihaia, 2011, 31(4): 441-443.
NI Y Y, YANG W J, LIU J F, et al. Karyomorphology of five species[J]. Forest Research, 2017, 30(2): 189-193.
REN W J, GUO X F, JIANG L N, et al. Optimization of chromosome mounting technique and karyotype analysis of culinary rhubarb[J]. Acta Agriculturae Boreali-Sinica, 2013, 28(5): 128-132.
CHEN S Y, FANG C, SUN Y, et al. Study on optimization of observing method for chromosome of root-tip tissue in [J]. Grassland and Turf, 2008(2): 23-26.
ZOU J W, GUO Z Q, ZHANG Z W, et al. Influences of different factors on chromosome preparation of root-tip tissue in wheat[J]. Seed, 2016, 35(12): 8-11.
SHI L R, WANG J, CUI X G. Study on karyotype analysis methods of [J]. Northern Horticulture, 2009(2): 53-55.
LI Q Y, WANG S S, ZHOU P L, et al. Effects of low temperature stress on leaf shape and physiological characteristics in tobacco seedlings[J]. Chinese Tobacco Science, 2018, 39(1): 17-23.
ZHAI N, XU Y L, LIU P P, et al. Applications of flow cytometry in plant and tobacco research[J]. Tobacco Science & Technology, 2018, 51(9): 98-104.
ZHU H Q, ZHANG X Y, XUE Q Z. Rapid determination of ploidy level of chromosome in tobacco()[J]. Journal of Agricultural Biotechnology, 2006(2): 255-258.

