福鼎市桐江溪卤乙酸分布特征及潮汐影响分析
王晓云 李启明 付爱民
摘要:為了掌握福鼎市桐江溪卤乙酸(HAAs)的含量、时空分布规律及其来源,对水体中HAAs化合物进行取样调查。根据桐江溪水文情势及沿岸特点设置10个取样点,于2017年12月及2018年7月按照涨潮、退潮情况分别对水样进行采集,检测HAAs分布情况,同时将卤乙酸(HAAs)与水质特性、涨退潮进行了相关性分析。研究发现,HAAs是普遍存在于桐江溪中的污染物质。其中,一氯乙酸(MCAA)、二氯乙酸(DCAA)、三氯乙酸(TCAA)、一溴乙酸(MBAA)、二溴乙酸(DBAA)等5种卤乙酸(HAA5)质量浓度为0.44~3.39 μg/L;一氯乙酸(MCAA)、二氯乙酸(DCAA)、三氯乙酸(TCAA)、一溴乙酸(MBAA)、二溴乙酸(DBAA)、三溴乙酸(TBAA)、一溴一氯乙酸(BCAA)、一溴二氯乙酸(BDCAA)、二溴一氯乙酸(CBDAA)等9种卤乙酸(HAA9)质量浓度为0.83~56.15 μg/L。桐江溪中HAAs主要为DCAA,TCAA,TBAA 3种,其中DCAA为制药厂及医院排水导致,主要分布在下游;TCAA主要来源于河段上游的农业生产活动;TBAA为上游沸石矿尾矿库受雨水冲刷而流入的Br-所生成,主要分布于河流中下段。相关性分析结果表明,温度与HAA5,HAA9质量浓度呈现正相关,pH值与HAA5,HAA9质量浓度呈现负相关;TCAA质量浓度于相同季节不同潮汐及不同季节相同潮汐时均呈现上游高于下游的现象,其他HAAs均不因涨潮、退潮的差异造成质量浓度分布的变化。掌握桐江溪HAAs的含量、时空分布规律及来源,探讨其与水质的相关性,对于净水工艺选择、水厂出水HAAs含量的溯源分析、水体环境风险评估以及研究水生生物体内HAAs的累积效应等有重要意义。
关键词:水体环境学;福鼎市;桐江溪;卤乙酸;分布特征;相关性分析;水质特性;潮汐影响
中图分类号:X824; O661.1文献标志码:Adoi: 10.7535/hbgykj.2019yx04007
Abstract: In order to understand the content, temporal and spatial distribution and source of haloacetic acids (HAAs)inTongjiang River of Fuding City, the HAAs compounds in water were sampled and investigated. According to the hydrological situation and coastal characteristics of Tongjiang River, 10 sampling points were set up. In December 2017 and July 2018, water samples were collected according to the situation of high and low tide, and the distribution of HAAs was detected. At the same time, the correlation between HAAs and water quality characteristics, high and low tide was analyzed. It is found that HAAs are ubiquitous pollutants in Tongjiang River. There are five haloacetic acids (HAA5): monochloroacetic acid (MCAA), dichloroacetic acid (DCAA), trichloroacetic acid (TCAA), monobromoacetic acid (MBAA) and dibromoacetic acid (DBAA) Acids, with concentrations of 0.44~3.39 μg/L. Nine haloacetic acids(HAA9) include: MCAA,DCAA,TCAA,MBAA,DBAA,tribromoacetic acid (TBAA), bromoacetic acid (BCAA), bromochloroacetic acid (BDCAA), and chlorodibromoacetic acid (CBDAA), with concentrations of 0.83~56.15 μg/L. The HAAs in Tongjiang River are mainly DCAA, TCAA and TBAA, among which DCAA is caused by the drainage of pharmaceutical factories and hospitals and mainly distributes in the lower reaches; TCAA mainly comes from agricultural production activities in the upper reaches of the river; TBAA is generated by bromide ioninflow from the upstream zeolite tailings reservoir washed by rainwater and mainly distributes in the middle and lower reaches of the river. The results of correlation analysis show that temperature is positively correlated with HAA5 and HAA9 concentration, pH is negatively correlated with HAA5 and HAA9 concentration, TCAA is higher in upstream and downstream in the same season, different tides and different seasons, and other HAAs do not change in concentration distribution due to the difference of high and low tide. To grasp the content, temporal and spatial distribution and source of HAAs in Tongjiang River and to explore its correlation with water quality are of great significance for water purification process selection, traceability analysis of HAAs content in effluent of waterworks, water environmental risk assessment and Research on accumulation effect of HAAs in aquatic organisms.
Keywords:water body environmental science; Fuding City; Tongjiang River; haloacetic acids(HAAs); distribution characteristics; correlation analysis; water quality characteristics; tidal effects
卤乙酸(HAAs)主要有一氯乙酸(MCAA)、二氯乙酸(DCAA)、三氯乙酸(TCAA)、一溴乙酸(MBAA)、二溴乙酸(DBAA)、三溴乙酸(TBAA)、一溴一氯乙酸(BCAA)、一溴二氯乙酸(BDCAA)、二溴一氯乙酸(CBDAA),以上9種卤乙酸之和记为HAA9,前5种卤乙酸之和计为HAA5。卤乙酸的来源:一是饮用水消毒产生的副产物,二是医疗与农业使用过程中的排放,三是挥发性含氯、含溴溶剂进入环境中合成[1-3]。美国环保署(USEPA)规定饮用水中HAA5含量不得超过30 μg/L(质量浓度)。而中国《生活饮用水卫生标准》 ( GB 5749—2006) 仅对 DCAA,TCAA 的含量进行了限制,规定其质量浓度限值分别为 50,100 μg/L。研究表明HAAs具有胚胎毒性和致癌作用,主要表现在生殖损害和发育损害,而且不同的HAAs之间具有加毒效应[3]。HAAs的细胞毒性顺序为MBAA>DBAA>MCAA>DCAA>TCAA,遗传毒性顺序为MBAA>MCAA>DBAA>TBAA,其中DCAA,TCAA和DBAA的致癌性较强,世界卫生组织国际癌症研究机构致癌物清单中,将以上3种HAAs列为2B级致癌物质[4]。
国内对HAAs的研究主要针对饮用水消毒副产物的浓度控制及风险评价等方面,很少涉及天然水体中HAAs的研究。研究文献表明[3-7],HAAs普遍存在于降水、海水、地表水及空气中,且HAAs可能随着污(废)水进入环境水体。对天然水体中HAAs的质量浓度、种类及分布情形进行调查,掌握HAAs质量浓度的时空分布规律,探讨其与水质的相关性对于净水工艺选择、水厂出水HAAs含量的分析以及水体环境风险评估等有重要意义。
1研究方法
1.1研究区域与测站布设
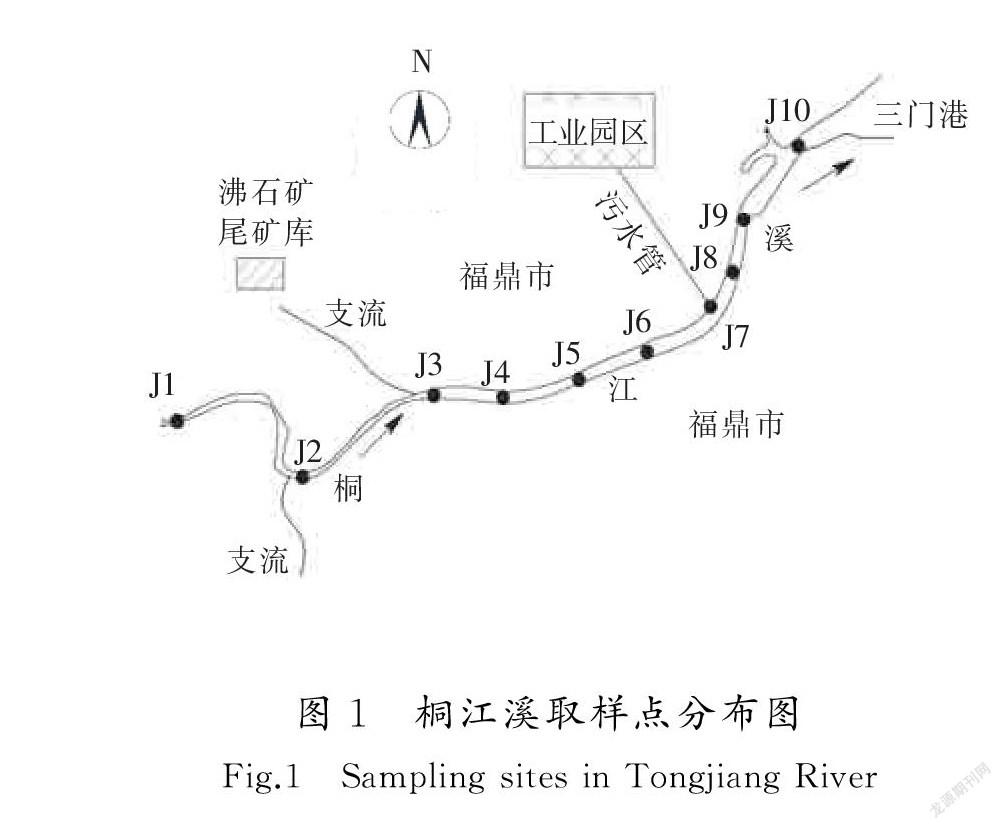
桐江溪发源于福建省福鼎市北部,全长29.5 km,流域面积156.7 km2,流经福鼎市市区,最后经三门港流入台湾海峡。桐江溪沿岸人口密集,居住人口约19万,工商业发达,主要污染源包括生活污水、工业废水(金属加工、电子、汽车电镀、制药、印染等)、医疗污水、城市雨水等,污染物流入河流中将造成河川水质恶化。其中,洗车、制药行业及上游沸石矿尾矿库为HAAs化合物的可能来源。
本研究在桐江溪河段(如图1所示)由上游至河口依次设置了共10个取样点,其中河流源头J1、支流流入(J2,J3)、精细化工工业园区污水厂排水管汇入(J7)、制药厂排水干管汇入(J8)、医院排水干管汇入(J9)、河口(J10)。
桐江溪入海口段受到海水潮汐作用影响,海水入侵河段与淡水形成感潮河段,感潮河段往上游最远可到J3至J4之间,涨潮时海水可能将港口区污染物传递到桐江溪河段,使桐江溪水质受到海水影响。本研究将桐江溪分成上下游河段进行讨论,上游段为J1—J5,下游段为J6—J10。
1.2水样采集时间及方法
现场采样时间为2017年12月与2018年7月,利用采样器采集表层水(水面以下0.5 m),并于现场测定温度、溶解氧(DO)、pH值及盐度等常规水质指标;然后将采样器中的水装入棕色玻璃瓶,保存在(4±2)℃恒温箱中,送至实验室进行分析。各点在涨退潮期间,每天各取样一次,每个取样点共取样93次。
1.3主要试验仪器及试剂
气相色谱仪(HP5890 SeriesⅡ GC/ECD,美国惠普-安捷伦公司):注入口温度为200 ℃。层析柱为HP-5MS 30 mm×0.25 mm×0.25 μm,烘箱温升条件为40 ℃停留10 min,然后以5 ℃/min上升至70 ℃,再以3 ℃/min上升至100 ℃,之后直接以20 ℃/min上升至250 ℃后停留2 min,侦测器温度为280 ℃,载流气体为纯度99.999%的氮气,管柱流量为2.7 mL/min。
拟似标准品:2-溴丁酸(纯度>99.9%,美国SUPELCO公司);甲基第三丁基醚(纯度>99.8%,美国TEDIA公司);甲醇(纯度>99.9%,美国ECHO公司);硫酸(纯度>95%,西班牙SCHARLAU公司);硫酸钠(纯度>99.9%,美国TEDIA公司);碳酸氢钠(纯度>99.5%,日本SHOWA公司)。
试剂制备:拟似标准品溶液(20 mg/L),取0.2 mL拟似标准品溶液以甲醇定溶至10 mL;10%(质量分数,下同)硫酸甲醇溶液,取10 mL硫酸加入50~60 mL的甲醇后,再以甲醇定溶至100 mL;硫酸钠溶液(150 g/L):称取15 g硫酸钠以去离子水定溶至100 mL;饱和碳酸氢钠溶液,常温下在200 mL去离子水中加入碳酸氢钠,搅拌至碳酸氢钠粉末无法再溶解为止。
1.4分析方法
1)常规指标分析方法氨氮(NH+4-N)、硝酸氮(NO-3-N)、亚硝酸氮(NO-2-N)、磷酸盐(PO3-4-P)、生化需氧量(BOD5)、悬浮物(SS),均采用国标法[8]测定;DO采用溶解氧计(德国WTW公司,Oxi3205)测定;盐度采用盐度计(美国YSI公司,EC300)测定;浊度采用浊度仪(美国HACH公司,2100N)测定;pH值采用pH计(瑞士METTLER TOLEDO公司,FE20)测定。
2)HAAs分析方法目前HAAs的检测方法主要有以下几种:气相色谱法、液相色谱法、电喷雾离子化-质谱法、毛细管电泳法等[8-9]。本研究采用气相色谱法并结合国家标准测定HAAs[8-10]。
具体方法如下:取40 mL的水样,置于60 mL萃取瓶中,加入0.02 mL的2-溴丁酸(质量浓度为20 mg/L),再加入2 mL浓硫酸调整pH值至0.5以下,然后立即加入18 g的硫酸钠,并立即摇动直至全部溶解。再加入4.0 mL的甲基第三丁基醚萃取溶液,并用手剧烈摇晃3 min,静置约5 min,使水层和萃取液分离,以玻璃滴管将上层的萃取液去除并移入15 mL试管中,加入3 mL10%硫酸甲醇溶液,封口后置于加热器以(50±2)℃加热2 h。之后取出试管,冷却后加入7 mL的150 g/L的硫酸钠溶液,加盖后摇晃使之均匀,待溶液分层完全后使用长玻璃滴管移除离心管下层的酸性甲醇水层。再加入1 mL饱和碳酸氢钠溶液,加盖后摇晃使之反应完全,将上层萃取液取出1 mL置于自动进样器样品瓶,取样品1 μL注入气相色谱仪。
1.5质量控制
为确保HAAs分析数据的可靠性,在分析过程中采取如下质量控制措施。
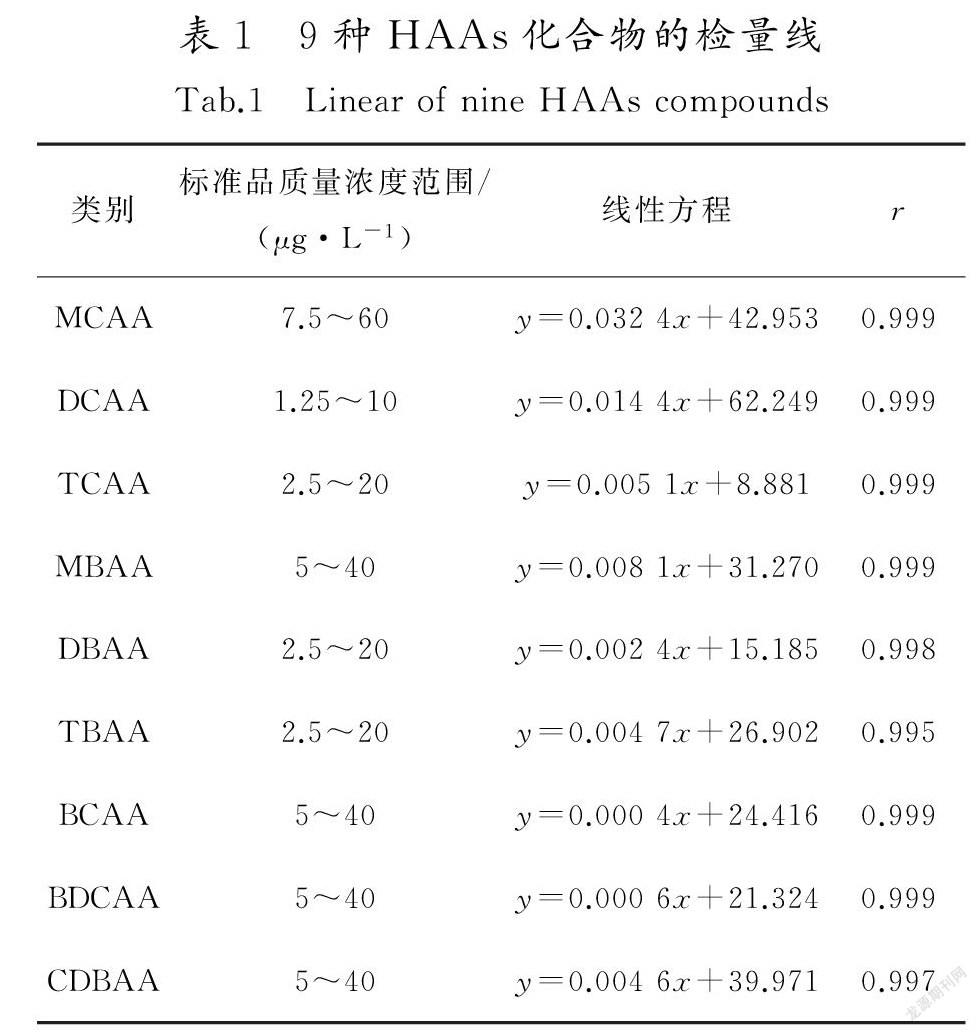
1)检量线建立以甲基第三丁基醚为溶剂,配置5个不同质量浓度的标准品,以GC/ECD分析后,依分析结果将标准品质量浓度设定为Y轴,分析面积为X轴,计算出线性方程式与线性相关系数r(0.995~0.999),检量线参见表1。
2)空白样品分析为了解实验所使用的药品、试剂、容器及各操作流程中的污染情况,用不含待测物的去离子水以与样品相同实验流程进行分析,以确保实验操作过程中未受到污染,每10个或每批次样品至少执行一次空白样品分析。每批次样品分析前,进行空白样品分析,其分析结果的空白值均小于二倍方法侦测极限。
3)复查样品分析为了解实验分析结果的可信度及准确性,每10个或每批次样品至少执行一次复查样品分析。每批次样品分析时,以线性回归方程样本中间点质量浓度进行复查样品分析,样品回收率为70.0%~129.7%。
4)重复样品分析为确定实验分析结果的精确性,每10个或每批次样品至少执行一次重复样品分析,其相对差异百分比应在30%以内。每批次样品分析时,将样品分为2份进行试验流程分析,其分析结果相对差异百分比为0.4%~29.6%。
5)拟似标准品回收率为确保实验分析结果的完整性,进行样品分析时,必须同时评估拟似标准品的回收率。本研究样品所添加的拟似标准品的回收率为(101.0±27.0)%。
1.6数据处理
将各研究点的连续监测数据在Microsoft Excel软件中以时间序列组成水质分析项目数据组,按照统计学原理,采集30~50个数据,并建立数据库。最后将采样时间、地点相同的数据进行算数平均,得到平均值数组。所有试验结果为3次重复测定的平均值,采用的数据标准误差S≤1%,每组测定数据在X±S范围内。以Origin7.0作图,SPSS10.0软件进行相关性分析。相关系数|r|<0.1为不相关,0.1≤|r|<0.3为低度相关,0.3≤|r|<0.7为中度相关,|r|≥0.7为高度相关。低相关系数不一定代表2个变量之间关系薄弱,仅能代表2个变量没有直线关系,2个变量也可能存在曲线相关性。
2结果与讨论
2.1桐江溪HAAs含量及分布特征
2.1.1HAAs含量
表2显示桐江溪中HAAs质量浓度情况,各取样点均测得不同种类的HAAs存在,表明地表水体中确有HAAs存在,这与很多研究结果一致[4-7]。桐江溪水样采集时间为2017年12月及2018年7月,季节分别为冬季与夏季。2017年12月采集的水样,测得的HAAs主要为DCAA,TCAA和TBAA,其余化合物均未检出(ND);2018年7月采集的水样测得HAAs主要为MCAA,DCAA,TCAA,TBAA,BDCAA和TBAA,其余化合物均未检出(ND)。河水中的MCAA质量浓度为ND~1.23 μg/L,DCAA质量浓度为0.12~2.56 μg/L,TCAA质量浓度为0.16~2.45 μg/L,TBAA质量浓度为0.32~52.94 μg/L,BDCAA质量浓度为ND~1.05 μg/L,CDBAA质量浓度为ND~13.04 μg/L,而MBAA,DBAA及BCAA质量浓度均为ND。HAA5质量浓度为0.763~3.39 μg/L,HAA9质量浓度为0.83~56.15 μg/L。
2.1.2HAAs分布特征
根据表2测得的HAAs质量浓度情况来看,HAA5的主要组分为DCAA与TCAA,HAA9的主要组分为TBAA,选择DCAA,TCAA和TBAA 3种高频出现的HAAs进行分析。
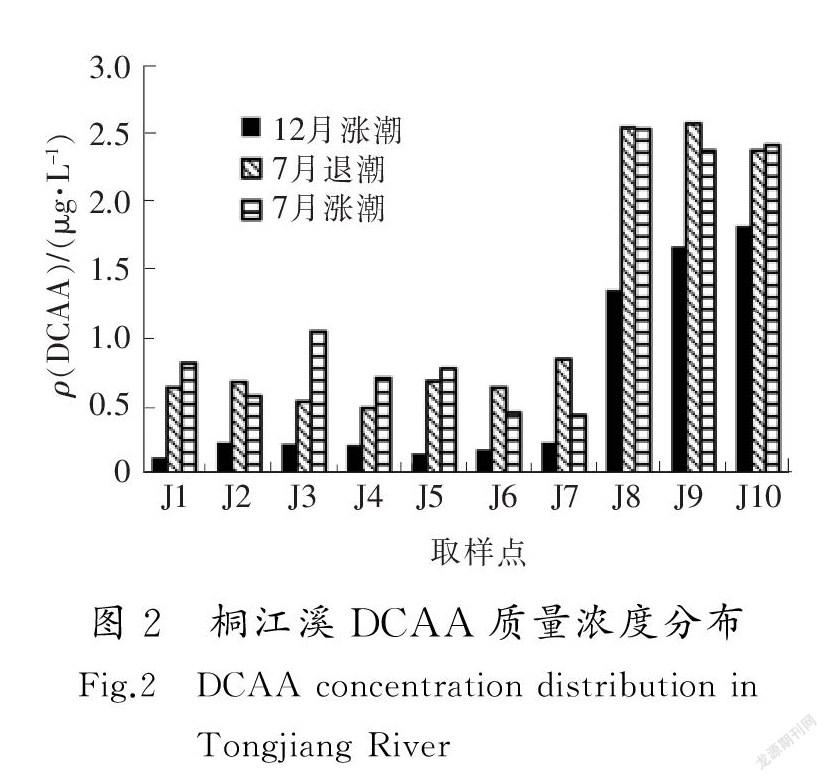
图2显示桐江溪中DCAA的质量浓度分布情况。
12月最高质量浓度为1.81 μg/L(J10),最低质量浓度为0.12 μg/L(J1),高质量浓度主要分布在下游河段;7月(退潮)水样最高质量浓度为2.56 μg/L(J9),最低质量浓度为0.48 μg/L(J4);7月(涨潮)最高质量浓度为2.52 μg/L(J8),最低质量浓度为0.43 μg/L(J7)。下游质量浓度高于上游质量浓度,主要是由于制药厂排水中含有的DCAA和医院排水中游离氯进入水体合成了DCAA,这与陈丽珠等[11]的研究结果一致。J1—J7点的CDAA质量浓度7月高于12月,主要是受温度影响;但水体在经过J8点后受到制药废水影响均提升到较高质量浓度,季节影响变得不显著。
图3显示桐江溪中TCAA质量浓度分布情况,12月最高质量浓度为1.29 μg/L(J5),最低质量浓度为0.16 μg/L(J10);7月(退潮)最高质量浓度为2.00 μg/L(J1),最低质量浓度为0.44 μg/L(J10);7月(漲潮)最高质量浓度为2.45 μg/L(J2),最低质量浓度为0.43 μg/L(J7)。TCAA的最高质量浓度均出现在上游,且7月的质量浓度比12月的质量浓度高,这是由于上游流域以农业生产为主,农作物种植季节河段接纳了含有除草剂的农业灌溉排水的缘故,这与HANSON等[12-13]和DAVID等[14]的研究结果一致。
图4显示桐江溪中TBAA的质量浓度分布情况,12月最高质量浓度为0.46 μg/L(J4,J5),最低质量浓度为0.32 μg/L(J1);7月(退潮)最高质量浓度为52.94 μg/L(J7),最低质量浓度为0.41 μg/L(J1);7月(涨潮)最高质量浓度为37.61 μg/L(J7),最低质量浓度为0.57 μg/L(J2),TBAA质量浓度于J3取样点后有明显上升趋势。由于J3取样点支流上游存在沸石矿尾矿库,其废弃物中含有质量浓度较高的Br-,夏季台风期间强降雨会冲刷尾矿库,将Br-带入桐江溪中,Br-可与HClO反应生成HBrO,而HBrO比HClO活性更强,更容易与有机物发生卤代反应,生成较多的溴代副产物[3],从而使水样中出现质量浓度较高的TBAA,而冬季降水量少,这种情况则不明显。J7点有來自使用TBAA为原料的精细化工工业园区的污水汇入,退潮时河水水量减少,导致该点出现质量浓度升高的现象。
图5显示桐江溪中HAA5质量浓度分布情况,12月取样最高质量浓度为1.97 μg/L(J10),最低质量浓度为0.44 μg/L(J7);7月(退潮)的最高质量浓度为3.37 μg/L(J9),最低质量浓度为1.09 μg/L(J3);7月(涨潮)最高质量浓度为3.39 μg/L(J8),最低质量浓度0.86 μg/L(J7),HAA5的分布没有明显的规律性。这与HANSON等[12]的研究结果不同,表明不同水体中HAA5分布特征存在个性化差异。
图6显示桐江溪中HAA9质量浓度分布情况,12月取样最高质量浓度为2.39 μg/L(J10),最低质量浓度为0.83 μg/L(J6);7月(退潮)最高质量浓度为56.15 μg/L(J7),最低质量浓度为3.53 μg/L(J2);7月(涨潮)最高质量浓度为38.47 μg/L(J7),最低质量浓度为4.56 μg/L(J1)。HAA9质量浓度7月明显高于12月,高浓度分布于J3—J10,主要由于TBAA质量浓度在夏季明显增加。夏季桐江溪中含溴HAAs占HAAs总量的90%以上,所占比例高于HANSON等[13]和DAVID等[14]研究的水体。
桐江溪HAAs质量浓度的分布从空间而言,DCAA在12月的质量浓度以下游较高,7月的质量浓度则没有明显趋势;TCAA则以上游质量浓度较高;TBAA以J3—J10取样点质量浓度较高。除J7外,其余取样点HAA5质量浓度以上游取样点较高,HAA9与TBAA具有相同分布趋势。就季节分布而言,DCAA冬季平均质量浓度为0.29 μg/L,低于夏季平均质量浓度1.20 μg/L。TCAA质量浓度除了J5,其他取样点均是夏季质量浓度高于冬季质量浓度。TBAA质量浓度冬季没有检测出。HAA5夏季平均质量浓度为2.28 μg/L,高于冬季平均质量浓度0.86 μg/L。HAA9夏季质量浓度高于冬季。桐江溪的HAAs质量浓度夏季高于冬季,主要是由于夏季温度高,氧化反应速度加快,从而HAAs的生成量增加[5]。
2.2桐江溪HAAs的相关性分析
2.2.1HAAs与水质特性的相关性
桐江溪HAAs与基本水质特性的相关性分析结果见表3。可以看出,pH值与TCAA呈现负相关(p<0.05,r=-0.427),与TBAA及HAA9呈现非常显著负相关(p<0.01,r=-0.609~-0.587),许多文献研究表明[3-5],在高pH值环境下HAAs生成量会减少,因此pH值与HAAs生成量成反比。温度与TBAA及HAA9呈现非常显著正相关,这与PETERS等[7]和DAVID等[14]的研究结果一致。
2.2.2HAAs与涨退潮的相关性
图2显示涨退潮时的DCAA质量浓度差异情况。可以看出7月涨退潮J3与J7取样点质量浓度差异较大,其余点差异较小,退潮质量浓度分布无明显趋势变化,涨潮质量浓度分布则为上游高于下游,并且上游涨潮时质量浓度高于退潮时质量浓度。12月涨潮与7月涨潮的质量浓度数据对比发现,J5,J7,J8,J9,J10点质量浓度差异较大,其余各点差异较小,可知12月份涨潮时质量浓度下游比上游高,7月涨潮时质量浓度上游比下游高。
图3显示涨退潮时的TCAA质量浓度差异情况。可以看出7月涨潮差异,J2,J3,J7取样点质量浓度差异较大,其余点差异较小,而退潮的质量浓度分布与涨潮的质量浓度分布相同,上游质量浓度高于下游质量浓度,且由上游至下游呈现下降趋势。12月与7月涨潮质量浓度差异,J1,J2,J3,J5,J8,J10点质量浓度差异较大,其余点差异较小,而12月与7月退潮质量浓度分布相同,均呈现上游质量浓度高于下游质量浓度的现象,但是上游河段的质量浓度分布不同,12月涨潮J1的质量浓度由0.51 μg/L增加到J5的1.29 μg/L,7月涨潮J1的质量浓度由2.06 μg/L下降到J5的0.79 μg/L。
图5显示HAA5涨退潮质量浓度差异情况。可以看出7月涨潮与退潮的差异,除J7外退潮的质量浓度分布与涨潮的质量浓度分布一致,由上游至下游呈现下降趋势。7月退潮J7质量浓度也较高,主要由于该点出现MCAA,且DCAA,TCAA质量浓度也较大。12月涨潮各点质量浓度无明显上升与下降趋势。
图6显示HAA9涨退潮质量浓度差异情况。7月退潮时中间河段(J3—J10)质量浓度较高,涨潮时J3—J10质量浓度也较高,其余取样点无明显变化趋势。7月涨潮质量浓度均高于12月涨潮质量浓度,7月由于出现较高质量浓度的TBAA,致使7月质量浓度远高于12月质量浓度。
桐江溪HAAs质量浓度在不同潮汐下的分布情况,以7月涨退潮而言,DCAA涨潮质量浓度分布为上游高于下游,退潮则无明显趋势。TCAA涨退潮质量浓度分布情况一致,均呈现上游至下游逐渐降低的趋势。以12月涨潮与7月涨潮质量浓度差异而言, DCAA质量浓度12月下游高于上游, 7月上游高于下游;TCAA质量浓度12月与7月的分布特征相同,均为上游高于下游,且7月呈现由上游至下游逐渐降低的趋势。HAA5在12月质量浓度无明显变化趋势,7月质量浓度分布特征为上游高于下游,且呈现逐渐降低趋势。HAA9质量浓度7月涨退潮均高于12月,但没有明显分布特征趋势。SCOTT等[5]的研究显示,东京湾涨潮时的TBAA质量浓度高于退潮时的浓度,但对HAA9质量浓度影响无明显趋势;DAVID等[14]和MARTIN等[15]的研究显示,潮汐对HAA9质量浓度的影响呈现正相关。这与本研究的结果不同,可能是由于桐江溪水中含有某种物质影响了溴化HAAs的生成,这需要后续进一步研究,也反映出不同水体的水质特性可能不同。
3结论
1)HAAs为普遍存在于桐江溪的污染物质,其中HAA5质量浓度为0.44~3.39 μg/L,HAA9质量浓度为0.83~56.15 μg/L。HAA5主要为DCAA与TCAA,HAA9主要为TBAA,影响桐江溪HAAs质量浓度的主要为TBAA。后续需要对桐江溪上游沸石矿尾矿库加强截排水以及植物保护措施,控制Br-进入桐江溪中。
2)桐江溪HAAs质量浓度的空间分布,TCAA主要来源为主河段上游,TBAA为支流上游沸石矿尾矿库冲刷Br-进入河段产生,主要分布在河流中下游段(J3—J10);HAA5质量浓度以上游高于下游,HAA9质量浓度与TBAA质量浓度分布特征相同。桐江溪HAAs质量濃度的季节分布,HAA5与HAA9质量浓度均是7月高于12月。
3)桐江溪HAAs与水质特性的相关性分析结果显示,温度与HAA9呈现正相关,而pH值与HAA9呈现负相关,温度与pH值均会影响桐江溪中HAAs的含量。
4)桐江溪HAAs质量浓度在不同潮汐下的分布情况来看,TCAA的质量浓度于相同季节不同潮汐,及不同季节相同潮汐时均呈现上游比下游高的情况,其他HAAs均不因涨退潮而发生质量浓度变化,无法判定潮汐作用对HAAs质量浓度的影响。
5)掌握桐江溪HAAs的含量、时空分布规律及来源,探讨其与水质的相关性,对于净水工艺选择、水厂出水HAAs含量的溯源分析、水体环境风险评估以及研究水生生物体内HAAs的累积效应等具有重要意义。后续应加强对桐江溪水体中浮游植物群落组成与结构变化的生物学监测,这是进行桐江溪水质监测及生态保护的重要途径之一[16]。
参考文献/References:
[1]SHANGCHAO Y, LEIJUN Z, XIUDUO W, et al.Rejection of haloacetic acids in water by multi-stage reverse osmosis: Efficiency, mechanisms, and influencing factors[J].Water Research,2018,144(7):383-392.
[2]SAENGCHUTP,KARUCHITS, PENTAMWAP.Investigation of haloacetic acids (HAAs) levels in water supply and its correlated HAAs formation[J].IOP Conference Series: Earth and Environmental Science,2018,164(1):165-171.
[3]BU Yinan, WANG Liwei, CHEN Baiyang, et al.Effects of typical water components on the UV254 photodegradation kinetics of haloacetic acids in water[J].Separation and Purification Technology,2018,200:255-265.
[4]RUNMIAO X,HONGLAN S,YINFA M, et al. Evaluation of thirteen haloacetic acids and ten trihalomethanes formation by peracetic acid and chlorine drinking water disinfection[J]. Chemosphere,2017,189(11):349-356.
[5]SCOTT B F,SPENCER C,MARVIN C H, et al. Distribution of haloacetic acids in water coumns of the Laurentian Great Lakes and Lake Malawi[J]. Enviromental Science & Technology,2002,36(9):1893-1898.
[6]ZHANG Junzhi, YU Jianwei, AN Wei, et al. Characterization of disinfection byproduct formation potential in 13 source waters in China[J]. Journal of Environmental Sciences, 2011, 23(2):183-188.
[7]PETERSR J B.Chloroacetic acids in European soils and vegetation[J].Journal of Environment Monitoring,2003,5(2):275-280.
[8]国家环境保护总局. 水和废水监测分析方法[M]. 4版. 北京:中国环境科学出版社, 2002:211-213, 566-574.
[9]张子秋,罗茜,王东红,等.饮用水中9种卤乙酸的同时测定方法[J].环境化学,2011,30(2):574-576.
ZHANG Ziqiu,LUO Qian,WANG Donghong,et al.Simultaneous determination of nine haloacetic acids in drinking water by GC-ECD[J].Environmental Chemistry,2011,30(2):574-576.
[10]王坤丽,赵旭,吴丽颖.反相高效液相色谱法快速分析紫脲酸[J].河北工业科技,2015,32(4):318-321.
WANG Kunli,ZHAO Xu,WU Liying.Rapid analysis of violuric acid by reversed phase high performance liquid chromatography[J].Hebei Journal of Industrial Science an Technology,2015,32(4):318-321.
[11]陳丽珠,巢猛,刘清华,等.臭氧-生物活性炭控制有机物和消毒副产物研究[J].给水排水,2015,41(11):37-40.
CHEN Lizhu, CHAO Meng, LIU Qinghua, et al. Study on ozone-biological activated carbon to control organics and disinfection by-products[J]. Water & Wastewater Engineering, 2015, 41(11):37-40.
[12]HANSON M L,SOLOMON K R.Haloacetic acids in the aquatic environment PartⅠ:Macrophytetoxicity[J].Enviromental Pollution,2004,130(3):371-383.
[13]HANSON M L,SOLOMON K R.Haloacetic acids in the aquatic environment PartⅡ: Ecological risk assessment[J].Enviromental Pollution,2004,130(3):385-401.
[14]DAVID AE,MARK LH,PAUL KS,et al.The fate and persistence of triuoroacetic and chloroaceticacids in pond waters[J].Chemosphere,2001,42(2):309-318.
[15]MARTIN J,FRANKLIN.Detection of chlorodiuoroacetic acid in precipitation:Apossible product of uorocarbondegradation[J].Enviromental Science & Technology,2000,43(2):274-281.
[16]闫路娜,王艳,沈洪艳,等.春季石家庄市水体浮游植物群落结构调查与分析[J].河北工业科技,2019,36(3):206-214.
YAN Luna, WANG Yan,SHEN Hongyan,et al.Investigation and analysis of phytoplankton community structurein waters of Shijiazhuang City during spring season[J].Hebei Journal of Industrial Science and Technology,2019,36(3):206-214.

