胶质母细胞瘤病人外周血中相关miRNA表达及其与肿瘤分级和预后相关性
吕江峰 刘珊 王琳娜 陈晶

[摘要]目的 探讨胶质母细胞瘤(GM)病人外周血中miRNA的表达情况及其与肿瘤分级和预后之间的相关性。方法 应用实时荧光定量PCR法检测40例GM病人(GM组)和40例健康人(对照组)外周血中miR-106b-5p、miR-196b-5p、miR-483-5p、miR-513a1-5p、miR-574-3p及miR-197-5p的表达水平,分析其表达与GM病理分级和预后的相关性。结果 GM组病人外周血中miR-106b-5p、miR-196b-5p、miR-483-5p和miR-574-3p的表达明显高于对照组,差异具有统计学意义(t=4.626~7.013,P<0.01);两组miR-513a1-5p及miR-197-5p的表达差异无统计学意义(P>0.05)。外周血中miR-106b-5p和miR-574-3p的表达与GM病理分级及预后均有显著相关性(U=314.047、313.500,χ2=8.205、9.114,P<0.01)。结论 外周血中miR-106b-5p和miR-574-3p的表达或许可以作为GM病人肿瘤分级及预后的诊断标志物。
[关键词]胶质母细胞瘤;微RNAs;病理学,临床;预后
[中图分类号]R739.41
[文献标志码]A
[文章编号] 2096-5532(2019)05-0552-05
doi:10.11712/jms201905012
[开放科学(资源服务)标识码(OSID)]
胶质母细胞瘤(GM)恶性程度高,侵袭性强,术后易复发,预后极差,病程超过1年者不足10%,严重威胁着病人的生命健康[1-2]。根据世界卫生组织颁布的最新指南,GM在组织病理学上被划分为4级[3]。其中Ⅳ级是恶性度最高也是最常见的级别,一般由影像学结合病理学来诊断。但病理学和影像学诊断灵敏度较低且费用高[4],并伴有手术本身带来的出血及神经压迫的潜在风险。因此,开发一种成本低廉且可以在短时间内监测肿瘤的新的标志物很有必要。虽然血液循环标志物作为癌症的早期检查手段已经建立,但其在胶质瘤诊断中的应用还是非常有限。微小RNA(miRNA)作为无创的肿瘤诊断标志物已经越来越得到认可和广泛应用,目前其检测已经延伸到胶质瘤的预后、病理分级及药物应答等方面[5-7]。根据前期的相关文献报道[6,8-9],本實验选择了miR-106b-5p、miR-196b-5p、miR-483-5p、miR-513a1-5p、miR-574-3p及miR-197-5p作为在GM中进一步验证的目的miRNA,并且探讨其表达与GM病理分级和预后的相关性,以期为miRNA在GM中作为无创检测标志物提供实验依据。现将结果报告如下。
1 资料与方法
1.1 一般资料
以2014年5月—2017年5月在青岛市中心医院就诊的GM病人40例为GM组,同期收集年龄及性别与GM组相匹配的健康体检者40例作为对照组。GM组病人,男25例,女15例;年龄为35~61岁,平均(49.21±8.72)岁;均由病理科资深病理医师诊断为多形性GM;根据WHO 2015年的标准,其病理分级为Ⅰ级5例,Ⅱ级8例,Ⅲ级17例,Ⅳ级10例。本研究临床资料的获取程序及研究设计均符合青岛市中心医院医学伦理委员会制定的伦理学标准,研究对象均签署知情同意书。
1.2 仪器与试剂
仪器:IQ5 Real-time PCR 仪(美国Bio-Rad公司产品);Eppendorf离心机(德国Eppendorf公司产品);Nanodrop 2000紫外线分光光度计(美国Thermo Fishers公司);恒温水浴锅(上海凌科公司)。试剂:Trizol RNA提取试剂盒(美国Life公司);Revert AidTM First Strand cDNA反转录试剂盒(立陶宛Fermentas公司);实时荧光定量PCR试剂盒(日本Takara公司)。
1.3 检测方法
1.3.1 标本采集及处理 用EDTA抗凝管收集新鲜外周血3 mL,置于-80 ℃冰箱长期保存供研究使用。用Trizol RNA提取试剂盒提取外周血清中总RNA,参照反转录试剂盒说明书将总RNA反转录成cDNA,将cDNA置于-20 ℃冰箱中待测。
1.3.2 实时荧光定量PCR检测miRNA表达 采用SYBR Green染料法,以cDNA为模板,在IQ5 Real-time PCR仪上进行PCR扩增检测。所有待检测miRNA的茎环法反转录引物及上下游引物均由上海生工生物工程有限公司设计合成,其引物序列见表1。取0.5 μL的 cDNA作为模板,加入2×TaKaRa SYBR Premix Ex 12.5 μL,上下游引物0.5 μL,以双蒸水补足至25 μL,混匀并经短暂离心后,在PCR仪上进行扩增检测。PCR反应条件:95 ℃预变性3 min;95 ℃变性10 s、60 ℃退火30 s、72 ℃合成40 s,40个循环。以U6作为内参基因,每个样本均设3个复孔。miRNA相对表达量的计算采用2-△△Ct 法。
1.4 统计学处理
应用SPSS 16.0软件进行统计学处理。计量资料先进行Kolmogorov-Smirnov正态性检验,符合正态分布的数据以[AKx-D]±s表示,不符合正态分布的数据以中位数和四分位数间距表示。符合正态分布的数据组间比较采用独立样本t检验,不符合正态分布的数据组间比较采用Mann-Whitney U检验;计数资料组间比较采用卡方检验或Fisher精确概率法;miRNA表达与GM病人预后的相关性分析采用Log-Rank检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组miRNA表达的比较
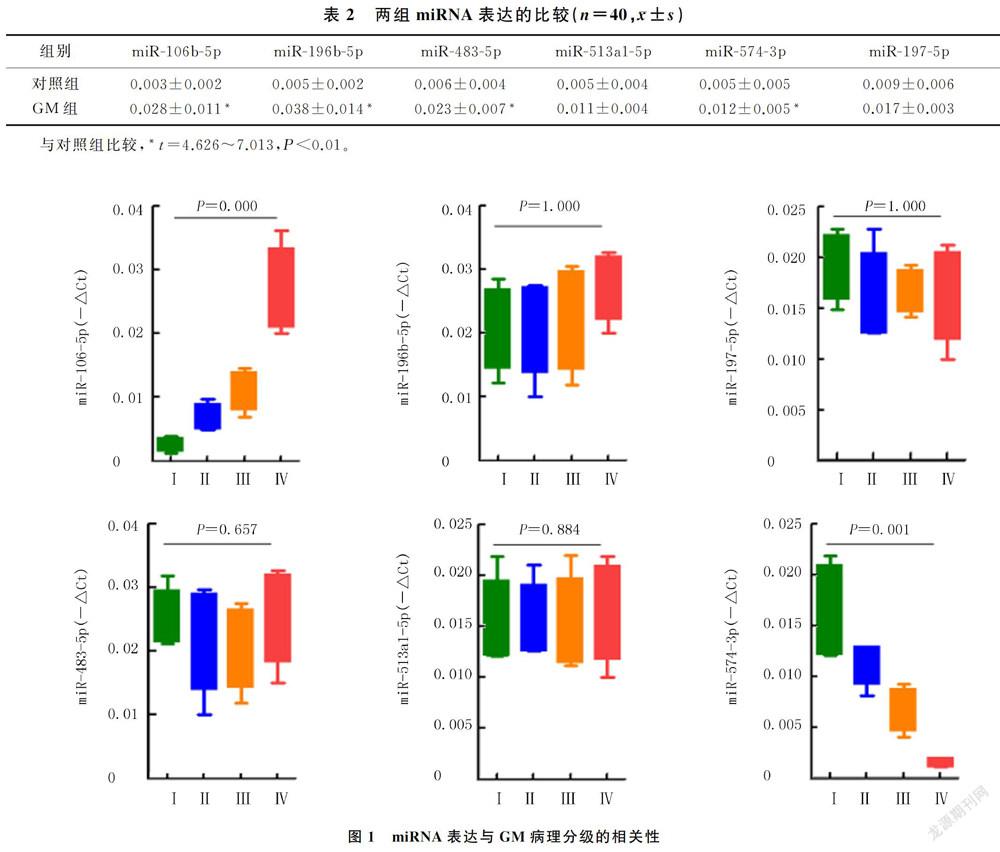
GM组病人外周血中miR-106b-5p、miR-196b-5p、miR-483-5p和miR-574-3p的表达明显高于对照组,差异具有统计学意义(t=4.626~7.013,P<0.01);两组miR-513a1-5p及miR-197-5p的表达差异无统计学意义(P>0.05)。见表2。
2.2 miRNA表达与GM病理分级的相关性
外周血中miR-106b-5p和miR-574-3p的表达与GM的病理分级具有显著相关性(U=314.047、313.500,P<0.01),miR-106b-5p的表达随着GM病理分级的增高而增加,miR-574-3p的表达则随着GM病理分级的增高而降低;其他miRNA的表达与GM病理分级均无相关性(P>0.05)。见图1。
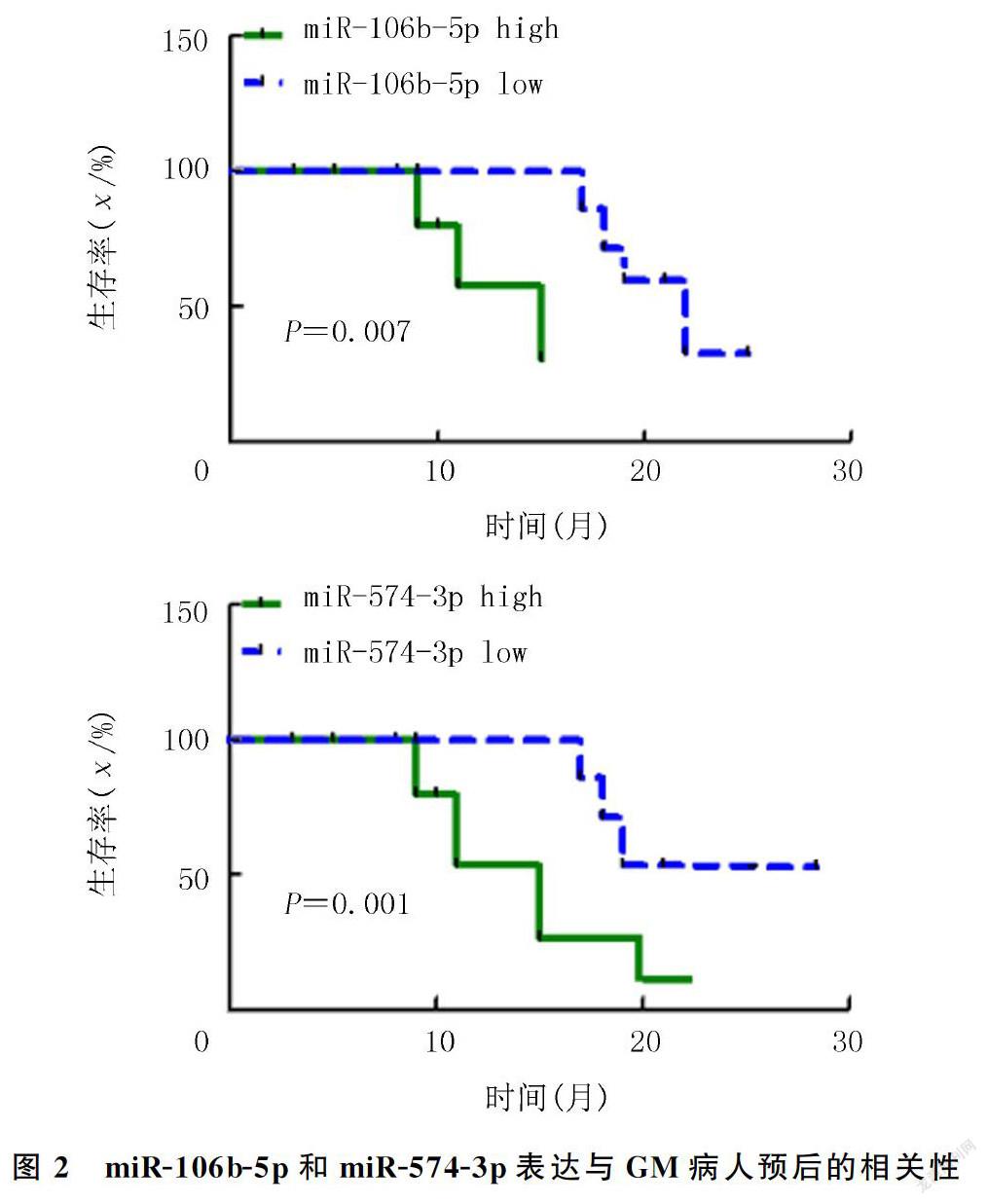
2.3 miRNA表达与GM病人预后的相关性
本文40例GM病人的血清miRNA表达量经Kolmogorov-Smirnov正态性检验均符合正态分布。以各miRNA的平均表达量作为cut-off值,将每种miRNA分为高表达(高于平均表达量)和低表达(低于平均表达量)。Log-Rank检验结果显示,在6种miRNA中,只有miR-106b-5p(χ2=8.205,P<0.01)和miR-574-3p(χ2=9.114,P<0.01)的表达与病人的预后具有相关性,miR-106b-5p和miR-574-3p的表达水平越高,病人的预后越差(图2);而其他4种miRNA的表达与GM病人的预后则无相关性(P>0.05)。
3 讨论
miRNA作为一类内源性的在进化上高度保守的单链非编码小RNA,具有稳定、组织特异性、检测灵敏等优点,逐渐成为疾病无创诊断和预后判断的理想生物标志物[6]。根据前期的相关文献报道[8],本研究选择miR-106b-5p、miR-196b-5p、miR-483-5p、miR-513a1-5p、miR-574-3p及miR-197-5p作为检测指标。
本文对这6种miRNA的检测结果显示,GM组病人外周血中miR-106b-5p、miR-196b-5p、miR-483-5p和miR-574-3p的表达均显著高于对照组,而两组miR-513a1-5p及miR-197-5p的表达差异无统计学意义。就miR-197-5p的表达差异而言,本文结果与YANG等[10]的研究结果不一致。YANG等[10]研究显示,恶性星形细胞瘤病人术前术后miR-197的表达差异具有统计学意义。结果不一致的原因主要为两者研究对象不一样,此外,本研究检测的是miR-197的5′端(即miR-197-5p),而YANG等[10]检测的是miR-197,并未交代是5′端还是3′端。鉴于同一个miRNA的5′端和3′端所介导的生物学功能不一样[10],源于5′端和3′端的同一个miRNA其表达模式也不一样[11],所以本研究结果和YANG等[10]结果严格来说是不具有可比性的。而对于miR-197在胶质瘤中的功能而言,两项体外研究均支持miR-197在胶质瘤中作为一种抑癌基因存在[12-13]。BARCISZEWSKA等[14]在其综述中也提到,miR-197在胶质瘤中被预测为表达下调,但是并未提供直接的实验证据。本研究结果显示,相较于正常对照,miR-197-5p在多形性GM病人血清中呈表达上调,但是差异并无统计学意义。目前,miR-574在GM中的表达未見有研究报道,但是在其他类型的肿瘤中有报道[15-17]。本研究首次报道了miR-574在GM病人血清中呈显著高表达,此结果还有待于进一步验证。WANG等[18]的研究结果显示,相较于癌旁正常组织,胶质瘤组织中miR-483-5p呈显著低表达。本文研究结果显示,miR-483-5p在GM病人血清中呈显著高表达。本研究结果与WANG等[18]研究结果不一致,导致差异的原因目前尚不清楚。关于miR-106b-5p和miR-196b-5p在GM病人血清中的表达水平,本文研究结果与先前有关miR-106b和miR-196b在胶质瘤中的研究报道结果是高度一致的,这两种miRNA在胶质瘤中都是研究较为透彻的致癌miRNA[19]。本文研究结果显示,miR-106b-5p和miR-574-3p的表达上调与GM的病理分级和不良预后均具有显著相关性。因为大量的临床及基础研究证实了miR-106b在胶质瘤中起着癌基因的作用[20-22],所以本研究miR-106b-5p表达上调与GM的病理分级和不良预后具有显著相关性的结果不难理解。但是,miR-574-3p在胶质瘤中的作用目前尚未有研究报道,该结果尚需进一步验证。
尽管首次报道了miR-574-3p在GM病人血清中的表达及其病理学的意义,但是本研究仍然存在一定的局限性。首先,本研究所纳入的外周血标本均为-80 ℃冰箱冻存标本,而非新鲜外周血标本,样本的质量可能会对检测结果有一定的影响[23];其次,本研究主要从外周血的血清中而非总外周血中提取miRNA进行检测[24],考虑到血清和外周血中miRNA的丰度不一样[23],这可能有助于解释为什么本研究部分结果与既往研究结果不一致[25];最后,本研究的样本数有限,需要在后续实验中进一步扩大样本数进行验证[26]。
综上所述,本研究检测了6种相关miRNA在GM病人血清中的表达水平并分析了其表达的临床病理学的意义,结果显示,miR-106b-5p、miR-196b-5p、miR-483-5p和miR-574-3p在GM组外周血中的表达显著高于其在对照组中的表达,miR-106b-5p和miR-574-3p的异常表达与GM的病理分级和不良预后均具有显著相关性,提示miR-106b-5p和miR-574-3p的表达或许可以作为GM病人的血清诊断标志物。
[參考文献]
[1]STOYANOV G S, DZHENKOV D, GHENEV P, et al. Cell biology of glioblastoma multiforme:from basic science to diagnosis and treatment[J]. Medical Oncology, 2018,35(3):27.
[2]LI Xuezhen, LI Yanbin, CAO Yang, et al. Risk of subsequent cancer among pediatric, adult and elderly patients following a primary diagnosis of glioblastoma multiforme:a population-based study of the SEER database[J]. International Journal of Neuroscience, 2017,127(11):1005-1011.
[3]PAUL Y, MONDAL B, PATIL V, et al. DNA methylation signatures for 2016 WHO classification subtypes of diffuse gliomas[J]. Clinical Epigenetics, 2017,9:32.
[4]HUANG R Y, NEAGU M R, REARDON D A, et al. Pitfalls in le neuroimaging of glioblastoma in le era of antiangiogenic and immuno/targeted therapy-detecting illusive disease, defining response[J]. Frontiers in Neurology, 2015,6:33.
[5]YE Xinyun, WEI Wenjin, ZHANG Zhengyu, et al. Identification of microRNAs associated with glioma diagnosis and prognosis[J]. Oncotarget, 2017,8(16):26394-26403.
[6]SHEN Li, LIN Yuxin, SUN Zhandong, et al. Knowledge-guided bioinformatics model for identifying autism spectrum disorder diagnostic microRNA biomarkers[J]. Scientific Reports, 2016,6:39663.
[7]TUMILSON C A, LEA R W, ALDER J E, et al. Circulating microRNA biomarkers for glioma and predicting response to therapy[J]. Molecular Neurobiology, 2014,50(2):545-558.
[8]BARCISZEWSKA A M. MicroRNAs as efficient biomarkers in high-grade gliomas[J]. Folia Neuropathologica, 2016,54(4):369-374.
[9]YANG Cuihua, WANG Cheng, CHEN Xi, et al. Identification of seven serum microRNAs from a genome-wide serum microRNA expression profile as potential noninvasive biomarkers for malignant astrocytomas[J]. Int J Cancer, 2013,132(1):116-127.
[10]MARCO A, MACPHERSON J, RONSHAUGEN M, et al. MicroRNAs from the same precursor have different targeting properties[J]. Silence, 2012,3(1):8.
[11]GUO Li, ZHANG Hui, ZHAO Yang, et al. Selected isomiR expression profiles via arm switching[J]? Gene, 2014,533(1):149-155.
[12]ZHANG Guifang, SUN Weibo, ZHU Liangfu, et al. Overexpressed circ_0029426 in glioblastoma forecasts unfavorable prognosis and promotes cell progression by sponging miR-197[J]. Journal of Cellular Biochemistry, 2019,120(6):10295-10302.
[13]TIAN Liqiang, LIU Enqin, ZHU Xide, et al. MicroRNA-197 inhibits cell proliferation by targeting GAB2 in glioblastoma[J]. Molecular Medicine Reports, 2016,13(5):4279-4288.
[14]BARCISZEWSKA A M, GURDA D, GLODOWICZ P A, et al. A new epigenetic mechanism of temozolomide action in glioma cells[J]. PLoS One, 2015,10(8):e0136669.
[15]SAUL M J, BAUMANN I, BRUNO A, et al. miR-574-5p as RNA decoy for CUGBP1 stimulates human lung tumor growth by mPGES-1 induction[J]. FASEB J, 2019. doi:10.1096/fj.201802547R.
[16]SUN F D, WANG P C, LUAN R L, et al. MicroRNA-574 enhances doxorubicin resistance through down-regulating SMAD4 in breast cancer cells[J]. European Review for Medical and Pharmacological Sciences, 2018,22(5):1342-1350.
[17]ZHOU Rui, ZHOU Xiaoshu, YIN Zhongyuan, et al. Micro-RNA-574-5p promotes metastasis of non-small cell lung cancer by targeting PTPRU[J]. Scientific Reports, 2016,6:35714.
[18]WANG Li, SHI Ming, HOU Shuangxing, et al. MiR-483-5p suppresses the proliferation of glioma cells via directly targeting ERK1[J]. FEBS Letters, 2012,586(9):1312-1317.
[19]LIU F, GONG J, HUANG W, et al. MicroRNA-106b-5p boosts glioma tumorigensis by targeting multiple tumor suppressor genes[J]. Oncogene, 2014,33(40):4813-4822.
[20]AMES H, HALUSHKA M K, RODRIGUEZ F J. miRNA regulation in gliomas:usual suspects in glial tumorigenesis and evolving clinical applications[J]. Journal of Neuropathology and Experimental Neurology, 2017,76(4):246-254.
[21]CODO P, WELLER M, MEISTER G, et al. MicroRNA-mediated down-regulation of NKG2D ligands contributes to glioma immune escape[J]. Oncotarget, 2014,5(17):7651-7662.
[22]ZHANG Anling, HAO Jianwei, WANG Kun, et al. Down-regulation of miR-106b suppresses the growth of human glioma cells[J]. Journal of Neuro-Oncology, 2013,112(2):179-189.
[23]BLONDAL T, NIELSEN S J, BAKER A A, et al. Assessing sample and miRNA profile quality in serum and plasma or other biofluids[J]. Methods, 2013,59(1):S1-S6.
[24]SHIOTSU H, OKADA K, SHIBUTA T, et al. The influence of pre-analytical factors on the analysis of circulating micro-
RNA[J]. Microrna, 2018,7(3):195-203.
[25]SKOGHOLT A H, RYENG E, ERLANDSEN S E, et al. Gene expression differences between PAX gene and Tempus blood RNA tubes are highly reproducible between independent samples and biobanks[J]. BMC Research Notes, 2017,10(1):136.
[26]SRIVASTAVA K, TYAGI K. Single nucleotide polymorphisms of microRNA in cardiovascular diseases[J]. Clinica Chimica Acta, 2018,478:101-110.
(本文編辑 马伟平)

