外瓶霉属Exophiala一中国新记录种
任朋朋 姜于兰

摘 要:采集贵州凯里雷山森林公园的土壤,分离得到一株丝状真菌,结合形态特征及分子系统学分析基于 ITS、TEF1-a和LSU三个基因片段,在系统进化树上,菌株HGUP-R300 与Exophiala abietophila聚集在一起,并且形成100%的支持率,将该种鉴定为Exophiala abietophila。
关键词:外瓶霉;形态学;分子系统学;新记录;中国
中图分类号:S432.1
文献标识码:A
文章编号:1008-0457(2019)05-0084-05 国际DOI编码:10.15958/j.cnki.sdnyswxb.2019.05.015
A New Recorded Species of Exophiala in China
REN Peng-peng1 JIANG Yu Lan*
(Department of Plant Pathology, Agricultural College, Guizhou University, Guiyang, Guizhou 550025, China)
Abstract::A newly recorded strain of the genus Exophiala was isolated from the soil of the forest of Leishan in Kaili, Guizhou. This species was identified by combining morphological characters and phylogenetic analysis based on sequences of Internal Transcribed Spacer (ITS), Ribosomal Large Subunit (LSU), and translation elongation factor 1-alpha(TEF1-α)gene. The phylogenetic analysis revealed that the strain HGUP-R300 was clustered with Exophiala abietophila. The strain was strongly supported to be identified as E. abietophila. The holotype and ex-type cultures are preserved in the Plant Pathology Laboratory of Guizhou University( HGUP).
Key words: Exophiala;Morphology; Molecular phylogeny; New recorder; China
外瓶霉属Exophiala J.W.Carmich由J.W.Carmich于1966年建立,属于子囊菌门盘菌亚门刺盾炱纲刺盾炱目小疱毛壳科,Carmich 在1966年从鲑鱼鱼头上分离得到Exophiala.salminis,并且以该种为模式种建立外瓶霉属Exophiala[1]。该属主要的形态特征是菌落疏展,生长缓慢,菌丝体埋生或表生,无子座,隔膜与附属丝缺乏;分生孢子梗直立或弯曲,不分枝或不规则分枝,光滑,浅橄榄色到棕色;产孢细胞单瓶梗式。
该属真菌分布广泛,通常从土壤、木材以及一些植物材料上分离得到。
外瓶霉属Exophiala 属于黑酵母真菌,该属的种大都引起人类疾病[2],例如,引起人的皮肤病,其中,E.spinifera的致病性最强[3],基于ITS、TEF1-α、BT2、ACT1四个基因构建多基因和单基因进化树,结果显示:ITS等基因片段能用于外瓶霉属属内部分真菌进行初步鉴定[4]。近年来,分子技术的普及使得真菌分类有了新的研究方法,越来越多的研究者采用分子技术来解决形态相似属间、种间及种下单位等真菌类群间的分类学问题[5]。
在外瓶霉属的分类鉴定过程中,许多学者对于外瓶霉属种类数量,仍然存在分歧,目前Mycobank Database(http://www.mycobank.org)记录58种(截止2018年12月),Index Fungal Database(http://www.speciesfungorum.org)记录56种(截止2019年4月)。2018年4月,笔者收集贵州省雷公山国家自然保护区的土壤标本,从暗色丝孢菌中分离获得一株未知真菌。查阅资料并结合形态学与分子系统学的分析结果,确认该菌为中国真菌新记录种。
1 材料与方法
1.1 标本和菌株
土壤样品于2018年4月采于贵州省雷公山自然保护区(E108°09′~108°22′,N26°15′~26°22′),样品编号为LGS-R147,放入塑料袋,土壤平板稀释法[6]进行真菌分离。
1.2 获得纯菌种
使用马铃薯琼脂培养基PDA纯化菌株,研究标本保存在贵州大学植物病理学实验室(HGUP),菌株编号为HGUP-R300。
1.3 菌株DNA提取、PCR扩增与测序
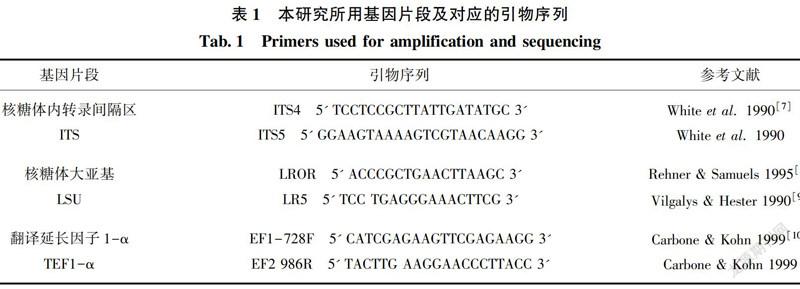
菌株DNA的提取采用试剂盒 Fungal gDNA Kit GD2416(Biomiga 公司生产),并按照说明方法进行提取。选择相应的引物对菌株DNA进行ITS(ITS4/ITS5)、LSU(LROR/LR5)与TEF1-α(EF1-728F/EF-986R)三个片段进行扩增测序。本研究使用25 μL PCR反应体系,其中正反向引物各1 μL,DNA模板1 μL,ddH2O 9.5 μL,Taq聚合酶12.5 μL,PCR產物经电泳检测,合格的样品,送到上海生物工程技术服务有限公司进行测序。所用基因片段与引物如表1所示。
1.4 分子系统学
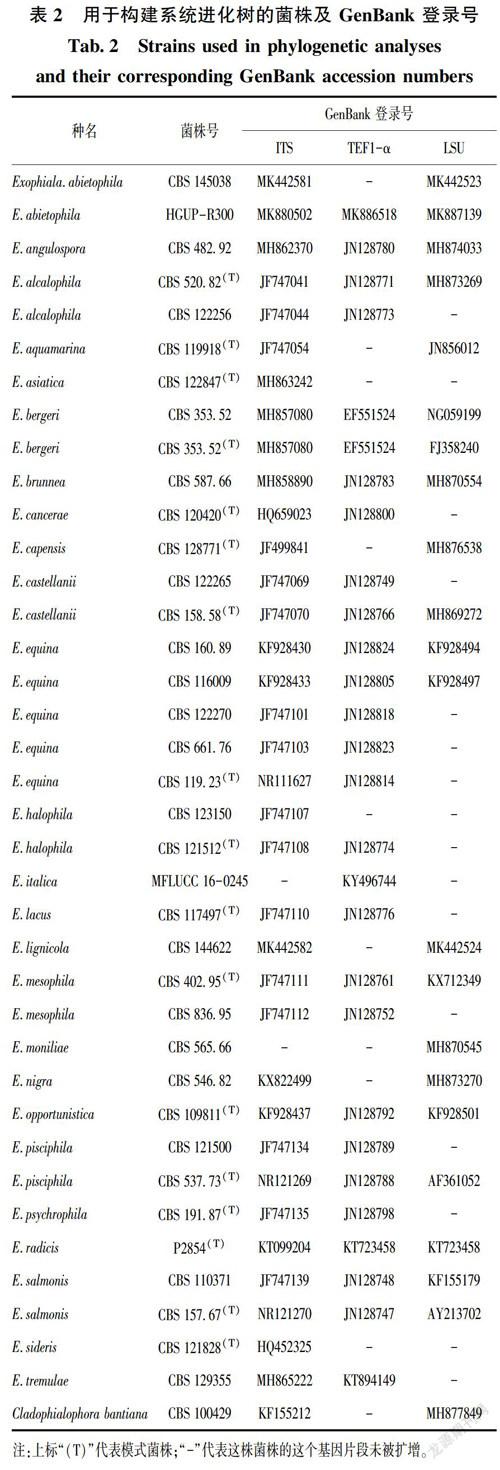
用Bioedit软件结合序列峰图检测从测序公司获得的序列是否准确,若显示双峰或杂峰,则序列不可信,需要重新测序。将峰值整齐的序列上传到 NCBI(National Center for Biotechnology Information)的BLAST(Basic Local Alignment Search Tool)进行比对,确定其属级分类地位。将测序结果正常的序列上传GenBank 并获取基因登录号。通过参阅相关文献,从GenBank中下载参比序列(权威期刊最新发表外瓶霉属的基因序列),如表2所示。将用于构建系统进化树的序列经Bioedit进行比对及手工校正后[11],保存为Fasta格式,然后在MEGA7.0.26里面按ITS+TEF1-α+LSU的顺序进行基因拼接,输出为NEXUS/PAUP格式,用系统发育分析软件PAUP*4.0b10(Swofford2002)运行该文件,所有碱基位点进行随机处理,缺失碱基视为数据缺失;分析主要参数设置为:最大树值设置为5000,Bootstrap自举检测值为1000,执行最大简约(maximum parsimony,MP)法的分析运算,得到系统进化树,如图1所示。
1.5 形态学记述
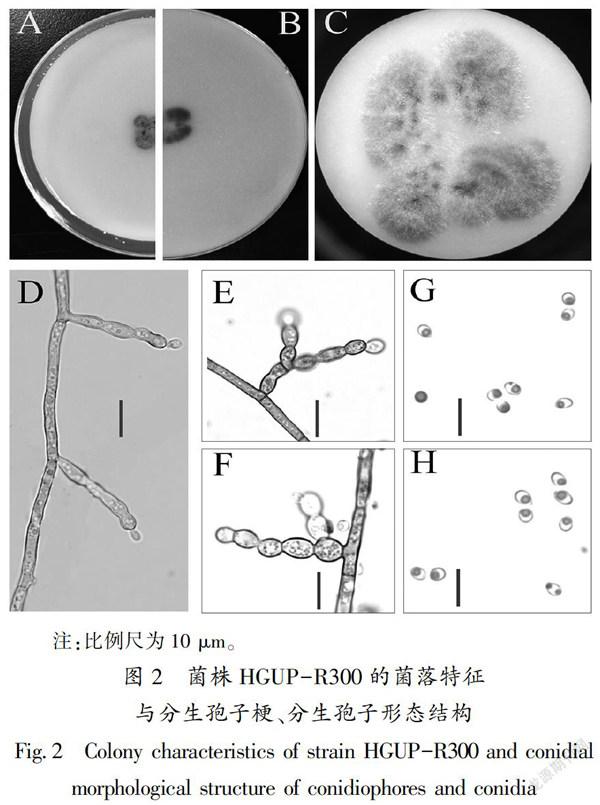
分离纯化菌株,待其在燕麦培养基(配方:20 g燕麦片,5 g琼脂糖,1000 mL自来水,混合煮沸,过滤,灭菌备用)上产孢后(25℃,20~25 d),挑取分生孢子和分生孢子梗做成洁净的玻片于光学显微镜下(Olympus BX53,Japan)观察拍照,记述菌株的形态显微结构特征,并做出合格图版。
2 结果与分析
2.1 系统发育分析
该进化树组合了38个分类单元的ITS + TEF1-α+LSU共87条序列所构建,共有1819位点,其中,672个一致性位点,663个可变信息位点,484个信息位点。树长(TL)为2543,一致性指數(CI)为0.6461,保存力指数(RI)为0.6920,相似性指数为(0.3539)。从图1可知,菌株HGUP-R300(进化树加粗部分)以100%的进化支持率与菌株Exophiala abietophila BS 145038 聚在一起,自举支持率很高,与其呈现出同等的分类地位。
2.2 形态学描述
Exophiala abietophila Crous & R.K. Schumach.
在燕麦培养基上,菌丝稀疏,浅棕色,菌落生长缓慢,25℃光照培养25~27 d直径为30~40 mm,菌落棕土色一般疏展,无子座,附属丝与刚毛缺乏;菌丝光滑有隔膜,表生或埋生,半透明到橄榄至棕色。分生孢子梗(11~22 μm×2~3 μm),半直立或弯曲,不分枝或不规则分枝,不分枝时在梗顶端直接进行产孢。产孢梗内壁芽生单瓶梗式产孢,产孢位点浅棕色,安瓿形或瓮形。分生孢子(1.8~2.4 μm×1.6~2.0 μm),椭球形或球形,平滑,无隔膜,无色透明或半透明,尖端钝圆,内具1~2个油滴[12]。
3 结论与讨论
外瓶霉属真菌中的大部分种类是一类能使人、动物与植物患病的病原菌。如E.dermatitidis导致人的皮炎[13],E.salmonis能够引起鲑鱼肾脏的肿胀[14]。在鉴定过程中,我们首先选取了ITS(该基因片段是真菌研究中最常用的序列标记),对菌株的属级分类地位进行确认,达到与形态学相同的鉴定结果,然后选取另外两个片段(TEF1-α与LSU)时发现,3个片段在软件Mega7里的加合顺序会影响进化树的自举支持率,在查阅文献[15]的基础上,发现本研究的加合方式更能确定菌株HGUP-R300的分类地位。
从前人研究结果看[16],外瓶霉属分类工作一直不稳定。该属建立至今,属下种的形态学特征变化较大,产孢较慢,不易鉴定,单靠形态学难以准确鉴定到种级水平。本研究结合分子系统学,认为菌株HGUP-R300与Crous P W等人[10]发表的E.abietophila菌株为同一个种。
真菌的准确鉴定在真菌物种多样性考察过程中尤为重要[17],在一些真菌无法产孢或产孢较慢时,可以先对其进行分子系统学研究,辅以形态学研究补充。
菌株HGUP-R300的属级特征满足外瓶霉属的属级特征,尽管环痕条带有时不明显,但它仍是外瓶霉属真菌的主要鉴别特征。
参 考 文 献:
[1] Carmichael J W . Cerebral mycetoma of trout due to a phialophora-like fungus[J].Sabouraudia, 1966, 5(2):120.
[2] Hyde, K.D., Al-Hatmi, A.M.S., et al. The world’s ten most feared fungi.[J].Fungal Diversity,2018,93:161.
[3] Vitale R G , De Hoog G S . Molecular diversity, new species and antifungal susceptibilities in the Exophiala spinifera clade[J].Medical Mycology, 2002, 40(6):545-556.
[4] Zeng J , Feng P , A. H. G. Gerrits van den Ende, et al. Multilocus analysis of the Exophiala jeanselmei clade containing black yeasts involved in opportunistic disease in humans[J].Fungal Diversity, 2014, 65(1):3-16.
[5] Zhang Y, Crous P W, Schoch C L, et al. Pleosporales[J].Fungal Diversity, 2012, 53(1):1-221.
[6] 杨亚曦. 云南西部和贵州韭菜坪土壤暗色丝孢菌多样性研究[D].贵阳:贵州大学,2016:15-16.
[7] White T J . Amplification and direct seqencing of fungal ribosomal RNA genes for phylogenetics[J].PCR Protocols, A Guide to Methods and Applications, 1990.
[8] Rehner S A , Samuels G J . Molecular systematics of the Hypocreales:a teleomorph gene phylogeny and the status of their anamorphs[J].Canadian Journal of Botany, 1995, 73(S1):816-823.
[9] Vilgalys R, Hester, M. Rapid genetic identification and mapping of enzymatically amplified ribosomal DNA from several Cryptococcus species[J].Journal of Bacteriology, 1990, 172(8):4238-4246.
[10] Carbone I, Kohn, Linda M. A Method for Designing Primer Sets for Speciation Studies in Filamentous Ascomycetes[J].Mycologia, 1999, 91(3):553-556.
[11] Zhao C L , Cui B K , Dai Y C . New species and phylogeny of Perenniporia based on morphological and molecular characters[J].Fungal diversity, 2012, 58(1):47-60.
[12] 王坤英, 姜于蘭. 分离自土壤Paraboeremia属真菌一新记录种[J].山地农业生物学报, 2019,38(1):6-9.
[13] de Hoog G S, Matos T, Sudhadham M, et al. Intestinal prevalence of the neurotropic black yeast Exophiala (Wangiella) dermatitidis in healthy and impaired individuals[J].Mycoses, 2010, 48(2):142-145.
[14] Richards R H , Holliman A , Helgason S . Exophiala salmonis infection in Atlantic salmon Salmo salar L[J].Journal of Fish Diseases, 2010, 1(4):357-368.
[15] Crous P W , Schumacher R K , Akulov A , et al. New and Interesting Fungi. 2[J].Fungal Systematics and Evolution, 2019.
[16] Crous P W , Schubert K , Braun U , et al. Opportunistic, human-pathogenic species in the Herpotrichiellaceae are phenotypically similar to saprobic or phytopathogenic species in the Venturiaceae[J].Studies in Mycology, 2007, 58(58):185-217.
[17] Jeewon , Rajesh & Hyde, Kevin. Establishing species boundaries and new taxa among fungi:Recommendations to resolve taxonomic ambiguities[J].Mycosphere,2016, 7:1669-1677.

