水稻转录因子GLK的启动子多态性及基因表达模式分析文
苏麟


摘 要:GLK转录因子隶属于GARP家族,广泛存在于高等植物中,其编码的转录因子能够起到促进叶绿体发育的调控机制,水稻中有一对GLK基因,分别为OsGLK1与OsGLK2。为深入探究该基因的功能,本文克隆了水稻中OsGLK2的启动子序列,并对水稻GLK基因的表达进行分析。在OsGLK2启动子上发现了8个TATA-box,13个CAAT-box,5个G-box位点;不同水稻种质上OsGLK2基因启动子存在很大多态性,OsGLK1及OsGLK2主要在叶子及根中表达,不同种质间的表达差异明显,3个基因型的表达量明显低于及其他样;分析发现CAAT-box是影响OsGLK2表达量的调控位点。
关键词:水稻(Oryza sativa);GLK转录因子;启动子;多态性;表达模式
中图分类号:S511
文献标识码:A
文章编号:1008-0457(2019)05-0001-05 国际DOI编码:10.15958/j.cnki.sdnyswxb.2019.05.001
Genetic polymorphisms of rice transcription factor GLK promoters and the expression patterns of OsGLK gene
WEN Su-lin
(College of Life Sciences,Lanzhou University,Lanzhou ,Gansu 730000,China)
Abstract:GLK transcription factors belong to GARP family,and are widely found in higher plants. The transcription factors encoded by them play a regulatory role in chloroplast development. To date,two members of GLK genes,i.e. OsGLK1 and OsGLK2 have been uncovered in rice so far. To better understand the roles of this GLK transcription factor,the promoter of OsGLK2 was cloned from rice and sequenced,of which 8 TATA-box,13 CAAT-box,and 5 G-box sites were investigated. Diverse mutation sites were obtained from OsGLK2 promoter among the tested genotypes. Generally,OsGLK1and OsGLK2 expressed in leaves and roots. Further,the expression levels diversified among the germplasms,and three genotypes,i.e. L132,L149 and L160 demonstrated the lowest levels. CAAT-box is a regulatory site for OsGLK2 expression.
Key words:Rice (Oryza sativa); tanscription factor GLK; promoter; polymorphism; expression pattern
GLK转录因子屬于GARP家族,普遍存在于高等植物中,能够调控叶绿体的发育[1]。在拟南芥上,双突变体 AtGLK1和 AtGLK2 在所有光合组织中呈淡绿色,呈现减少 Granal 类囊体叶绿体特征[1] ;而过表达 AtGLK1和 AtGLK2 使淡绿色表型更加突出[2]。ZmGLK1 同源到 Golden2 (G2)上,并且玉米 g2 突变体叶片显淡绿色[3]。 从小立宛藓(Physcomitrella patens)中分离 GLK 基因,表明它们规管在叶绿体发育中。因此,GLK 转录因子在植物上具有调节叶绿体发育的功能。
前人研究表明,水稻中有一对GLK基因,分别为OsGLK1与OsGLK2。OsGLK1 能直系同源到玉米 Golden2 - 1 (ZmGLK1) 基因[4]。插入突变体证明OsGLK1 和 OsGLK2 的作用可能类似,反映了一定程度的功能冗余[4]。含 OsGLK2-FOX 序列D 愈伤组织在 N6D 培养基上显示绿色,OsGLK2野生型愈伤组织再生过程中表现出相似的表达模式[5]。本文对OsGLK2的启动子进行克隆和序列分析,同时利用实验室的丰富水稻种质资源,分析该基因在不同种质中的表达模式,旨在为深入认识GLK基因在水稻上的进化模式及在不同种质中的表达特性提供新信息。
1 材料与方法
1.1 植物材料
本实验所用水稻材料来源于华中农业大学作物遗传改良国家重点实验室,包括50份水稻突变体(L124-L173,表1)及对照中花11(ZH11),采集开花后10天的叶、根、花以及成熟种子,液氮保存备用。
1.2 DNA提取
液氮将植物组织组织研磨成细粉,加入65℃预热的2×CTAB抽提液1000μL和β-巯基乙醇4 μL,混匀,65℃温育1.5 h,间断混匀。12000 rpm离心10 min,转移上清,加入等体积酚∶氯仿∶异戊醇(25∶24∶1)(v/v),抽提上清,颠倒混匀7 min,12000 rmp离心10 min。转移上清,再用等体积的氯仿/异戊醇(24:1)(v/v)抽提上清液,12000 rpm离心10 min,转移上清。上清加入等体积的异丙醇,-20℃冰浴1 h。12000 rpm离心10 min,弃上清。75%酒精洗涤2次,用ddH2O溶解DNA。用Thermo 超微量核酸检测仪检测 DNA 浓度与质量。
1.3 RNA提取
根据实验需取拟南芥一定部位材料0.1 g左右,液氮中研磨,加入500 μL RNAiso Plus(Takara)试剂分离RNA,震荡均匀,室温放置10 min。加入200 μL氯仿,震荡,后静置3 min 12000 g,4℃离心15 min。取无色水相层置入新的1.5 mL離心管中,加入与其体积相同的异丙醇,-20℃下静置1 h,然后12000 g、4℃离心10 min。用75%乙醇洗涤两次后晾干,用RNase-free水进行溶解,用Thermo 超微量核酸检测仪检测DNA 浓度与质量。
1.4 RNA反转录获得cDNA
RNA反转录首先用DNAase去除RNA中的杂质DNA,后用Takara公司的5*PrimeScript RT Master Mix进行反转录,体系如下:5*PrimeScript RT Master Mix 2 μL,RNA 500 ng,添加ddH2O至10 μL。然后将混合液放入PCR仪,进行如下条件的反应:37℃ 15 min,85℃ 5 s。反应完成后将反转录得到的cDNA储存在-20℃备用。
1.6 基因表达的qRT-PCR分析
本实验采用实时荧光定量PCR(qRT-PCR)对基因表达量进行检验,仪器型号Bio-RAD CFX96。采用如下体系:cDNA 1 mg/μL,qRT-FP 5 μL,qRT-RP 0.5 μL,TransStart Top Green qRT-PCR SuperMix(全式金公司)7.5 μL,加dd H2O至15 μL。该实验使用引物为GLK2-qRT-F:AGAGCATAGACGCAGCCATC,GLK2-qRT-R:TGCTTGTGCAGCTCAGACAT。qRT-PCR过程为:首先95℃预变性30 s,接着95℃变形30 s,56℃退火10 s,40个循环。实验完成后,得到Ct值,计算相对表达量。
1.7 OsGLK2启动子的克隆
扩增PCR反应体系为50 μL:TaKaRaprimSTAR(2×)25 μL,ddH2O 21 μL,模版 基因组DNA 2 μL,上下游引物(10 μM)各1 μL;扩增程序为98℃变性10 s,55℃退火30 s,72℃延伸2 min 30 s,37个循环。1%琼脂糖凝胶进行电泳检测扩增产物,用 SanPrep 柱式DNA胶回收试剂盒(生工,上海)对获得的特异性扩增片段进行回收。该实验使用引物为GLK2-Promoter-F:AAGCTTGCTCCACGCTTTCCAAGTTCCT,GLK2-Promoter-R:GGATCCCCCAAAATCTCTCCCCTCTACA。
对片段进行回收、克隆,反应体系:在微型离心管中依次加入PCR 产物 0.5~4 μL(根据PCR 产物量可适当增减,最多不超过4 μL),pEASY- T3 Cloning Vector 1 μL轻轻混合,室温 (20 ℃-37 ℃) 反应5 分钟。反应结束后,将离心管置于冰上。
转化过程:加连接产物于50 μL Trans1-T1感受态细胞中(在感受态细胞刚刚解冻时加入连接产物),轻弹混匀,冰浴20~30 min。42℃热激30 s,立即置于冰上2 min。加250 μL平衡至室温的SOC/LB,200转、37℃孵育1 h。 取8 μL 500 mM IPTG,40 μL 20 mg/mL X-gal混合,均匀地涂于准备好的平板(AIX培养基)上,在37℃ 放置30 min。待IPTG,X-gal 被吸收后,取200 μL 菌液铺板,培养过夜。
用SanPrep 柱式质粒 DNA 小量抽提试剂盒(生工公司)提取质粒,酶切鉴定后选取合适的质粒送测序公司测序,测序引物用T7和SP6。
2 结果与分析
2.1 OsGLK2启动子克隆
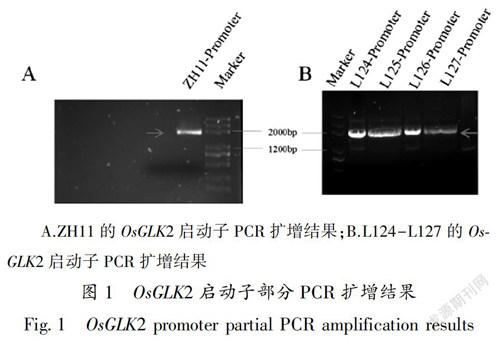
通过合适的PCR体系扩增得到了OsGLK2启动子片段,所扩增片段大小在2000 bp 左右,符合目的片段大小。虽然电泳结果呈现轻微杂带,但是经过对目的片段的切胶回收后,能够保证目的片段的纯度。取得该片段后,用目的片段连接测序载体p-Easy T3,转化大肠杆菌,送到测序公司测序。
A.ZH11的OsGLK2启动子PCR扩增结果;B.L124-L127的OsGLK2启动子PCR扩增结果
图1 OsGLK2启动子部分PCR扩增结果
Fig.1 OsGLK2 promoter partial PCR amplification results
2.2 OsGLK2启动子序列分析
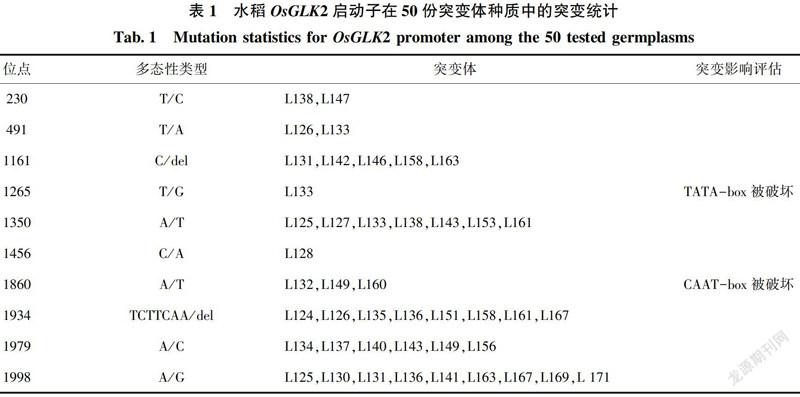
为了探究启动子序列对于OsGLK2基因表达的影响,对中花11(对照)中OsGLK2基因启动子元件进行分析(图1)。结果显示,以主要的启动子元件为例(表1),OsGLK2上具有8个TATA-box,13个CAAT-box,5个G-box。以上调控元件主要功能是:TATA-box,核心启动子;CAAT-box,增强子;G-box,光响应的顺势调控元件。
2.3 OsGLK2启动子在不同种质中的多态性
以ZH11为参照,通过测序后的序列比对发现,50组水稻种质样品均准确地克隆到了目的片段,即OsGLK2的启动子。我们还分析了50份水稻种质资源在OsGLK2启动子区的多态性位点,结果发现(表1),许多种质在该区段部分都出现了碱基的突变,其中L132、L149及L160由于第1860位点的碱基发生突变(A/T),造成了该位置CAAT-box被破坏;另外,L133的1265碱基发生突变(T/G),造成该位置受到破坏。
2.4 OsGLK1及OsGLK2的表达分析
以ZH11为材料,取花、叶片(花后10 d)、根(花后10 d)及成熟种子,分析两个GLK基因的表达模式),结果显示(图2 A),OsGLK1及OsGLK2主要在叶子及根中表达,花中少量表达,成熟种子中极少表达;不同种质间分析表明(图2 B),L132、L149及L160的基因表达量明显低于对照ZH11及其他样品,而其他样品间差异不明显。
3 结论与讨论
GLK2基因在过去被发现具有促进叶绿体发育,抵抗生物胁迫,非生物胁迫以及抵抗植物衰老等功能[6]。考虑到启动子是调控基因表达的关键因素[7],本文克隆了OsGLK2的启动子序列,序列分析发现OsGLK2存在许多调控元件,例如TATA-box、CAAT-box、G-box,它们都是植物中生理调控的重要调控元件,是转录因子重要的结合域[8]。在OsGLK2启动子上,CAAT-box占據了大多数,它是重要的增强子[9],推测它在增强OsGLK2转录方面起到重要作用;另外,TATA-box是重要的转录起始元件,在基因转录中也扮演着重要角色[10],能看到OsGLK2启动子也遍布着TATA-box。G-box主要是响应光信号的调控元件,由于OsGLK2与叶绿体发育相关[11],因此推测G-box可能也在OsGLK2转录过程中扮演着重要角色。
缺失了OsGLK2基因1860位点CAAT-box的样品L132,L149,L160,OsGLK2基因的表达量受到一定影响。考虑到OsGLK2基因主要功能是促进叶绿体发育[5],因此叶绿体发育在这些样品中可能会受到轻微程度的影响;另外,L133样品在1265位点处出现碱基变异导致TATA-box结构被破坏,但是未能明显影响OsGLK2的表达,说明该位点的TATA-box不是对基因表达起核心影响的元件。此外GLK基因普遍能够响应生物胁迫及非生物胁迫[6],且遍布OsGLK2启动子上的G-box元件是一种胁迫应答元件[12],因此G-box是否影响OsGLK2的胁迫应答是一个值得研究的问题。
不同种质OsGLK2基因启动子存在较大的多态性(表1),就其产生的原因,我们推测在这些种质遗传传代过程中,许多外因及内因造成了这些位点的单碱基突变。例如,从物理因素来说,各种射线(包括x射线,γ射线)、激光、紫外线等,温度的剧烈改变会引起了基因突变[13]。这些因素可能干扰DNA的复制,使DNA在复制过程中发生差错而导致基因分子结构中碱基序列的改变;就化学因素来说,各种能够与DNA分子发生作用而改变DNA分子结构和性质的物质,如一些化学致癌物质砷、笨、煤焦油、硫酸二乙酯、秋水仙素等的存在,能够与DNA发生作用,使其在DNA复制过程中发生差错的可能性增加,从而产生突变的位点[13]。生物因素上,某些病毒和细菌能够使DNA产生突变位点[14]。因此,这些因素的综合影响使得水稻材料在生长过程中,出现了或多或少基因层面上的变异,但不一定会影响其性状[15]。推测本文研究中的不同种质资源在长期的自然选择过程中,许多基因的自然变异被保留了下来,因此OsGLK2启动子部分出现了诸多核苷酸多态性位点。
叶绿体是植物进行光合作用的核心部位,其发育直接关系到植物生长[5]。GLK家族基因在水稻叶片中表达水平最高,符合GLK基因主要功能是促进叶绿体发育的报道[5]。由于该基因在水稻根中也有较高的表达量,因此也可能参与根中某些生理过程的调控,对此推测有待进一步研究。
参 考 文 献:
[1] Fitter D W,Martin D J,Copley M J,et al. GLK gene pairs regulate chloroplast development in diverse plant species[J].Plant Journal,2010,31(6): 713-727.
[2] Waters M T,Moylan E C,Langdale J A. GLK transcription factors regulate chloroplast development in a cell-autonomous manner[J].Plant Journal,2010,56(3): 432-444.
[3] Hall L N,Rossini L,Cribb L,et al. GOLDEN 2: a novel transcriptional regulator of cellular differentiation in the maize leaf[J].Plant Cell,1998,10(6): 925-936.
[4] Rossini L,Cribb L,Martin D J,et al. The Maize Golden2 Gene Defines a Novel Class of Transcriptional Regulators in Plants[J].Plant Cell,2001,13(5): 1231-244.
[5] Nakamura H,Muramatsu M,Hakata M,et al. Ectopic Overexpression of The Transcription Factor OsGLK1 Induces Chloroplast Development in Non-Green Rice Cells[J].Plant and Cell Physiology,2009,50(11): 1933-1949.
[6] 刘俊芳,张 佳,李 贺,等.植物GOLDEN2-Like转录因子研究进展[J].分子植物育种,2017,15(10): 3949-3956.
[7] Zarrin A A,Malkin L,Fong I,et al. Comparison of CMV,RSV,SV40 viral and Vlambda1 cellular promoters in B and T lymphoid and non-lymphoid cell lines[J].Biochim Biophys Acta,1999,1446(1-2): 135-139.
[8] 吴 宪. 拟南芥干旱诱导型启动子的克隆及功能分析[D].长春:吉林大学,2013.
[9] Hogekamp C,Arndt D,Pereira P A,et al. Laser microdissection unravels cell-type-specific transcription in arbuscular mycorrhizal roots,including CAAT-box transcription factor gene expression correlating with fungal contact and spread[J].Plant Physiology,2011,157(4): 2023-2043.
[10] Joshi C P. An inspection of the domain between putative TATA box and translation start site in 79 plant genes[J].Nucleic Acids Research,1987,15(16): 6643-6653.
[11] Kiguchi K,Watanabe K,Izumi K,et al. Role of the G-box element in regulation of chlorophyll biosynthesis in Arabidopsis roots[J].Plant Signaling & Behavior,2012,7(8):922-926.
[12] 薛宝平. 辣椒bHLH基因家族的鉴定、表达分析及CabHLH94在应答青枯菌侵染中的作用[D].延安:延安大学,2019.
[13] 岳玉峰. 水稻超高产基因的自然突变[J].北方水稻,2017,47(03): 38-41.
[14] 倪 鑫. PBmice实验小鼠基因诱变项目信息系统优化[D].上海:复旦大学,2013.
[15] 张 林,何祖华. 水稻重要农艺性状自然变异研究进展及其应用策略[J].科学通报,2015,60(12): 1066-1078.

