福建省番鸭小鹅瘟流行毒株病原学研究
林锋强 程晓霞 朱小丽 陈少莺 江丹丹
摘 要:【目的】旨在研究福建省番鸭小鹅瘟病流行毒株及病毒遗传变异状况。【方法】从福建省番鸭主要饲养区收集临床疑似番鸭小鹅瘟病例30份,进行病原学检测、病原分离、病毒感染试验、基因片段序列分析。【结果】显示30份疑似病例中有15份为番鸭源鹅细小病毒(Muscovy duck-origin goose parvovirus,MDGPV)感染,占比50%。分离到的15株MDGPV均能致死番鸭胚,番鸭感染后发病率为60%~100%,死亡率为40%~60%。15株MDGPV分离毒VP1基因核苷酸同源性在99.5%以上,与MDGPV-PT株同源性在96%以上,未发生碱基缺失、插入或基因重组,较为稳定;而与番鸭细小病毒MDPV-P株同源性小于90%。进化树分析显示15株分离毒与MDGPV-PT株属于同一分支,而与MDPV-P株属于不同分支。【结论】福建省2018年流行的MDGPV毒株与1997年分离的MDGPV-PT株致病性和基因序列特性相似,无明显变化,生物学特性和基因组特性比较稳定,遗传变异程度小。
关键词:番鸭小鹅瘟;番鸭源GPV;流行毒株;病原
中图分类号:S 855文献标识码:A文章编号:1008-0384(2019)07-796-06
Abstract:【Objective】Etiology of the epidemic Muscovy duck-origin goose plague (MDGP) and genetic variation of the pathogenic parvovirus (MDGPV) in Fujian were studied. 【Method】 Clinic specimens from 30 suspected MDGP cases at the major duck breeding areas in Fujian were collected for the etiological detection, pathogen isolation, virus infection test, and gene fragment sequence analysis.【Result】On the 30 cases, 15 were confirmed to be MDGPV-positive. All isolated 15 MDGPV could cause death to the Muscovy duck embryos. The morbidity and mortality on the ducks from the viral infection were 60%-100% and 40%-60%, respectively. The nucleotide homology of VP1 gene of the MDGPV isolates was greater than 99.5%. The homology of the isolates with MDGPV-PT was higher than 96% with no deletion and insertion on the nucleobases or gene recombination. On the other hand, its homology with MDPV-P was less than 90%. The phylogenetic tree analysis showed that the 15 isolates belonged to the same branch as MDGPV-PT but differed from MDPV-P. 【Conclusion】The pathogenicity and gene sequence of the MDGPV strain prevalent in 2018 and those of the MDGPV-PT isolated in 1998 were similar with no apparent mutations. The biological and genomic characteristics of the MDGPV isolates seemed stable with little genetic variation throughout the years.
Key words:muscovy duck-origin goose plague; muscovy duck derived goose parvovirus; prevalent strain; pathogen
0 引言
【研究意義】番鸭小鹅瘟病是主要侵染20日龄以内番鸭,临床主要表现为不同程度腹泻、部分病番鸭肠黏膜脱落形成栓塞的番鸭常见病害[1-2]。发病日龄越小,死亡率越高,发病率50%~70%,病死率40%~65%。其病原为番鸭源鹅细小病毒(Muscovy Duck-origin Goose parvovirus, MDGPV)[3]。临床上使用抗菌素和番鸭细小病毒病疫苗、鹅细小病毒病疫苗均不能控制病情,给养鸭业造成巨大的经济损失[4]。通过对临床疑似番鸭小鹅瘟样品检测、病原分离和鉴定,分析番鸭小鹅瘟病流行毒株的生物学特性及病毒遗传变异状况,对临床番鸭小鹅瘟病的防控具有指导意义。
【前人研究进展】目前对MDGPV的研究主要集中在病毒检测方法的建立、应用以及病毒的分离,如2007年在四川德阳某番鸭场分离得到的MDGPV-DY 株[5-7]。而基因研究方面,在Genbank登录的番鸭源鹅细小病毒全基因序列只有MDGPV-PT 株(登录号JF926695)和DY株(登录号EF515837)[8]。1997年,番鸭小鹅瘟病在福建省莆田、福清等番鸭饲养区出现,随后在我国广东、浙江、江西、江苏、四川等省份相继发生,荷兰、德国、俄罗斯、匈牙利、法国等国家也有该病的报道,分布极其广泛,使其成为严重危害番鸭养殖业的重要疫病[3-4,9-13]。发病日龄5~25日龄,日龄越大,易感性越低。本病无明显季节性,但以冬季和早春多发。对其流行病学研究,仅见在鹅以及樱桃谷鸭中有对某个地区GPV流行的报道[14],对番鸭小鹅瘟的流行情况调查未见报道。
【本研究切入点】福建省作为主要番鸭饲养区,番鸭小鹅瘟病的危害尤其严重[4]。自1997年发现以来,经过多年的传播与发展,福建省区域内番鸭小鹅瘟病毒株是否发生了变异目前未有报道。
【拟解决的关键问题】为了对番鸭小鹅瘟的流行病学进行调查,于2018年在福建省莆田、漳州、三明将乐、南平建瓯等地的番鸭饲养场收集临床疑似样品进行病毒检测,对流行毒株进行分离鉴定,分析评价流行病株的生物学和分子生物学特性,并与2007年分离的MDGPV-PT株进行致病性和基因片段序列分析比较,评价2018年番鸭小鹅瘟病毒流行毒株与1997年分离毒株的差异,为其防治措施的提升和相应疫苗的更新提供参考。
1 材料和方法
1.1 试验动物及试剂
85羽1日龄雏番鸭购自莆田广东温氏家禽有限公司;抗MDGPV单克隆抗体致敏乳胶、抗番鸭细小病毒(muscovy duck parvovirus, MDPV)、MDGPV单克隆抗体由本实验研制;反转录试剂盒RNA RevertAid First Strand cDNA Systhesis Kit(Thermo Scientific公司)、样品基因组提取试剂盒EasyPure Viral DNA/RNA Kit(北京全式金生物技术有限公司)、PCR试剂Dream Taq Green PCR Master Mix(2×)购自Thermo Scientific公司。MDGPV-PT由本实验室保存[4]。
1.2 样品来源 2018年1~12月从福建省主要番鸭饲养区收集临床疑似番鸭小鹅瘟病例,其中莆田6份、漳州8份、三明将乐12份、南平建瓯4份,共计30份。临床病料取肝脏、脾脏、胰腺组织,4℃保存,利用免疫荧光试验进行检测MDPV和MDGPV。
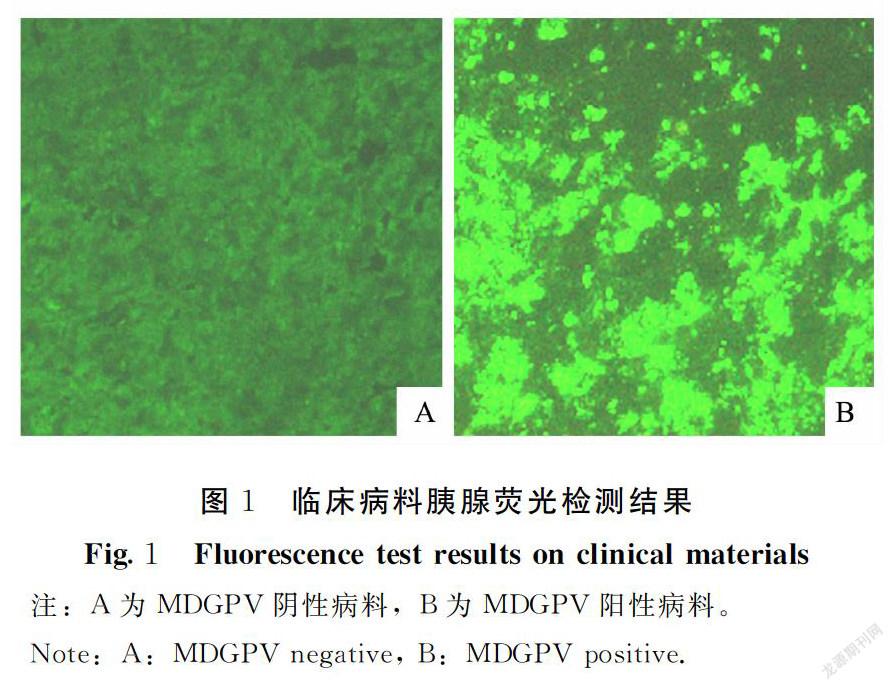
1.3 免疫荧光试验(IFA)检测取收集的胰腺组织制作冰冻切片,丙酮固定后,分别加适当稀释的抗MDGPV或MDPV单抗,37℃湿盒30 min,生理盐水洗涤3次,加工作浓度的羊抗鼠IgG-FITC,37℃湿盒30 min,生理盐水洗涤3次后以50%PBS-甘油封片,荧光显微镜下观察,出现亮绿色荧光判定为阳性。
1.4 MDRV、NDRV、DHV病原检测引物
按照番鸭呼肠孤病毒(muscovy duck reovirus, MDRV) MW9710株S4基因(KY580159)设计引物,上游引物MDRV P1:CTA CCT CAA ATG GTC GCA ATG GAG;下游引物MDRV P2:GAT CGT GTT GCC AAG TTA GAA CGA G(扩增长度500 bp,退火温度56℃)。按照鸭病毒性肝炎(duck hepatitis virus, DHV)GD株(KM017068)基因设计引物,上游引物DHV P1:CCC TTC ATT AGC AAG TGC TGT ACT;下游引物DHV P2:ACG CTG GTT AGC AAC ACC(扩增长度700 bp,退火温度52.5℃)。按照新型鸭呼肠孤病毒(New-type duck reovirus, NDRV)NP03株S3基因(GQ888710)设计引物,上游引物NDRV P1:ACC TCA GGA TAT CGC TGA AAC T;下游引物NDRV P2:CTC CAT CCC TGC AGC ACA TGT AAA G(扩增长度586 bp,退火温度55℃)。
1.5 MDRV、NDRV、DHV病原RT-PCR检测将临床样品按照1∶5比例磨成匀浆,取200 μL按照EasyPure Viral DNA/RNA Kit说明书提取病毒RNA。将所得的RNA按照RevertAid First Strand cDNA Systhesis Kit说明书进行反转录,反转录结束后利用Dream Taq Green PCR Master Mix(2×)试剂进行PCR。将所得到的产物在1%琼脂糖凝胶,120 V电泳20 min,在凝胶成像系统上观察结果。
1.6 病原分离和毒价测定取15份MDGPV阳性病料接种12日龄番鸭胚,每份接3枚,0.2 mL·枚-1,每天观察胚死亡情况,将48~96 h死亡胚收集尿囊液;未死亡胚的继续传2代,收集尿囊液,-20℃保存。死亡胚心制作冷凍切片,用免疫荧光检测MDGPV和MDPV;尿囊液提取RNA进行MDRV、NDRV、DHV病原RT-PCR检测。将15份均能致死番鸭胚的尿囊液用LPA方法进行毒价测定。方法如下:生理盐水将待检样品作连续2倍倍比稀释后,各取10 μL不同稀释度的待检样品与等量致敏乳胶在洁净的玻片或96孔细胞培养板板盖上混匀,37℃水浴温箱中静置5~15 min,观察凝集反应。试验设致敏乳胶对照、抗原对照和抗原加稀释液对照。以能出现“+”凝集的抗原最高稀释度的倒数为该抗原的凝集价。
1.7 攻毒试验 85羽7日龄雏番鸭随机分成17组,每组5羽。分成15株MDGPV分离株组、MDGPV-PT株组和空白对照组。MDGPV攻毒剂量为LPA效价24,0.3 mL·羽-1,空白对照组注射Hanks液0.3 mL。攻毒后每日观察和记录番鸭发病和死亡情况。
1.8 MDGPV分子流行病学分析
为了测定15株MDGPV分离毒3 321~4 195位核苷酸序列,按照MDGPV PT株(KY511293)设计引物,上游引物MDGPV P1:GAA TCA GAC CCA AGT CTC TT;下游引物MDGPV P2:CAA GAT CTG AAC TCG TAG GAG(扩增长度875 bp,退火温度55.9℃)。将15株MDGPV分离毒200 μL按照EasyPure Viral DNA/RNA Kit说明书提取病毒DNA。将所得的DNA利用Dream Taq Green PCR Master Mix(2×)试剂进行PCR。将所得到的产物在1%琼脂糖凝胶,120 V电泳20 min,在凝胶成像系统上观察结果,并送大连宝生物工程有限公司进行序列测定及进化树分析。
2 结果与分析
2.1 番鸭小鹅瘟病临床检测情况
番鸭小鹅瘟病一年四季均可发生,临床共计收集疑似番鸭小鹅瘟病病料30份,经过荧光和PCR检测,其中15份为MDGPV感染,占比为50%;3份为MDPV感染,占比为10%,其余12份均为多种病原混合感染,占比40%,其中主要为番鸭细小病毒病、番鸭呼肠孤病毒病,MDGPV和MDPV混合感染病例7例,MDGPV和MDRV混合感染病例5例。临床病料胰腺荧光检测结果图1。
2.2 番鸭MDGPV病毒分离及检测
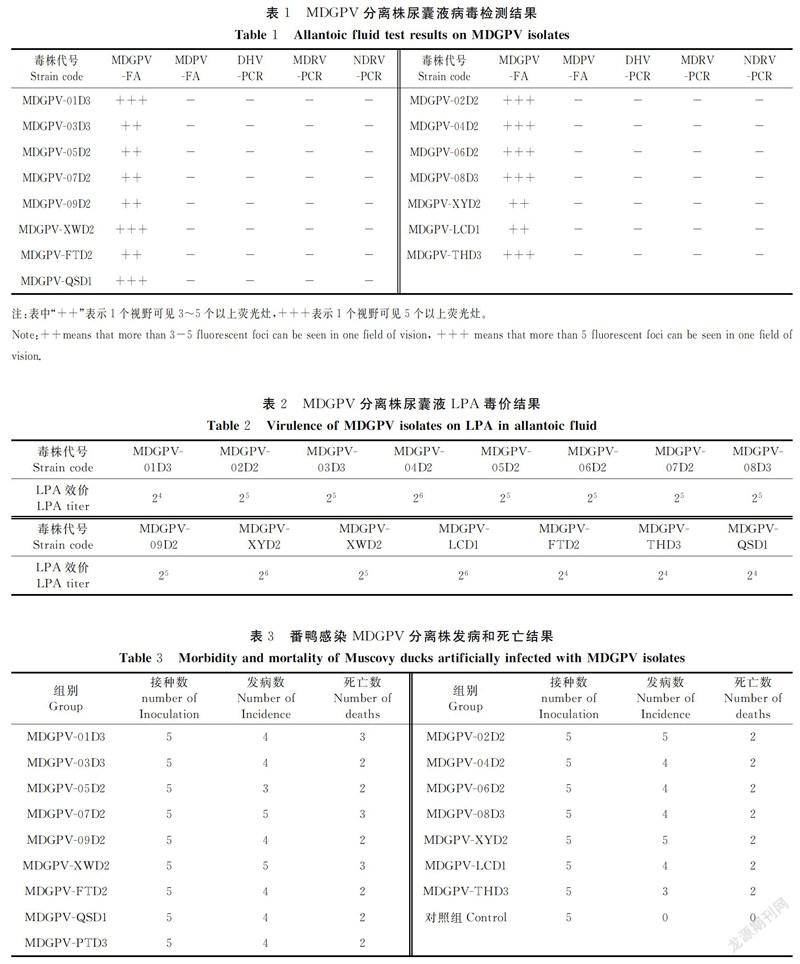
15份MDGPV病料在番鸭胚上盲传3代,结果显示15份病料接种番鸭胚后均100%死亡。对所收集胚体进行荧光检测,尿囊液进行PCR检测,发现仅能检测到MDGPV,其他病毒如MDPV、DHV、MDRV、NDRV均未检测到(表1)。
2.3 番鸭MDGPV LPA效价测定
利用MDGPV-LPA方法检测15份尿囊液毒价,LPA效价范围在24~26(表2)。
2.4 番鸭MDGPV攻毒试验15株MDGPV感染番鸭后,发病日龄在4~5 d,其中7~14日龄为多发日龄。主要表现为拉稀、不爱站立、少食。发病率为60%~100%;番鸭死亡日龄为感染7~14 d,死亡率为40%~66.7%(表4)。死亡番鸭解剖胰腺有灰白色坏死点,个别肠道出现栓塞,其余器官无明显变化。20日龄后番鸭逐渐恢复,但生长缓慢,变成僵鸭。MDGPV-PT株感染番鸭后发病率80%,死亡率40%,临床症状和剖检病变与流行毒株感染后情况一致。结果显示15株分离毒的与MDGPV-PT株发病率、死亡率和临床症状相似。
2.5 番鸭MDGPV分子流行病学分析
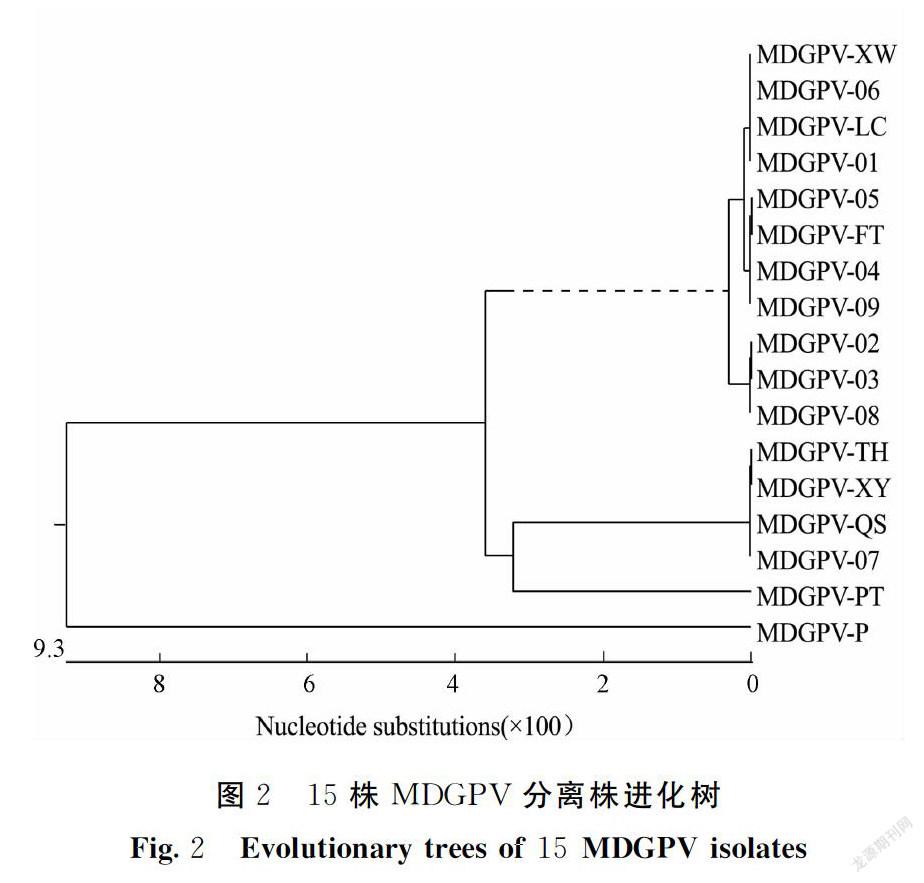
15株MDGPV分离毒碱基序列特征与MDGPV-PT株保持一致,同源性在96%以上,未发生碱基缺失、插入或基因重组,较为稳定。其中MDGPV-TH、XY、QS、07株同源性在99.8%以上,与PT株同源性在96.8%-97.2%;其余11株同源性在99.5%以上,与PT株同源性在96.2%~96.5%。所有分离株与番鸭细小病毒MDPV-P株同源性小于90%。进化树分析显示15株分离毒与MDGPV-PT株属于同一分支,而与番鸭细小病毒MDPV-P株属于不同分支(图2)。
3 讨 论
目前福建省番鸭饲养地区主要集中在莆田、漳州、建瓯、将乐,饲养量占到全省的80%左右。对4个地区2018年收集的30份病料分析来看,MDGPV发生率为50%。从发生季节来看,冬季(12月至翌年2月)收集7份,占比46.7%;春季(3~5月)收集5份,占比33.3%;夏秋两季仅收集到3份,表明番鸭细小病毒病一年四季均能发生,但主要以冬春季节多发。
番鸭小鹅瘟1997年最早在福建莆田、福清等番鸭饲养区出现,1998年在莆田发病鸭群中分离鉴定了MDGPV-PT株,是由GPV和MDPV流行株之间发生基因重组后形成的新基因型强毒株。基因组由两个开放阅读框组成,其中右侧阅读框相互重叠,编码衣壳蛋白VP。其中VP1基因编码的VP1蛋白,位于病毒粒子外壳,可能与病毒的毒力及致病性有关[15]。同源性分析显示:(1)MDGPV和MDPV同源性为79.7%~89.4%。季芳等研究认为MDGPV和MDPV的VP1基因同源性为87.2%[16]。张云等[17]研究认为MDGPV和MDPV的VP1基因同源性79.7%~88.7%。Poonia等[18]研究认为美国新型MDPV与MDGPV-PT株同源性83.5%。本研究分离到15株MDGPV分离毒与MDPV同源性均也小于90%。(2)MDGPV和GPV同源性为88.1%~91.2%。其中GPV-B株、YG株、VG32/1株与MDGPV-PT株同源性为分别为89.0%、88.2%和88.8%[4,13]。(3)不同MDGPV分离毒之间同源性在95.2%~99.6%[16]。MDGPV-PT株与DY株同源性为98.8%[4,13],与本研究分离到的15株MDGPV VP1基因同源性大于96%相一致。进化树分析显示15株分離毒与MDGPV-PT株属于同一分支,而与番鸭细小病毒MDPV-P株和鹅源GPV属于不同分支。因此番鸭源GPV具有不同于鹅源GPV与MDPV的遗传进化方向。
从分离的流行毒株特性来看,与1997年分离的PT株特性相似,基因进化树显示15株分离毒与PT株属于同一分支。综上所述,虽然MDGPV在我国流行了20多年,但是病毒生物学特性和基因组特性比较稳定,变异程度小。
参考文献:
[1]ZHANG J,LIU P,WU Y,et al.Growth characteristics of the novel goose parvovirus SD15 strain in vitro[J]. BMC Vet Res,2019,15(1):63-67.
[2]程由铨,胡奇林,陈少莺,等. 番鸭细小病毒和鹅细小病毒生化及基因组特性的比较[J]. 中国兽医学报,2001,21(5):129-132.
CHENG Y Q,HU Q L,CHEN S Y,et al. Comparison of Biochemical and Genomic Characteristics of Muscovy Duck Parvovirus and Goose Parvovirus[J]. Chinese Journal of Veterinary Science,2001,21(5):129-132.(in Chinese)
[3]张伟,季艳菊,陈芳艳,等. 华南地区小鹅瘟和番鸭“三周病”分离野毒株部分VP基因序列的差异分析[J]. 黑龙江畜牧兽医,2009(10):64-67.
ZHANG W, JI Y J, CHEN F Y, et al. Differential analysis of partial VP gene sequences of wild virus strains isolated from goose plague and muscovy duck "three weeks disease" in south China[J].Heilongjiang Animal Husbandry and Veterinary Medicine, 2009 (10):64-67.(in Chinese)
[4]程晓霞,陈少莺,朱小丽,等. 番鸭小鹅瘟病毒的分离与鉴定[J]. 福建农业学报,2008,23(4):355-358.
CHENG X X,CHEN S Y,ZHU X L,et al. Isolation and Identification of Muscovy Duck Goose Plague Virus[J]. Fujian Journal of Agricultural Sciences,2008,23(4):355-358.(in Chinese)
[5]LI P, ZHANG R, CHEN J, et al. Development of a duplex semi-nested PCR assay for detection of classical goose parvovirus and novel goose parvovirus-related virus in sick or dead ducks with short beak and dwarfism syndrome[J].J Virol Methods, 2017,249:165-169.
[6]BIAN G,MA H,LUO M,et al.Identification and genomic analysis of two novel duck-origin GPV-related parvovirus in China[J]. BMC Vet Res,2019,15(1):88-92.
[7]ZADORI Z,ERDEI J,NAGY J. Characteristics of the genome of goose parvovirus[J]. Avian Pathology, 1994,23:359-364.
[8]王劭,朱小丽,林锋强,等. 番鸭源小鹅瘟病毒PT株VP基因的克隆与序列分析[J].农业生物技术学报,2012,20(1):79-84.
WANG S,ZHU X L,LIN F Q,et al. Cloning and Sequence Analysis of VP Gene of Goose Parvovirus PT Strain Isolated from Muscovy Duck Origin[J]. Journal of Agricultural Biotechnology,2008,20(1):79-84.(in Chinese)
[9]NING K, WANG M, QU S, et al. Pathogenicity of Pekin duck-and goose-origin parvoviruses in Pekin ducklings[J].Vet Microbiol,2017,210(8):17-23.
[10]GOUGH T D,CECRAZ V,COX B,et al. Isolation and identification of goose parvovirus in the UK[J]. Vet Rec,2005,156(13):424.
[11]JANSSEN D S,FEINSTEIN R,KARDI V,et al. Epidemiologic investigation of an outbreak of goose parvovirus infection in Sweden[J]. Avian Dis,2007,51(2):609-613.
[12]RICHARD IRVINE,PAUL HOLMES. Diagnosis and control of goose parvovirus[J]. Clinical practice, 2010,32:382-386.
[13]YANG J, CHEN H, WANG Z,et al. Development of a Quantitative Loop-Mediated Isothermal Amplification Assay for the Rapid Detection of Novel Goose Parvovirus[J]. Front Microbiol,2017,12(8):2472-2479.
[14] 肖世峰,程曉霞,陈仕龙,等. 短喙与矮小综合征鹅细小病毒对樱桃谷鸭的致病性研究[J]. 中国预防兽医学报,2016,38(9):690-694.
XIAO S F,CHENG X X,CHEN S L,et al. Pathogenicity of Short beak goose parvovirus in Cherry Valley ducks[J].Chinese Journal of preventive veterinary medicine,2016,38(9):690-694.
[15]LI P, LIN S, ZHANG R, et al.Isolation and characterization of novel goose parvovirus-related virus reveal the evolution of waterfowl parvovirus[J]. Transbound Emerg Dis,2018,65(2):284-295.
[16]季芳,张毓金,杨增岐,等. 番鸭细小病毒和鹅细小病毒广东株VP1基因的克隆及序列分析[J]. 中国预防兽医学报,2004,26(4):245-251.JI F,ZHANG Y J,YANG Z Q,et al. Cloning and Sequence Analysis of VP1 Gene of Muscovy Duck Parvovirus and Goose Parvovirus Guangdong Strain[J]. Chinese Journal of Preventive Veterinary Medicine,2004,26(4):245-251.(in Chinese)
[17]张云,耿宏伟,郭东春,等. 鹅和番鸭细小病毒全基因克隆和序列分析[J].中国预防兽医学报,2008,30(6):415-419.
ZHANG Y,GENG H W,GUO D C,et al. Cloning and Sequence Analysis of Full Gene of Goose and Muscovy Duck Parvovirus[J]. Chinese Journal of Preventive Veterinary Medicine,2008,30(6):415-419.(in Chinese)
[18]POONIA B,DUNN P A,LU H G,et al. Isolation and molecular characterization of a new muscovy duck parvovirus from muscovy duckin USA[J]. Avian Pathology,2006,35(6):435-441.
(责任编辑:张 梅)

