广西崇左市甘蔗梢腐病病原菌的分离鉴定及生物学特性测定
郭强 马文清 陈海生 闭德金 施泽升 彭崇 秦昌鲜 何洪良 唐利球




摘要:【目的】明確广西崇左市甘蔗梢腐病病原菌种类及其生物学特性,为甘蔗梢腐病的综合防治提供理论依据。【方法】以采集自广西崇左市甘蔗种植区的甘蔗梢腐病病叶为材料,采用组织分离法进行病原菌单孢分离,结合科赫法则进行致病性测定,通过形态学特征观察及rDNA-ITS序列分析对病原菌进行种类鉴定;应用十字交叉法进行病原菌的生物学特性测定。【结果】分离获得的病原菌rDNA-ITS序列长度为496 bp,与轮枝镰刀菌(Fusarium verticillioides)的同源性达99%,与轮枝镰刀菌(登录号EU047)的遗传关系最近。病原菌的生物学特性测定结果表明,该菌菌丝最适生长温度为28 ℃,致死温度为70 ℃;菌丝生长最适pH为8,光暗交替条件下生长较快;菌丝生长最适氮源为胰蛋白胨,最适碳源为甘露醇。【结论】引起广西崇左市甘蔗梢腐病的病原菌是轮枝镰刀菌,该菌适宜在高温高湿、弱碱性、光暗交替及富含有机营养的环境条件下生长。
关键词: 甘蔗梢腐病;轮枝镰刀菌;生物学特性;广西崇左市
中图分类号: S432.44 文献标志码: A 文章编号:2095-1191(2019)08-1728-07
Isolation identification and biological characteristics of the pathogen causing sugarcane pokkah boeng
in Chongzuo, Guangxi
GUO Qiang, MA Wen-qing, CHEN Hai-sheng, BI De-jin,SHI Ze-sheng,PENG Chong,
QIN Chang-xian, HE Hong-liang, TANG Li-qiu*
(Guangxi South Subtropical Agricultural Science Research Institute, Guangxi Academy of Agricultural Sciences, Longzhou, Guangxi 532415, China)
Abstract:【Objective】The present experiment was conducted to investigate species and biological characteristics of the pathogen causing sugarcane pokkah boeng in Chongzuo,Guangxi in order to provide scientific basis for controlling sugarcane pokkah boeng. 【Method】Sugarcane leaves with sugarcane pokkah boeng in Chongzuo sugarcane planting areas were collected. Conventional tissue separation was applied to isolate monospore from the pathogen,and the pathogenicity of the pathogen were investigated. Based on morphological characteristics observation and analysis of rDNA-ITS sequence,the pathogen of sugarcane pokkah boeng was identified. Biological characteristics of the pathogen were determined with crossing methods. 【Result】The rDNA-ITS sequence of tested strains was 496 bp in length,which showed 99% homology with Fusarium verticillioides. It had the closest genetic relationship with Fusarium verticillioides(accession number EU047). According to the biological characteristics test, the pathogen could grow with an optimal condition at 28 ℃,and the lethal temperature was 70 ℃. The best cultural condition for mycelial growth was pH 8,12 h dark+12 h light. The best nitrogen sources for the pathogen growth was tryptone,and the best carbon sources was mannito. 【Conclusion】The pathogen causing sugarcane pokkah boeng in Chongzuo is identified as F. verticillioides. The optimal growth conditions for F. verticillioides is high temperature, high humidity, weak alkaline, alternating light and dark and full of organic nutrition.
Key words: sugarcane pokkah boeng; Fusarium verticillioides; biological characteristics; Chongzuo, Guangxi
0 引言
【研究意义】甘蔗(Saccharum officinarum L.)为禾本科单子叶植物,是最主要的糖料作物之一。我国作为世界第三大蔗糖生产国,蔗糖总产量达1367.9万t/年,占全国食糖总产量的92.2%以上(李杨瑞和杨丽涛,2009)。可见,甘蔗生产对国民经济的可持续发展具有重要意义。然而,甘蔗生产长期受到病害的威胁,严重影响甘蔗蔗茎产量及蔗糖分,对蔗糖产业造成巨大损失,严重阻碍了蔗糖产业的可持续发展。甘蔗梢腐病是甘蔗伸长期最主要的一种真菌性病害,该病主要发生在高温高湿的7—9月,易感病品种发病率高达70%~90%,抗病品种发病率也有5%~30%(张玉娟,2009);受梢腐病危害的蔗田,其产量损失率为30.2%~48.5%,甘蔗糖分下降2.63%~5.21%(单红丽等,2018)。梢腐病主要危害甘蔗梢部心叶,发病较轻时植株可恢复生长,发病严重时致使生长点组织软化坏死,造成顶腐,最终导致植株整株死亡(卢文浩,2007)。近年来,我国蔗区频繁暴发大面积甘蔗梢腐病危害,尤其是被誉为“中国糖都”的广西崇左市甘蔗种植区,梢腐病已成为制约甘蔗生产的主要因素。因此,明确崇左蔗区甘蔗梢腐病病原菌种类,并初步研究其生物学特性,对甘蔗梢腐病防治具有重要意义。【前人研究进展】甘蔗梢腐病最早发现于爪哇地区,并确定是由镰刀菌(Fusarium)引起的一种真菌性病害,目前该病已传遍世界所有甘蔗种植国家和地区(Siti,2007)。张玉娟(2009)采用ITS-PCR、ATP-PCR和Effd-PCR 3种方法对甘蔗梢腐病菌进行分子鉴定,结果表明,菌株ATP片段与尖孢镰刀菌(F. oxysporum)相比仅有79%的同源性,菌株Effd片段与藤仓镰孢菌(F. fujikuroi)的同源性为92%,菌株ITS序列与串珠赤霉菌(Gibberella moniliformis)具有100%的同源性;Lin等(2014)分离获得101株甘蔗梢腐病病原菌株,经rDNA-ITS序列分析,结果表明,90%的菌株为轮枝镰刀菌(F. verticillioides),7%为层生镰刀菌(F. proliferatum);何姗珊等(2016)采用ITS特异性扩增和序列分析,确定甘蔗梢腐病病原菌属于镰刀菌属;Bao等(2016)在广西百色市调查甘蔗病害时发现梢腐病危害,采集病葉进行病原菌分离鉴定,结果表明,分离获得的病原菌株为尖孢镰刀菌。这是我国首次发现尖孢镰刀菌引起甘蔗梢腐病,与轮枝镰刀菌和层生镰刀菌相比,尖孢镰刀菌能在较短时间内引起顶腐,最终造成整株死亡。【本研究切入点】目前,关于广西崇左蔗区甘蔗梢腐病病原的研究尚无文献报道,病原菌生物学特性尚缺乏相关信息。【拟解决的关键问题】对采集自广西崇左市甘蔗种植区甘蔗梢腐病病叶进行单孢分离、致病性测定、形态学特征观察及rDNA-ITS序列分析,并在此基础上研究不同温度、pH、碳源、氮源和光照条件下病原菌的生物学特性,明确崇左蔗区甘蔗梢腐病病原及其生物学特性,为崇左蔗区甘蔗梢腐病的综合防治和深入研究提供理论依据。
1 材料与方法
1. 1 试验材料
1. 1. 1 病样 于2018年6月从广西崇左市甘蔗种植区采集典型的甘蔗梢腐病病叶样品,带回实验室,进行拍照,备用。
1. 1. 2 培养基 PDA培养基:马铃薯(去皮)200.00 g、葡萄糖20.00 g、琼脂20.00 g、蒸馏水1000 mL;马铃薯葡萄糖水(PDW)培养基:马铃薯(去皮) 200.00 g、葡萄糖20.00 g、蒸馏水1000 mL;查氏培养基:蔗糖30.00 g、NaNO3 2.00 g、K2HPO4 1.00 g、MgSO4·7H2O 0.50 g、KCl 0.50 g、FeSO4·7H2O 0.01 g、琼脂20.00 g、蒸馏水1000 mL。
1. 1. 3 接种材料 生长至3~4片叶的健康ROC22种苗。
1. 2 病原菌分离
从广西崇左市甘蔗种植区采集发病的甘蔗梢腐病病叶,按组织分离法进行病原菌分离(Lin et al.,2014)。取病健交界处叶片,剪切成大小约0.5 cm×0.5 cm的方块,经70%酒精消毒10 s,然后转移至0.1%升汞中灭菌40 s,以无菌水冲洗3遍后转移至灭菌的滤纸上自然晾干,最后转移至PDA培养基(含100 μg/mL氨苄青霉素)中,28 ℃恒温培养箱倒置培养2~3 d。待菌丝长出后,用移液枪挑取菌落边缘菌丝划线纯化培养,纯化3代。将分离获得的病原菌菌株用50%甘油保存于-80 ℃超低温冰箱中。
1. 3 病原菌致病性测定
根据科赫法则鉴定病原菌的致病性。将保存于-80 ℃超低温冰箱中的病原菌菌株进行活化,挑取菌落边缘的菌丝接种至PDW培养基中,于28 ℃、220 r/min恒温摇床中振荡培养3~4 d,用离心法收集孢子并去除培养基,用无菌水配制成1×107个/mL的孢子悬液;用注射器吸取200 μL孢子悬液注射接种到ROC22幼苗的心叶处,每处理5个重复,以无菌水为对照;将接种后的甘蔗幼苗置于28 ℃、湿度在85%以上的条件下培养,观察发病情况。将发病叶片再进行分离、纯化,对比获得的病原菌与原病原菌菌落形态、菌丝颜色、分生孢子形态等是否一致。
1. 4 病原菌鉴定
1. 4. 1 形态学鉴定 挑取纯化好的菌落边缘菌丝转接至PDA培养基中央,于28 ℃恒温培养箱中培养3~4 d,待菌落几乎长满整个培养皿后,观察菌落形态、颜色、菌丝疏密程度等形态特征,并挑取菌丝制成玻片,置于光学显微镜下观察菌丝和分生孢子形态。
1. 4. 2 分子生物学鉴定 挑取菌落边缘菌丝接种至PDW培养基中,于28 ℃、220 r/min恒温摇床中振荡培养3~4 d,利用离心法收集菌体,采用SDS法提取病原菌基因组DNA(Lin et al.,2014)。采用真菌rDNA-ITS通用引物(上游引物ITS1:5′-TCCGT AGGTGAACCTGCGG-3′,下游引物ITS4:5′-TCC TCCGCTTATTGATATGC-3′)对病原菌rDNA-ITS区进行PCR扩增。PCR反应体系25.0 μL:Premix Taq(TaKaRa)12.5 μL,上、下游引物各1.0 μL,DNA模板1.0 μL,ddH2O 9.5 μL。扩增程序:94 ℃预变性3 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 40 s,进行35个循环;72 ℃延伸10 min。PCR结束后,用1.0%琼脂糖凝胶电泳对PCR扩增产物进行检测,检测合格后进行测序,将测序所得的序列提交至NCBI数据库中进行BLAST比对分析。选取镰刀菌属不同种病原菌的rDNA-ITS序列,通过MEGA 7.0中的邻接法(Neighbor-joining)构建系统发育进化树。
1. 5 病原菌生物学特性测定
1. 5. 1 温度对病原菌菌丝生长的影响 将保存于 -80 ℃超低温冰箱的病原菌菌株接种于PDA培养基中进行活化,用直径7 mm的打孔器取活化病原菌菌丝块接种至PDA培养基中央,分别置于10、15、20、25、28、30、35和40 ℃共8个温度梯度下培养,每温度处理设5个重复。5 d后采用十字交叉法测量菌落直径,所得结果减去菌饼直径7 mm(朱迎迎等,2016)。
1. 5. 2 pH对病原菌菌丝生长的影响 用1.0 mol/L HCl和1.0 mol/L NaOH调节灭菌后的PDA培养基,配制成pH分别为5、6、7、8和9的PDA培养基(番华彩等,2018)。将保存于-80 ℃超低温冰箱中的病原菌菌株接种于PDA培养基中进行活化,用直径7 mm的打孔器取活化病原菌菌丝块接种至不同pH的PDA培养基中央,每处理5个重复,28 ℃培养。菌落直径测量方法与1.5.1相同。
1. 5. 3 光照对病原菌菌丝生长的影响 将保存于 -80 ℃超低温冰箱中的病原菌菌株接种于PDA培养基中进行活化,用直径7 mm的打孔器取活化病原菌菌丝块接种至PDA培养基中央,分别置于连续光照、连续黑暗、12 h光暗交替处理3个条件下,于28 ℃恒温培养箱中培养,每处理5个重复。菌落直径测量方法与1.5.1相同。
1. 5. 4 氮源對病原菌菌丝生长的影响 参考胡美姣等(2013)的方法并略加修改。以Czapek培养基为基础培养基,分别配制以酵母粉、蛋白胨、NaNO3、硫酸铵和甘氨酸为氮源的培养基,以不加氮源的培养基为对照。将保存于-80 ℃超低温冰箱中的病原菌菌株接种于PDA培养基中进行活化,用直径7 mm的打孔器取活化病原菌菌丝块接种至不同氮源培养基中央,每处理5个重复,28 ℃培养。菌落直径测量方法与1.5.1相同。
1. 5. 5 碳源对病原菌菌丝生长的影响 参考胡美姣等(2013)的方法并略加修改。以Czapek培养基为基础培养基,分别配制以D-果糖、葡萄糖、蔗糖、可溶性淀粉和甘露醇为碳源的培养基,以不加碳源的培养基为对照。将保存于-80 ℃超低温冰箱中的病源菌菌株接种于PDA培养基中进行活化,用直径7 mm的打孔器取活化病原菌菌丝块接种至不同碳源培养基中央,每处理5个重复,28 ℃培养。菌落直径测量方法与1.5.1相同。
1. 5. 6 病原菌致死温度 参照孙嘉曼等(2016)的方法并略有改动。将保存于-80 ℃超低温冰箱中的菌株接种于PDA培养基中进行活化,用直径7 mm的打孔器取活化病原菌菌丝块置于含10 mL无菌水的离心管中,然后分别置于45、50、55、60、65、70和75 ℃水浴中加热10 min,取出菌丝块转接至PDA培养基中,28 ℃倒置培养5 d,每处理5个重复,观察菌丝有无生长。确定致死温度范围后,再按1 ℃梯度进行试验,最终确定致死温度。
1. 6 统计分析
试验数据采用Excel 2007进行统计分析,运用SPSS 13.0进行方差分析。
2 结果与分析
2. 1 病原菌分离及其致病性测定结果
将分离、纯化后获得的菌株配制成1×107个/mL的孢子悬液,根据科赫法则将菌株孢子悬液回接至健康的ROC22幼苗心叶处,接种5 d后,心叶开始变黄,出现红褐色病斑,病斑不断扩散,导致心叶腐烂坏死(图1-A);对照处理不发病。接种分离菌株后的发病症状与大田自然发病症状相似(图1-B)。采集接种后发病叶片再次进行分离培养,获得的分离株与原接种菌株的菌落形态、分生孢子形态完全一致,证明分离获得的菌株是甘蔗梢腐病的致病菌。
2. 2 病原菌形态学观察结果
在PDA培养基上,菌落正面气生菌丝发达,菌丝稠密,呈白色(图1-C);菌落背面初期为白色,2~3 d后呈黄色(图1-D)。分生孢子可分为大型分生孢子和小型分生孢子,分生孢子梗顶端分离产生小型分生孢子,小型分生孢子呈卵形,无隔膜,小型分生孢子逐渐长大形成大型分生孢子,大型分生孢子有隔膜,呈镰刀状(图1-E);菌丝分枝不规则,有分隔(图1-F)。
2. 3 病原菌分子序列分析结果
利用ITS通用引物扩增病原菌的rDNA-ITS序列,获得长度为496 bp的片段。将病原菌菌株的rDNA-ITS序列提交至NCBI数据库中进行BLAST比对分析,结果显示病原菌菌株(LZ11-2)的rDNA-ITS序列与轮枝镰刀菌(Fusarium verticillioides)的同源性为99%。构建的系统发育进化树(图2)显示,病原菌菌株与F. verticillioides(登录号EU047)的遗传关系最近。综合病原菌的形态特征及分子鉴定结果,确定引起广西崇左市甘蔗梢腐病的病原菌为轮枝镰刀菌。
2. 4 病原菌生物学特性测定结果
2. 4. 1 温度对病原菌菌丝生长的影响 试验结果(图3)表明,病原菌菌株在10~35 ℃内均可生长,在25~30 ℃内生长较好,最适温度为28 ℃(平均菌落直径为79.60 mm);不同温度条件对病原菌菌丝的生长影响较大,在28和30 ℃下病原菌菌落直径与其他温度处理差异显著(P<0.05,下同),但二者间菌落直径差异不显著(P>0.05,下同);10 ℃下,病原菌菌株第3 d才开始生长,生长非常缓慢,平均生长速度为3.32 mm/d;40 ℃下菌丝完全不生长。
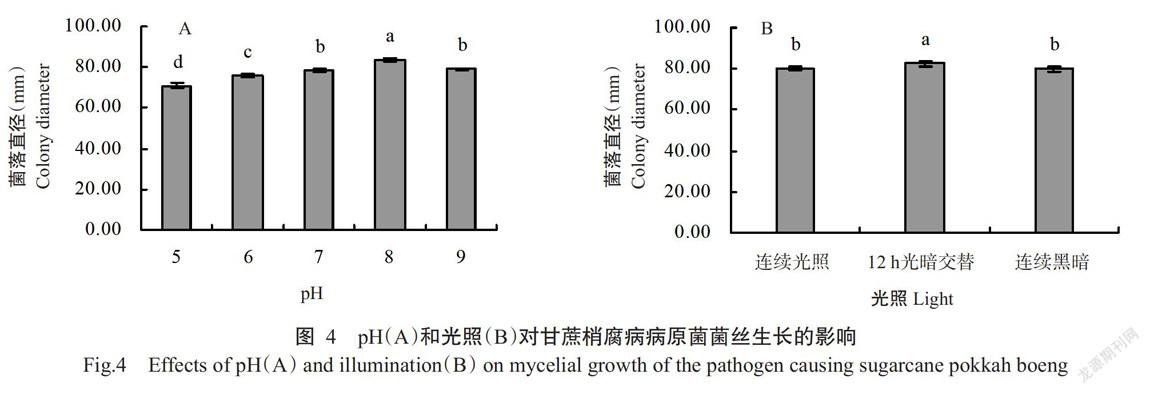
2. 4. 2 pH对病原菌菌丝生长的影响 试验结果(图4-A)表明,病原菌菌株对pH的适应范围较广,菌丝在pH 5~9内均能生长,其中最适pH为8(平均菌落直径为83.83 mm),且与其他处理间达显著差异水平;对菌丝生长影响最大的pH为5,平均菌落直径为70.83 mm,与其他pH处理间达显著差异水平,说明病原菌更适合在弱碱性的培养基中生长。
2. 4. 3 光照对病原菌菌丝生长的影响 试验结果(图4-B)表明,病原菌菌丝在12 h光暗交替条件下生长速度最快(平均菌落直径为82.33 mm),且与连续光照和连续黑暗处理间均达显著差异水平,而连续光照和连续黑暗处理对菌丝生长无明显影响,二者菌落直径差异不显著。
2. 4. 4 氮源对病原菌菌丝生长的影响 病原菌在6种不同氮源培养基上均能生长,其中在以胰蛋白胨为氮源的培养基上菌丝生长最快,平均菌落直径为82.56 mm,显著高于其他氮源处理;其次是以酵母粉为氮源的培养基,平均菌落直径为79.88 mm;菌丝生长最慢的是以硫酸铵为氮源的培养基,平均菌落直径为57.30 mm,且与其他处理相比均达显著差异水平;在不加氮源的CK中,平均菌落直径为78.40 mm,但其菌丝非常稀薄,无气生菌丝(表1)。不同氮源的培养基对病原菌菌落颜色也有影响,以甘氨酸、硫酸铵和硝酸钠为氮源的培养基,其菌落呈白色;而在以蛋白胨和酵母粉为氮源的培养基中,菌落呈黄色,与其在PDA培养基中颜色相同;在不加氮源的CK中,菌落呈紫红色。
2. 4. 5 碳源对病原菌菌丝生长的影响 病原菌在6种不同碳源培养基上均能生长,其中在以甘露醇为碳源的培养基上生长最快,平均菌落直径为79.10 mm,显著高于其他处理;其次为可溶性淀粉和葡萄糖,两者间无显著差异;蔗糖、D-果糖和CK处理稍弱,三者间无显著差异,但CK处理菌落稀薄,无气生菌丝生成,其他处理菌落致密,呈白色(表1)。
2. 4. 6 病原菌致死温度 病原菌菌丝在45、50、55、60、65、70和75 ℃ 7个温度梯度下分别预处理10 min,培养10 d后观察发现45、50、55、60和65 ℃ 5個处理的病原菌菌丝均能正常生长,而70和75 ℃处理的病原菌菌丝不能生长,因此初步确定病原菌致死温度在65~70 ℃;进一步将病原菌置于66、67、68和69 ℃ 4个温度下预处理10 min,观察发现培养2 d后,4个温度处理下病原菌菌丝均能正常生长,最终确定病原菌致死温度为70 ℃。
3 讨论
本研究对采集自广西崇左市甘蔗种植区的甘蔗梢腐病病叶进行病原菌分离及纯化培养,运用科赫法则进行致病性测定,结合病原菌的形态特征及分子生物学鉴定,确定引起广西崇左市甘蔗梢腐病的病原菌为轮枝镰刀菌。据研究报道,引起甘蔗梢腐病的镰刀菌种类繁多,其中包括F. moniliforme(Siti,2007)、轮枝镰刀菌(Mohammadi et al.,2012)和层生镰刀菌(Khani et al.,2013)等,但不同地区的优势菌不同,我国发现的甘蔗梢腐病病原菌主要包括轮枝镰刀菌和层生镰刀菌两种,其中轮枝镰刀菌为优势种(Lin et al.,2014),本研究结果与之相符,分离获得的菌株均为轮枝镰刀菌,进一步说明我国甘蔗梢腐病病原菌的优势菌为轮枝镰刀菌。
轮枝镰刀菌在向日葵(高婧,2016)、辣椒(刘丹,2016)、番茄(张斌等,2016)、水稻(陈宏州等,2018)和玉米(王芝涵等,2019)等作物上均有报道,但对其生物学特性的研究甚少。本研究对轮枝镰刀菌生物学特性测定发现,其菌丝适应生长的温度范围较广,在10~35 ℃内均可生长,在25~30 ℃内生长较好,最适温度为28 ℃,与火龙果镰刀菌果腐病病原菌(F. dimerum)(朱迎迎等,2016)和马铃薯干腐病病原菌(F. acuminatum)(刘丽萍和方鹏鹏,2017)对温度的适应范围相似,符合甘蔗梢腐病于6—9月高温高湿的气候条件下大规模暴发的规律。病原菌菌丝对pH的适应范围较广,在pH 5~9范围内均能正常生长,其中最适pH为8,说明菌株在弱碱性环境中生长最佳,与高婧(2016)对向日葵枯萎病病原菌生物学特性研究结果一致。
轮枝镰刀菌与尖孢镰刀菌的生物学特性有相同之处,适宜菌丝生长的温度均为5~35 ℃,光暗交替条件下更适合菌丝生长;但也有不同之处,表现为轮枝镰刀菌的菌丝更适合在偏碱性环境中生长,而尖孢镰刀菌在pH为6.26时生长最快,即更适合在偏酸性条件下生长(曲田丽和辛惠普,2003)。轮枝镰刀菌引起的甘蔗梢腐病危害较轻,主要危害梢部叶片,导致其黄化扭曲,病菌对生长点的影响较小,因此受害植株能迅速恢复生长;而尖孢镰刀菌引起的甘蔗梢腐病危害较严重,主要危害生长点,能在短时间内造成植株生长点坏死,导致整株植株死亡。
4 结论
引起广西崇左市甘蔗梢腐病的病原菌为轮枝镰刀菌,该菌适宜在高温高湿、弱碱性、光暗交替及富含有机营养的环境条件下生长。在对甘蔗梢腐病的防治中,要根据气候条件的变化提早防治,防止该菌在有利的环境条件下暴发流行。
参考文献:
陈宏州,杨红福,姚克兵,束兆林,周华飞,庄义庆. 2018. 水稻恶苗病病原菌鉴定及室内药剂毒力测定[J]. 植物保护学报,45(6):1356-1366. [Chen H Z,Yang H F,Yao K B,Shu Z L,Zhou H F,Zhuang Y Q. 2018. Identification of rice bakanae pathogens and indoor toxicity test of fungicides[J]. Journal of Plant Protection,45(6):1356-1366.]
番华彩,郭志祥,白亭亭,徐胜涛,杨佩文,尹可锁,郑泗军,潘艳华,李迅东,曾莉. 2018. 香蕉棒孢霉叶斑病病原菌生物学特性测定[J]. 南方农业学报,49(3):481-487. [Fan H C,Guo Z X,Bai T T,Xu S T,Yang P W,Yin K S,Zheng S J,Pan Y H,Li X D,Zeng L. 2018. Biological characteristics of pathogenic bacteria causing banana leaf spot disease[J]. Journal of Southern Agriculture,49(3):481-487.]
高婧. 2016. 向日葵枯萎病菌的分离鉴定、致病力分化以及侵染过程的研究[D]. 呼和浩特:内蒙古农业大学. [Gao J. 2016. The study on the pathogen isolation and identification,pathogenicity differentiation and infection process of sunflower wilt[D]. Hohhot:Inner Mongolia Agricultural University.]
何姗珊,方位宽,经艳,谭芳,韦永定,韦士评,梁朝旭,李鸣. 2016. 甘蔗梢腐病原菌分离纯化与ITS序列鉴定[J]. 广西糖业,(4):10-14. [He S S,Fang W K,Jing Y,Tan F,Wei Y D,Wei S P,Liang C X,Li M. 2016. Isolation of sugarcane pokkah boeng pathogen and ITS sequence identification[J]. Guangxi Sugar Industry,(4):10-14.]
胡美姣,杨波,李敏,杨冬平,蒲金基,张正科,高兆银. 2013. 海南芒果果腐病病原菌鉴定及其生物学特性研究[J]. 热带作物学报,34(8):1564-1569. [Hu M J,Yang B,Li M,Yang D P,Pu J J,Zhang Z K,Gao Z Y. 2013. Identification and biological characteristics of mango fruit rot pathogen[J]. Chinese Journal of Tropical Crops,34(8):1564-1569.]
李楊瑞,杨丽涛. 2009. 20世纪90年代以来我国甘蔗产业和科技的新发展[J]. 西南农业学报, 22(5): 1469-1476. [Li Y R,Yang L T. 2009. New developments in sugarcane industry and technologies in China since 1990s[J]. Southwest China Journal of Agricultural Sciences, 22(5): 1469-1476.]
刘丹. 2016. 甘肃省设施辣椒镰刀菌根腐病病原鉴定及抗病种质资源筛选[D]. 兰州:甘肃农业大学. [Liu D. 2016. Studies on pathogens and resistance to fusarium root rot on greenhouse pepper in Gansu,China[D]. Lanzhou:Gansu Agricultural University.]
刘丽萍,方鹏鹏. 2017. 马铃薯干腐病镰刀菌的分离及生物学特性研究[J]. 陇东学院学报,28(5):62-66. [Liu L P,Fang P P. 2017. The isolation and biological characteristic of Fusarium associated with potato dry rot[J]. Journal of Longdong University,28(5):62-66.]
卢文浩. 2007. 甘蔗梢腐病的发生及综合防治措施[J]. 作物杂志,(2):92. [Lu W H. 2007. The damage of sugarcanes pokkah boeng and the main control strategies[J]. Crops,(2):92.]
曲田丽,辛惠普. 2003. 绿豆根腐病菌生物学特性研究[J]. 黑龙江八一农垦大学学报,15(4):109-114. [Qu T L,Xin H P. 2003. The biological characteristics of the root rot pathogens in mung[J]. Journal of Heilongjiang Bayi Agricultural University,15(4):109-114.]
单红丽,李文凤,张荣跃,王晓燕,李婕,仓晓燕,尹炯,罗志明,黄应昆. 2018. 甘蔗梢腐病暴发流行原因及产量糖分损失测定[J]. 中国糖料,40(3):40-42. [Shan H L,Li W F,Zhang R Y,Wang X Y,Li J,Cang X Y,Yin J,Luo Z M,Huang Y K. 2018. Analysis on epidemic reason of sugarcane pokahh boeng and its losses on yield and sucrose content[J]. Sugar Crops of China,40(3):40-42.]
孙嘉曼,张进忠,韦弟,蓝霞,郭文峰,卢江. 2016. 一种新的香蕉黑斑病病原菌鉴定及生物学特性研究[J]. 植物病理学报,46(1):119-123. [Sun J M,Zhang J Z,Wei D,Lan X,Guo W F,Lu J. 2016. Identification and biological characterization of the pathogen causing a new black spot disease on Musa spp.[J]. Acta Phytophologica Sinica,46(1):119-123.]
王芝涵,王春伟,高海馨,荆琦,余廷濠,王燕. 2019. 引起玉米穗腐病的禾谷镰刀菌LAMP快速检测方法的建立[J]. 江苏农业学报,35(3):581-585. [Wang Z H,Wang C W,Gao H X,Jing Q,Yu T H,Wang Y. 2019. Development of loop-mediated isothermal amplification(LAMP) assay for the detection of the Fusarium graminearum causing ear rot of maize[J]. Jiangsu Journal of Agricultural Scien-ces,35(3):581-585.]
张斌,杨晓云,陈志谊. 2016. 番茄枯萎病致病镰刀菌种类鉴定及优势种群的研究[J]. 植物病理学报,46(4): 561-565. [Zhang B,Yang X Y,Chen Z Y. 2016. Identification of the pathogenic and dominant Fusarium species causing tomato Fusarium wilt[J]. Acta Phytophologica Sinica,46(4): 561-565.]
张玉娟. 2009. 甘蔗梢腐病病原分子检测及甘蔗组合、品种的抗病性评价[D]. 福州:福建农林大学. [Zhang Y J. 2009. Molecular detection and resistance evaluation for pokkah boeng disease of sugarcane[D]. Fuzhou: Fujian Agriculture and Forestry University.]
朱迎迎,高兆银,李敏,陈亮,胡美姣. 2016. 火龙果镰刀菌果腐病病原菌鉴定及生物学特性研究[J]. 热带作物学报,37(1):164-171. [Zhu Y Y,Gao Z Y,Li M,Chen L,Hu M J. 2016. Identification and biological characteristics of dragon fruit(Hylocereus undatus Britt) fusarium rot pathogen[J]. Chinese Journal of Tropical Crops,37(1):164-171.]
Bao Y X,Sun H J,Li Y F,Duan Z Z. 2016. First report of Fusarium oxysporum isolate gx3 causing sugarcane pokkah boeng in Guangxi of China[J]. Plant Disease,100(8):1785.
Khani K T,Alizadeh A,Nejad R F 2013. Pathogenicity of Fusarium proliferatum,a new causal agent of pokkah boeng in sugarcane[J]. Proceedings of the International Society Sugracane Technology,28:1-5.
Lin Z,Wei J J,Xu S Q,Guo Q,Wang X,Qiu Y X,Deng Z H,Huang J H,Charles A P,Chen B S,Chen R K,Zhang M Q. 2014. Species-specific detection and identification of Fusarium species complex,the causal agent of sugarcane pokkah boeng in China[J]. PLoS One,9(8):e104195.
Mohammadi A,Nejad R F,Mofrad N N. 2012. Fusarium verticillioides from sugarcane,vegetative compatibility groups and pathogenicity[J]. Plant Protection Science,48(3):80-84.
Siti N. 2007. Pathogenicity and aethiology of Fusarium species associated with pokkah boeng disease on sugarcane[D]. Penang:University Sains Malaysia.
(責任编辑 麻小燕)

