中药独家品种说明书安全性信息的评价研究
郑蕊 钟长鸣 关曼柯
摘要 近年对中成药说明书信息不全面的情况多有质疑。但目前情况到底如何尚无系统评估。本文从独家中药品种安全性信息入手,共收集692份说明书,其中包含521份处方药和171份非處方药。主要发现存在以下问题:对有毒、涉及十八反、十九畏药物警示不足,不良反应、药物相互作用、特殊人群用药等信息尚不明确。针对上述问题,本团队提出“三步走”策略,即转变认知、科研推进、公众科普,切实推进中成药说明书改进,适应“人人享有中医药服务”的临床迫切需求。
关键词 中成药;独家品种;说明书;安全性;征靶关联法;不良反应;药物相互作用;医保目录
Abstract There are many doubts about incomplete information in instructions of Chinese patent medicine in recent years.However,there is no systematic assessment on the current situation.In this paper,from safety information of exclusive varieties of Chinese materia medica,692 instructions are collected,including 521 prescription medicines and 171 OTC medicines.Main problems are found as follows:insufficient warning for toxic medicines and those involved in eighteen antagonisms and nineteen mutual inhibitions; and unclear information on adverse reactions,medicinal interactions and medication in special population.In response to the problems,“three-step” strategy is proposed.That is to change awareness,promote scientific research and popularize science among the public.It effectively promotes the improvement of Chinese patent medicine instructions to meet the urgent clinical needs that “everyone enjoys Chinese medicine services”.
Key Words Chinese patent medicine; Exclusive variety; Instructions; Safety; Association of feature-target method; Adverse reactions; Medicinal interactions; National Drug Reimbursement List
中图分类号:R242 文献标识码:A doi:10.3969/j.issn.1673-7202.2019.10.008
在《中医药发展“十三五”规划》中,国家中医药管理局提出“到2020年实现人人享有中医药服务”的目标。在我国308家(25 927例)医院进行的药物性肝损害调查发现,每年普通人群中药物性肝损伤的发生率至少为23.80/10万人,各类保健品和传统中药是最主要因素,共占比26.81%[1]。保证安全有效使用中成药,说明书对临床的指导作用至关重要[2]。
现有说明书已不能满足临床实际需求,其薄弱点在哪里,尚需系统地评估分析。独家品种是各大企业的“拳头”产品。其中云南白药、心可舒片、季德胜蛇药片等,更是中药明星产品。本文希望从独家品种说明书入手,对安全性信息进行梳理,为推进中成药说明书优化提供支持。
1 资料与方法
1.1 资料来源 以《国家基本医疗保险、工伤保险和生育保险目录》(2017年)中涉及的独家品种说明书为研究对象。独家品种定义为该品种在国家药品监督管理局仅有一家注册企业。
1.2 研究方法
1.2.1 说明书检索与相关机构收集 收集方式为网络检索与实地收集相结合。网络检索是指以“药品名+说明书”为检索词,在国家药品监督管理局官网、北京市医药阳光采购综合管理平台、药智数据、生产或营销企业网页等网页检索药品说明书;实地收集为与医疗机构、药店、生产企业等应用机构联系,直接获取药品说明书。筛选时,在可获取的范围内,选择最新版本。
1.2.2 评价标准 处方药:国家药品监督管理局印发的《中药、天然药物处方药说明书撰写指导原则》(原则);非处方药:国家食品药品监督管理局印发的《中成药非处方药说明书规范细则》(细则)等相关管理条例。对纳入说明书中涉及到的安全性信息各项目内容(成分、不良反应、禁忌、注意事项、孕妇及哺乳期妇女用药、儿童用药、老年用药、临床试验、药理毒理、警示语等)的标注情况逐一进行统计分析。
2 结果
本研究共收集692份说明书,包含75.29%(521份)处方药和24.71%(171份)非处方药。涉及药物剂型包括口服剂85.84%(594份)、外用剂11.12%(77份)、注射剂3.03%(21份)。功效分类上内科用药416份,占60.12%;其次为骨伤科用药59份,占比8.53%;之后依次为6.5%的外科用药(45份)、4.62%肿瘤用药(32份)、2.31%眼科用药(16份)、1.73%皮肤科用药(12份)。
2.1 成分报告 共10个品种列入国家秘密技术项目可不列出药方组成。
处方药:《原则》中要求列出处方中所有的药味或有效部位、有效成份等。8.25%(43份)说明书按要求完整报告主要成分及辅料;88.68%说明书(462份)仅报告有效成分;0.19%(1份)报告主要成分为商品名,未体现药物组成。对于注射剂还应列出所用的全部辅料名称:21份注射剂说明书中,42.85%(9份)的说明书仅列出主要成分,缺少对相关辅料的报道。
非处方药:《细则》中要求必须列出全部处方组成和辅料。非处方药说明书中,39份(22.81%)报告药物有效成分及辅料,未报告相关辅料。
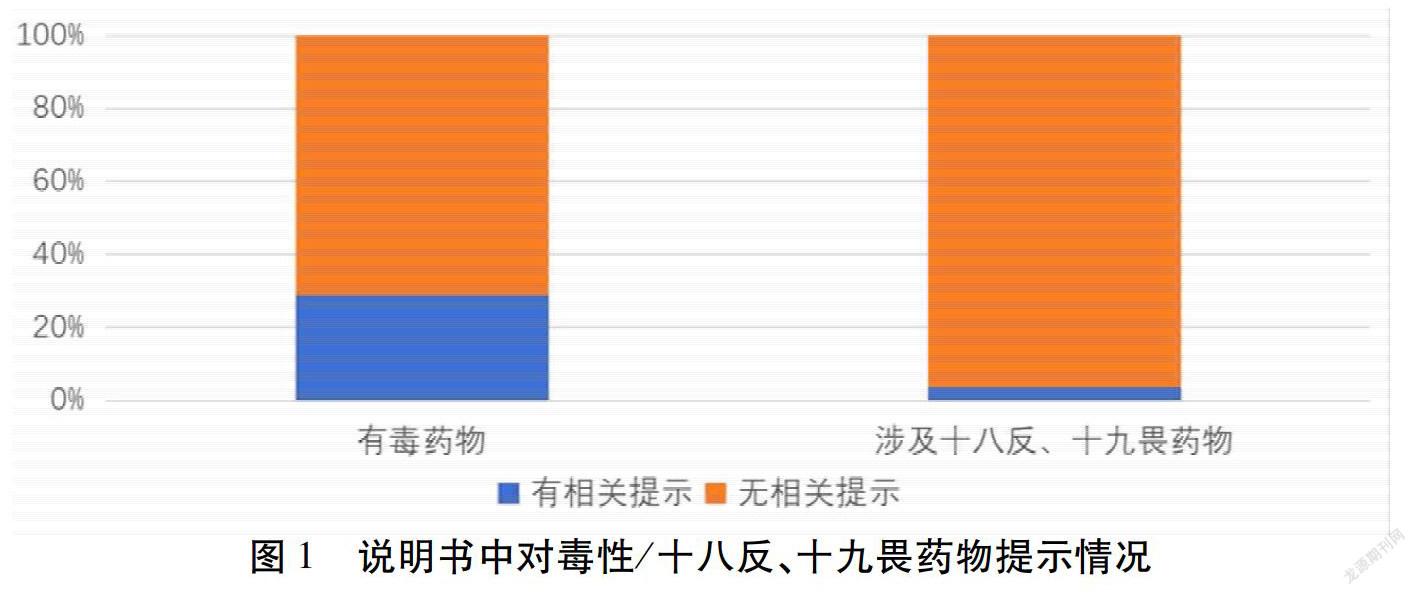
所纳入说明书中,181份在成分中涉及有毒药物,如朱砂、巴豆霜、蟾酥等。71.27%(129份)说明书没有任何提示,其余在注意事项,警示语中有所提示;298份说明书成分中涉及中药十八反、十九畏药物,如丹参、赤芍等,其中96.31%(287份)说明书未对配伍禁忌有任何提示。
2.2 警示语 《原则》与《细则》均要求警告或特别提醒用药人员,在用药安全方面需注意的事项。28.61%(198份)说明书在警示语中进行了详细描述,其中2份说明书由于条件所限不能看出是否使用明显字体标注;3.47%(24份)说明书未采用醒目的黑体字注明。
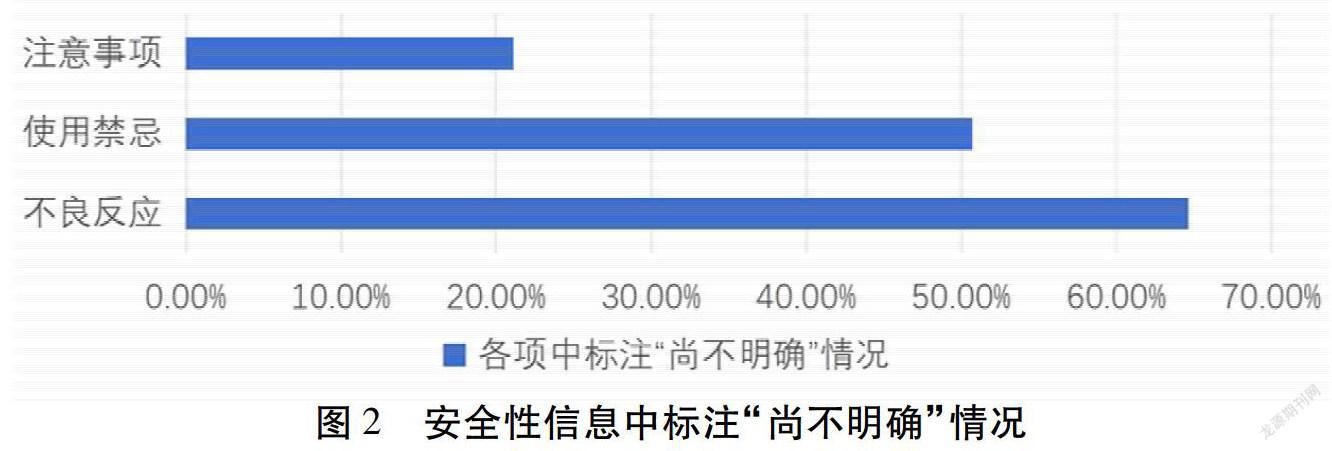
2.3 不良反应 《原则》与《细则》均要求在本项目下实事求是地详细列出该药品已知的或者可能发生的不良反应,对已公布的该药品不良反应内容不得删减。现有问题如下:1)信息缺失:64.6%(447份)说明书在此项下标注“尚不明确”;13.58%(94份)说明书按要求详细列出该药品不良反应;1.45%(10份)说明书中未提及此项;18.50%(128份)说明书缺少不良反应严重程度的描述;0.43%(3份)缺少不良反应发生频率的描述;0.43%(3份)说明书报告“未见不良反应”;0.58%(4份)说明书在不良反应项中,描述临床研究或文献报道病例情况。2)用词欠规范:国家医学科学组织委员会(CIOMS)要求,不良反应按其发生率分为十分常见、常见、少见、偶见、罕见、十分罕见6级。标准的表达有利于使用者对不良反应发生率的了解,也是用药知情的一部分。在本次统计中,存在多种不规范表达,如4.78%(31份)描述发生频率为“少数”;9.10%(63份)说明书描述频率为“个别”;0.87%(6份)描述为“极个别/极少数”;1.01%(7份)描述为“部分”;4.48%(31份)描述为“偶有/偶发”。
2.4 使用禁忌 50.72%(351份)说明书对于使用禁忌标注“尚不明确”;47.54%(329份)说明书按要求列出药品不能应用的各种情况,如患病人群、疾病情况等;1.73%(12份)说明书中未提及此项。
对于非处方药,《细则》要求使用加重字体印刷。69%(118份)说明书按要求采用加重字体;13.45%(23份)说明书未采用加重字体印刷;15.20%(26份)由于条件所限,不能看出是否加粗。
2.5 注意事项 71.82%(497份)说明书中列出在使用过程中必须注意的问题,但十分简略;21.10%(146份)说明书中在注意事项中标注“尚不明确”;2.17%(15份)说明书中未列此项。其中存在不合理表述现象,4.34%(30份)说明书标注“请遵医嘱”;有2份标注“打开防潮袋后,请注意防潮”,1份标注“出现肝功能异常,但临床判断与药物无关和可能有关”。
在规范表达上,非处方药要求对注意事项采用加重字体印刷。在统计的171份说明书中,72.51%(124份)符合要求;14.62%(25份)由于条件所限不能看出;12.87%(22份)未采用加重字体印刷。
2.6 药物相互作用 在21份注射剂说明书中,95.24%(20份)按照要求标注“尚无本品与其他药物相互作用的信息”;4.76%(1份)未做任何标注。其余非注射剂说明书中,21.16%(142份)说明书标注“如与其他药物同时使用可能会发生药物相互作用,详情请咨询医师或药师”。9.10%(61份)说明书未列此项。
2.7 特殊人群用药提示(仅处方药要求) 1)孕妇及哺乳期妇女用药:孕妇及哺乳期妇女用药信息,61.61%(321份)说明书标注“未进行该项相关研究,未列此项”;1.34%(7份)标注“尚不明确”;0.19%(1份)标注“未有相关研究”。2)儿童用药:儿童用药信息,1.34%(7份)说明书标注“尚不明确”;92.36%(476份)标注“未进行该项相关研究,未列此项”;0.19%(1份)标注“未有相关研究”。3)老年用药:老年用药信息中,1.15%(6份)标注“尚不明确”,94.82%(494份)标注“未进行该项相关研究,未列此项”。
2.8 临床试验及药理毒理报告情况(仅处方药要求) 85.08%(439份)说明书未描述临床试验情况。61.24%(316份)说明书未进行相关药理学研究。70.65%(411份)未进行相关毒理研究,未列此项;0.58%列出了主要人体毒理试验结果,19.78%说明书列出了以大鼠、小鼠为主的相关毒理试验结果。
3 问题分析
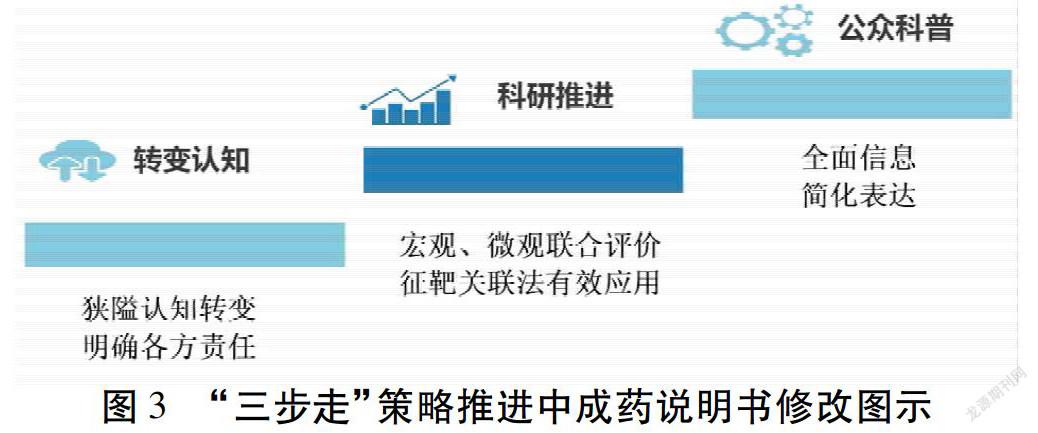
长久以来,中成药作为国家特色药品有非常广泛的使用[3]。随着公众对药品安全性问题认识的日益关注、社会舆论和媒体的传播与监督,比以往任何时期更容易发现问题。现行药品说明书中关于药物相互作用的内容几近空白,特殊人群用药表述含糊。一方面是因为早期对于中成药的研究不够充分,缺少精准、循证证据;另一方面,有狭隘的看法认为,越多的不良反应,禁忌证出现在说明书上,会影响患者、医护人员选用。一些药品已发现不良反应和禁忌事项,但尽力回避,不在说明书上标明。针对这些问题,笔者团队认为,在策略上可分“三步走”。
4 “三步走”解决策略
第一步:转变认知。2018年《检察日报》也发文论证“规范中成药说明书有利于中药长远发展”。中成药说明书不能再“说而不明”,必须全面规范地说明相关信息[4]。实际上,药品说明书上的“不良反应”写得越充分,越有利于用药后对异常情况的及时发现与处理,在某种程度上也可说明药物越安全。认知的转变,明确企业责任,可解决说明书中本应避免的简单问题,如有毒药物,十八反、十九畏药物的标注、发生频率的规范表达,可避免临床超剂量用药、错误联用等初级错误。第二步:科研推进。说明书中存在普遍的“尚不明确”的内容,原因除去认知意识的关系外,最主要的原因在于中医药科研力度不足[5]。基于中医临床实践、基础研究提供的全面信息,利用“征靶关联法”——总结临床多元证据体不良反应特征、分析网络靶标作用,在宏观和微观2个方面对中药安全性进行全面评价是现有的可行之路[6]。1)临床多元证据体的收集与分析:中医临床研究需注意研究目标、研究方法、过程监管及结果报告环节的优化和实施[7]。a.信息收集。安全性评价需要最广泛的信息来源来提供不同角度的、多层次的证据。为此可建立信息数据平台,包括病例报道、队列研究,随机对照试验、自发呈报系统的收集。也可利用手机软件等现代工具使医生、患者、药学人员随时监测、报告不良反应。b.风险评估。利用药品不良反应的数据挖掘技术有比值失衡测定法鉴定不良反应,包括报告比值比法[8]及贝叶斯判别可信区间递进神经网络模型法[9]等。Logistic回归分析法可用于筛选不良反应的影响因素,并根据Logistic回归模型预测不良反应的发生概率[10]。總结出中成药不良反应特征及影响因素。2)网络靶标分析:中药有多成分、多靶点的特征,加上临床应用中,中西药临用的各种情况格外复杂。联用中是否激活不良反应通路,增加不良反应是临床用药的隐忧之一。范骁辉团队在2011年提出了“网络毒理学”的概念[11],构建网络模型来描述中药的毒理学作用靶点,探讨其毒性机制等。该思路成功建立多味中药活性成分—毒性作用靶点—生物功能和通路网络,以及利用分子对接技术探讨其毒性的作用机制[12-13]。该思路可借鉴在该部分的网络靶标分析中,与临床特征相对应,填补说明书中不良反应、药物相互作用、注意事项等研究空白。第三步:公众科普。正如《人民日报》提出的“中成药说明书,请说得再明些”[14],说明书有其专业的表达方式,难以被公众理解应用。但对公众进行系统的中药说明书科普可有效解决该问题[15]。建议尤其是对患者可自行选购的非处方药,随药附赠小卡片等措施,以简单图画方式详细解释该药适合何种症状、避免与何种药物联用、可能出现的不良反应及应对方法等。符合大众认知层次,从合理应用上保障用药安全。
5 总结
随着国家及行业对中成药说明书开展了大量规范性工作,将有力地推动了中成药说明书修改优化[16-17]。越来越多的企业也开始意识到安全性评价的重要性,逐步开展相关中成药的安全性评价研究,相信通过“三步走”策略会逐步推进中成药说明书的优化,不断提升中医药的社会服务能力。
参考文献
[1]Shen T,Liu Y,Shang J,et al.Incidence and Etiology of Drug-Induced Liver Injury in Mainland China[J].Gastroenterology,2019,156(8):2230-2241.
[2]郑蕊,赵晨,陈诗琪,等.精确循证促进中药注射剂合理合法应用的策略与路径[J].世界科学技术-中医药现代化,2018,20(10):1713-1717.
[3]郑文科,刘智,雷翔,等.中成药上市后临床安全性评价研究模式的探索建立[J].中國中药杂志,2015,40(18):3693-3696.
[4]张淳艺.规范中成药说明书有利于中药长远发展[EB/OL].[2018-02-07].http://newspaper.jcrb.com/2018/20180207/20180207_005/20180207_005_2.htm.
[5]龚沁媛,赵蕾.中药说明书和美国药品说明书的调查与管理建议[J].中医药管理杂志,2019,27(17):42-44.
[6]郑蕊,陈诗琪,商洪才.中西药物联用安全性评价——“征靶关联法”的探索建立[J].世界科学技术-中医药现代化,2018,20(10):1734-1738.
[7]胡嘉元,张晓雨,蒋寅,等.我国临床研究发展现状及中医临床研究存在的问题、策略和实践[J].世界科学技术-中医药现代化,2018,20(8):1417-1421.
[8]Rothman K J,Lanes S,Sacks S T.The reporting odds ratio and its advantages over the proportional reporting ratio[J].Pharmacoepidemiol Drug Saf,2004,13(8):519-523.
[9]Bate A.Bayesian confidence propagation neural network[J].Drug Saf,2007,30(7):623-625.
[10]Mortality,David C.Classen M M,Stanley L.Pestotnik M R,et al.Adverse drug events in hospitalized patients:excess length of stay,extra costs,and attributable mortality[J].JAMA,1997,277(4):301-306.
[11]范骁辉,赵筱萍,金烨成,等.论建立网络毒理学及中药网络毒理学研究思路[J].中国中药杂志,2011,36(21):2920-2922.
[12]郝俊霞,高梓森,高皓,等.基于网络毒理学探讨草乌心脏毒性[J/OL].中国实验方剂学杂志:1-14[2019-11-08].
[13]高皓,贾党生,郝俊霞,等.基于网络分析细辛毒理学[J].中国实验方剂学杂志,2019,25(10):180-187.
[14]林丽鹂.中成药说明书,请说得再明些[EB/OL].[2018-02-06].http://paper.people.com.cn/rmrb/html/201802/06/nw.D110000renmrb_20180206_1-10.htm.
[15]孙昱.中国香港和中国内地中药说明书的药学相关要求对比[J].中国临床药理学杂志,2019,35(9):915-920.
[16]孙世光,孙蓉.药物利用指数与药品说明书评价相关性研究:中药注射剂[J].中华中医药杂志,2016,31(9):3497-3501.
[17]孙世光.中药注射剂临床使用合理性与安全性再评价体系构建[J].中华中医药杂志,2017,32(4):1411-1414.
(2019-09-10收稿 责任编辑:徐颖)

