AP化学酸碱平衡考点整合
杨新轩
摘 要:AP全称为Advanced Placement,为美国大学先修课程,是学生申请国际大学评价的一个重要指标,可有效的衡量学生专业课程的学习能力。本论文从知识构成和考察方式两个方面对高考和AP考试进行客观的比较,并分析AP化学在酸碱平衡这一章所涉及的知识点,通过总结历年的考察本章知识点的习题,整合出常见的知识点考察方式,并以问题的形式给出,帮助学生巩固知识点,提高分析和做题能力。
关键词:AP化学;酸碱平衡;考察题型
1 课题研究背景介绍
1.1 AP课程背景简介
AP是Advanced Placement的缩写,中文一般翻译为美国大学先修课程、美国大学预修课程。指由美国大学理事会(The College Board)提供的在高中授课的大学课程。美国高中生可以选修这些课程,在完成课业后参加AP考试,得到一定的成绩后可以获得大学学分。
1.2 本课题研究动机及目标
本文作者在西安高新一中国际课程班工作时间三年,在三年间主要教授AP化学,对于考试的题目有比较全面的认识。学生在化学学科方面整体的成绩不是很突出,所以就想要找出一个方法通过重新整合知识点和考法让学生建立简单而又印象深刻的知识框架。帮助学生将不同的酸碱平衡题目找出规律,找出常见的考察的知识点和重难点并帮助他们突破。
2 教材内容分析
酸碱平衡为AP化学教材的16章和17章。
第16章:
16.1 酸碱理论和布朗斯特酸碱理论;
16.2 共轭酸碱对及其相对强弱
16.3 水的自耦电离和离子积
16.4 pH与pOH
16.5 强酸强碱pH计算
16.6 利用电离常数计算弱酸溶液的pH值及多元弱酸pH计算
16.7 利用电离常数计算弱碱的pH值
16.8 Ka和Kb的关系
16.9 盐溶液的酸碱性
16.10 结构和酸碱性强弱的关系
16.11 路易斯酸碱理论
本章内容之前是化学平衡,学生已经初步建立分析平衡问题的基本思路和能力。本章内容是酸碱平衡是基础研究,主要研究对象为单一溶液。布朗斯特酸碱理论中的酸碱物质涵盖范围更加广泛,学生要清楚在水溶液中酸碱都有怎样的离子行为,所以电离方程式的书写就是本章第一个重点的内容。
在此基础之上,学生通过书写弱酸弱碱的电离方程式,引入新的平衡常数——电离常数,利用在化学平衡这一章所学的平衡常数的应用:用平衡常数判断反应进行的限度,来用电离常数的大小判断弱酸的酸性相对强弱。用共轭酸碱对电离常数之积等于水的离子积可以有效判断弱酸共轭碱的相对强弱,以此理论可顺利解释强酸制取弱酸的反应有较大的自发性。此为本章第二个重点。
pH计算的引入是酸碱平衡的一大难点,对于强酸强碱溶液的pH计算方法相对较为容易,因为二者都是完全电离,可以直接通过酸碱浓度求取氢离子浓度。而弱酸弱碱溶液pH的计算就是本章最大的难点。这部分理应引导学生列化学平衡三段式,利用平衡常数表达式来计算氢离子浓度,然后再求取pH值。弱碱的计算方法和弱酸类似。对于多元弱酸,因为是分步电离且各级电离常数依次减小,所以直接可以将其视为一元弱酸来计算pH值。
盐溶液的酸碱性也是AP经常会考的东西,主要用于判断滴定终点溶液的酸碱性。在AP中,可直接利用布朗斯特酸碱理论来解释盐溶液的酸碱性。通过判断组成盐的阴阳离子所属物质可以迅速的判断盐溶液的酸碱性,对于水解反应,也可以直接写成布朗斯特酸碱电离方程式。
第17章:
17.1 同离子效应
17.2 缓冲溶液及其pH计算
缓冲溶液的工作原理
17.3 酸碱中和滴定
强酸滴定强碱
强碱滴定弱酸
强酸滴定弱碱
多元弱酸滴定
盐溶液的滴定
本章内容主要是酸碱平衡的应用,第一节同离子效应为后面的缓冲溶液和酸碱中和滴定作以铺垫,缓冲溶液是本章内容的第一个重点。在强酸滴定弱碱的过程中或者强碱滴定弱酸的过程中,未到等当点之前待测液构成缓冲溶液,为共轭弱酸和共轭弱碱构成,所以在此过程中pH计算考察次数极多。
化学是一门以实验为基础的自然科学,所以酸碱平衡在实验中最常见的考察方法就是以滴定的形式考出。第一部分就是实验操作的考察,实验原理,实验仪器,每一步的实验操作,特别是对于滴定管和移液管的考察尤为多。第二部分是酸碱滴定中的计算问题,在已知标准液、待测液体积和浓度的情况下计算待测液的浓度。第三部分主要考察在滴定过程中pH的变化,特别是强碱滴定弱酸,在最开始的时候为一元弱酸体系,可按照一元弱酸体系处理。当开始滴定还未到等当点的期间,构成缓冲溶液,此时可以先通过计算共轭酸碱对浓度,然后在用缓冲溶液pH计算公式计算pH=pKa+log[[A-][HA]]。此过程中最重要的点就是滴定半程,在半程的时候[A-]=[HA],所以pH=pKa,这也是酸碱中和滴定第二个重要的应用,可以通过酸碱中和滴定的曲线来求出电离常数大致的范围。第三点是在等当点时pH的计算,等当点溶液中溶质为NaA,此时可以按照一元弱碱处理,计算溶液的pH值。最后一点就是指示剂的选择,指示剂可以认为是不同颜色的共轭酸碱对,理論变色点为pH等于pKa的点,所以选择指示剂的原则就是其pKa离等当点pH最近。
以上就是在AP化学中酸碱平衡的知识点总结和常见的考法,笔者将2002年到2018年所考到的所有关于酸碱平衡的题目选出,并对每一问的考察知识点和考察方法做以总结,并通过总结、改编和整合整理出能涵盖所有考点的习题。
3 AP考试题目考点分析
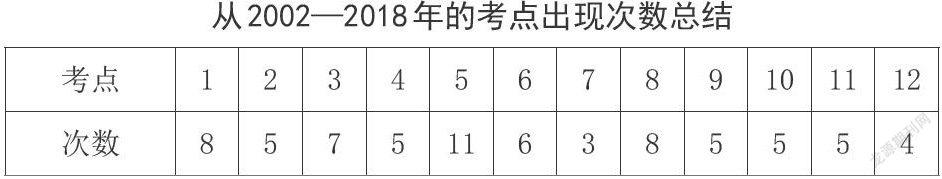
从2002—2018年的考点出现次数总结
通过对历年的AP简答题中的酸碱平衡问题进行分析,不难发现,对于缓冲溶液的考察尤为重要,对不同酸碱平衡体系的pH计算更加考察学生对于平衡的理解,对于溶液中离子行为的围观认识,有利于构建学生的微粒观,加深学生对化学反应的认识。
而在题目逐年的分析中,笔者发现题目的考点并未发生太大的改变,但是提问的方式有很大改变,题目从简单的计算更倾向于学生运用所学对知识进行主观解释,这样就需求学生对知识点有更深刻的认识。
4 题目的整合与设计
例题:
1.已知一元弱酸HA的Ka=1.0×10-5
(a)请写出HA电离方程式; (电离方程式)
(b)HA的共轭碱是什么? (共轭酸碱对)
(c)如果HB电离常数为1.0×10-6,则与HA相比哪一个的酸性更强,为什么?
A-与B-相比哪一个碱性更强,为什么? (电离常数和酸碱性强弱关系)
(d)请写出HA电离常数Ka表达式; (电离常数表达式)
(e)请计算A-的电离常数Kb; (共轭酸碱对Ka和Kb关系)
(f)(i)请求算浓度为0.100mol/L的HA的pH值; (用Ka计算一元弱酸pH值)
(ii)请求算此溶液中HA的电离度; (电离度)
(iii)0.100mol/L的HB(一元弱酸)溶液的pH值为4.00,求其电离常数Ka; (用pH值求取Ka)
(iv)浓度为0.100mol/L的H2C(二元弱酸)溶液pH值为多少?
已知: Ka1=1.0×10-5 Ka2=1.0×10-9 (多元弱酸pH计算)
(g)(i)请计算0.100mol/L的A-溶液的pH值 (一元弱碱pH计算)
(ii)哪些物质是布朗斯特弱碱? (对于布朗斯特酸碱理论的认识)
(h)判断下列物质溶液的酸碱性并用水解方程式解释。 (盐溶液的酸碱性)
FeCl3 Na2CO3 NH4NO3 CH3COONa
(j)完成下面的方程式并指出那个物质是路易斯酸; (路易斯酸碱理论)
(i)NH3 + BF3
(ii)AgCl + NH3
2.已知一元弱酸HA的Ka=1.0×10-5
(a)如果加水到0.100M的HA溶液中: (稀释过程中的离子行为)
(i)pH怎么变化,为什么?
(ii)电离度怎么变,为什么?
(iii)电离常数怎么变,为什么?
(iv)如果加入NaA到溶液中,以上三项如何变化?
(b)已知四种混合溶液组成 (缓冲溶液的配置和性质)
①0.1M的NaOH溶液100mL与0.1M的HA溶液100mL
②0.2M的NaOH溶液100mL与0.1M的HA溶液100mL
③0.1M的NaOH溶液100mL与0.2M的HA溶液100mL
④0.1M的NaA溶液100mL与0.1M的HA溶液100mL
(i)以上哪一个溶液是有效的缓冲溶液?
(ii)你还有其它方法可以制取缓冲溶液吗?
(iii)计算你选择有效缓冲溶液的pH值; (缓冲溶液pH计算)
(iv)哪些缓冲溶液pH>7,哪些缓冲溶液pH<7?
(v)HCO3-是一种有效的缓冲溶液吗?
(c)如果用0.100M的标准氢氧化钠溶液去滴定25.00mL未知浓度的HA溶液
(i)如果消耗氢氧化钠溶液的体积为25.00mL,则HA溶液浓度为多少? (中和滴定的计算)
(ii)在等当点时,pH值大于7、小于7、还是等于7,为什么? (盐溶液酸碱性判断)
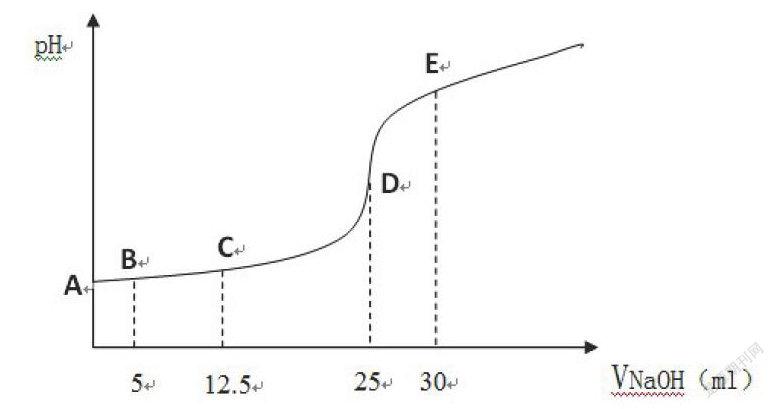
(iii)请画出滴定曲线; (滴定曲线)
(iv)请求出下图中ABCDE五个点的pH值。(酸碱中和滴定过程中pH计算)
(v)等当点和滴定终点有什么区别?
(vi)请选择最合适的指示剂并解释 (指示剂的选择)
以上两道习题基本涵盖酸碱平衡简答题的所有考法,每一道小题对应一个知识点,对于这些知识点的要求,有些需要学生熟知,有些需要学生会计算,还有写需要学生解释其原理。在做这些整合题的时候,相当于有效的帮助和引导学生复习,将每一个知识点理解透彻,可以针对每个知识点自己还原知识内容,补充未涉及到的细碎知识,自我总结和梳理能力才是笔者最希望学生能通过解析整合题获得的东西。
5教学成果反馈和反思
通过让学生做整合题,在让学生锻炼读题和做题能力的同时,也让学生对知识和考点进行总结和复习,让学生们在学习章节知识时能梳理出自己的知识框架。帮助学生提高视角,能站在出题人的角度上去思考题目,可以更加透彻的领悟题目的用意。在让学生做了整合题以后,笔者和学生交流讨论,学生们坦言,之前在做相关习题时主要存在的问题是读不懂题和不知道如何入手去解决问题,而在有了整合题后,学生基本上每一个问题都可以在整合题中找到相对应的小题,可以用类似的方法去解决问题。解题能力提高较为显著。
针对最近几年的题目考察方式的分析,死板的问题考察已经慢慢被灵活新颖的试题背景所替换。现在的题目更多的是基于一个实验中存在的问题引入知识点的考察,在解决问题的过程中一步步引导学生通过所学的知识去解决问题,这也正是新课标下要求在教育过程中提倡的学科素养,不仅仅让学生学到知识,要让学生在真是的实验环境下,真是的生活中将所学知识合理的运用并解决问题。针对这样的题目,如何提高学生的读题能力是下一步需要重点解决的问题。
6 结语
培养优良的品质和优秀的学习能力,才是新时代教育工作者在培养国家的栋梁之才之时所需着眼的重点,如何有效的提高学生在处理问题时的思维模式的高度和反应效果便是我们在平日教育教学过程中最应该思考和反思的问题。我们也应该像學生一样,在出现各种各样新的问题和挑战的时候,用于面对,不畏惧,不退缩,发扬“为时创新,人尽其才”的高新一中精神。

