脂质家族新成员——结构脂质研究进展
吴 进 董雪 季圣阳 吴 莹 徐斐然 鞠兴荣
[摘要]本文主要介绍了结构脂质的定义、应用、制备方法及限制其工业化生产的因素。结构脂质经过多年的研究,已经有了一套成熟的体系,且在市场上也有着许多的功能应用,主要包括中长碳链脂肪酸结构脂质、低热量结构脂质、人乳代替脂肪和可可脂等功能性脂肪代替物。结构甘三酯的合成需要酶作为催化剂参与,所以催化反应可以分为化学催化和酶催化,根据反应步骤可分为一步催化反应、两步催化反应及多步催化反应。即使结构脂质的研究方法已经相对成熟,但用于工业化生产的仍占少数,主要的限制因素就是成本,而重中之重就是酶,所以结构脂质这个课题需要进一步的研究探索。
[关键词]结构脂质;脂肪酶;化学催化;功能应用
中图分类号:TS221 文献标识码:A DOI:10.16465/j.gste.cn431252ts.201912
脂肪是人类生命所需的七大营养素之一,同时也是许多食品中的必要成分。大量的研究表明日常食用脂质中,甘油三酯(Triacylglycerols)的含量占93%~95%,其由甘油和脂肪酸酯化而成,甘油的骨架上连接着相同或不同的脂肪酸。脂肪酸根据碳链长度的不同分为碳原子数小于6的短链脂肪酸,8~12个碳原子的中链脂肪酸,长链脂肪酸指含有14个或以上碳原子的脂肪酸。中碳链脂肪酸甘油酯(MCT),与长碳链脂肪酸甘油酯(LCT)有着不同的代谢途径。中碳鏈脂肪酸甘油酯的特点是代谢快,可以迅速供能[1],但不含有必需脂肪酸,且迅速代谢会导致酮体浓度升高,对糖尿病人不利;长碳链脂肪酸甘油酯虽然有着人类所需的多不饱和脂肪酸,但代谢缓慢且不易被人体吸收。因此,结构脂质应运而生,它结合了中、长碳链脂肪酸的优点,且在较大程度上规避了缺点,并且研究者进行了更深层次的研究,包括加入EPA、DPA、DHA等对人体有利的多不饱和脂肪酸及一些特殊功能的物质如阿魏酸、抗坏血酸等。如今,随着结构脂质技术的进步,其用途正在不断扩大中,所以对结构脂质的研究具有重要意义。
1 结构脂质的定义
结构脂质一般是指经过化学物质或酶催化改变原来甘油酯上脂肪酸种类或者排列形成的新的具有特定作用或功能的脂质。近年来研究发现,甘油上的脂肪酸组成及分布都影响着结构脂质的性质及功能。甘油有三根骨架,可以连接三个脂肪酸,根据其空间排列,可分别命名为Sn-1、Sn-2、Sn-3,结构脂质根据酰基数量分类,可分为单酰基甘油、二酰基甘油和三酰基甘油,其中研究较多的是二酰基甘油和三酰基甘油。
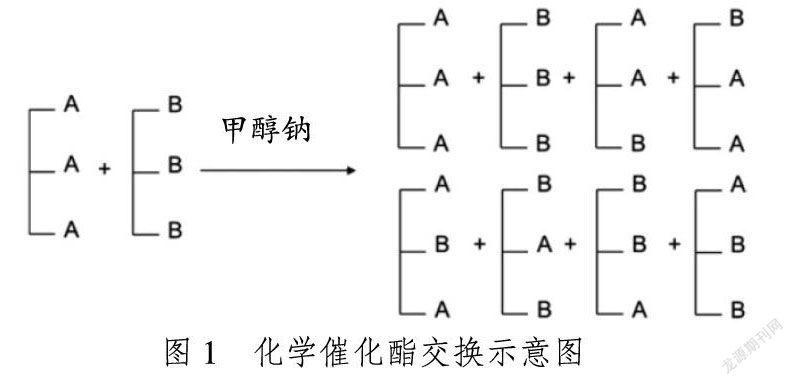
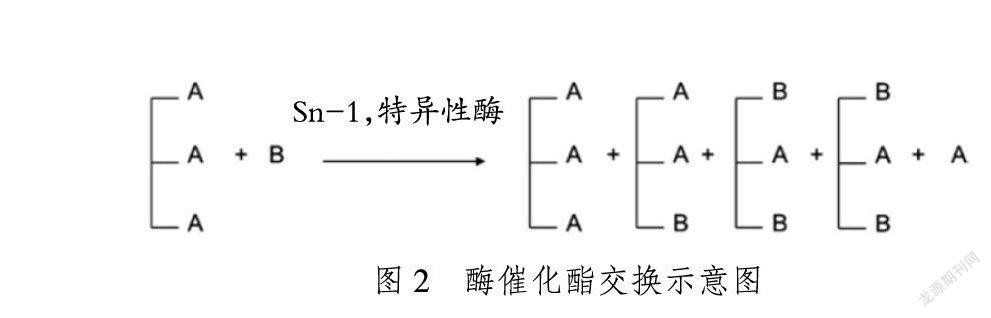
合成结构脂质的一般方法有化学催化酯交换法和酶催化酯交换法,通过在甘油骨架上接上特定脂肪酸以获得具有一定功能的结构脂质[2-3]。两种催化方法各有利弊,化学催化酯交换法一般使用甲醇钠作为催化剂,操作简单、合成成本较低、可规模化生产,但缺点是酯交换过程是随机发生的,并不能控制脂肪酸连接在想要的位置上[4],且反应温度较高,易造成脂质的氧化[5],所以目标产量低、副产物多,进而造成高额的分离提纯费用;酶催化酯交换法一般使用Sn-1,3特异性酶,只裂解1,3位置上的脂肪酸而保持2位上的脂肪酸不变,再往1,3位上插入目标脂肪酸来获得结构脂质。目前实验室研究大部分是采用酶法酯交换,虽然酶法更准确高效但同时也存在着问题,用于催化的脂肪酶价格较高,难以应用于工业化生产,且即使是特异性酶的催化也不能保证得到的都是目标结构脂质,其中会有酰基迁移等问题,实际得到的产物也会有其他杂质,需要进行分离提纯。化学催化酯交换过程见图1,酶催化酯交换的过程见图2[6]。
2 结构脂质的一般应用
2.1 中长碳链结构甘油酯
中碳链脂肪酸与长碳链脂肪酸代谢不同,低于12个碳原子的脂肪酸能够被门静脉直接吸收,而不用像长碳链脂肪酸一样经过复杂的淋巴系统代谢吸收。但中长碳链脂肪酸各有优缺,所以研究者就综合并放大其优点,削弱其缺点制造出了中长碳链结构甘三酯。中长碳链结构甘三酯既能提供能力又能提供营养,其主要形式是Sn-1,3位上为中碳链脂肪酸,在Sn-2位上插入对人体有益的多不饱和脂肪酸如DHA、EPA、DPA等,这种为中长中(MLM)型结构脂质[7]。
2.2 低热量脂质
如今,肥胖已经成为全球化问题,根据WHO调查,至2014年,全世界有19亿的成年人是超重的,其中6亿人属于肥胖。所以应对肥胖已经刻不容缓,而作为能量的主要的来源,减少脂质的能量可以从源头上解决肥胖这一问题。已经有研究针对这一问题提出了两种方案,一种是制造低热量的结构脂质,还有一种是制造一种不容易被吸收的结构脂质[8]。一般脂肪酸的热量在5kcalg-1左右,脂质的热量为9 kcalg-1左右[9]。而经过酯交换的结构脂质吸收产生的热量也大约是5 kcalg-1,通过含有长碳链脂肪酸的甘油酯与短链的酸进行酯交换制得这种结构脂质,称为Salatrim(Benefat)[10-11]。这是一种零反式脂肪酸的脂质,且保留了普通脂质的质感,通过调节长碳链和短碳链脂肪酸的比例可以调节脂质的特性。
2.3 人乳代替脂肪(HMFS)
人乳脂肪中甘三酯占98%,提供了婴儿50%的能量,对婴儿的生长发育具有重要的影响[12]。人乳脂肪中的甘三酯有着特定的结构,主要的不饱和脂肪酸为油酸并分布在Sn-1,3位上,而Sn-2位上主要是饱和的棕榈酸[13-14]。所以在人工合成的人乳代替脂肪中,甘油骨架中间位置上一般为棕榈酸,在两边的骨架上接上不饱和脂肪酸。人乳代替脂肪有着众多好处,研究者指出:HMFS可以提高棕榈酸的吸收率,保持新生儿的矿物质平衡,促进新生儿的骨骼发育,有利于肠内微生物群,并且能让婴儿更安静,减少哭闹[15-17]。
2.4 可可脂及其他脂质产品的代替物
可可脂是需求量比较大的一类脂质,由于原料限制其生产一直受限,但现在已经可以用结构脂质代替可可脂[18]。可可脂中主要的甘三酯结构为Sn-1,3位上是棕榈酸或者硬脂酸,Sn-2位上是油酸,正是这样特殊的结构,使得可可脂的熔点接近于人体温度[19]。通过人工制造出的结构脂质有着与可可脂相同的物理化学性质,可以部分或全部代替可可脂。已经有很多研究者就这样一方面做了大量的研究,在1,3位特异性脂肪酶催化下使用高油酸的葵花籽油与硬脂酸进行酯交换反应制造可可脂代替物;Mohamed[20]使用棕榈酸与硬脂酸的混合物通过酶促酯交换与橄榄油反应制造出了与可可脂性质相近的代替物;还可以用大豆油与硬脂酸乙酯反应制造出可可脂代替物[21]。
其他脂质产品代替物包括人造黄油和起酥油[22],商业上是通过氢化植物油来生产,经过氢化的植物油可以提高熔点及稳定性,但也会产生对人体不利的反式脂肪酸。通过酯交换反应来制造这些脂质产品可以有效避免这一问题,生产出零反式脂肪酸脂质产品代替物。
3 结构脂质的制备
3.1 化学催化制备结构脂质
结构脂质的合成一般需要催化剂的参与,一些化学试剂可以作为催化剂催化结构脂质合成反应。现在实验室及工业生产中一般用甲醇钠作为化学催化剂,反应在高温下进行。有研究者探索了经过化学酯交换的棕榈硬脂、棕榈仁油及大豆油混合物的物理化学、微观结构和热性能的变化。最终经过最佳配方得出的酯交换反应产物可以作为人造黄油,表明化学酯交换制造产品是可行的。但在其他一些化学酯交换反应中,由于高温,容易使得脂肪酸氧化变质,且有一些化学催化剂有毒,不能用于食品生产。然而影响化学催化生产结构脂质的最根本原因还是其不定向催化,产生了大量的副产物,提高了分离纯化的成本。
3.2 酶催化制备结构脂质
相较于无法控制的化学催化反应,酶法催化的反应条件更加温和,且特异性强,受到了广大研究者的青睐,大部分结构脂质制备的文章中也是以酶作为催化剂。酶催化结构脂质制备反应根据反应步骤可以分为一步催化反应、两步催化反应以及多步催化反应,下面大致介绍了几种反应。
3.2.1 酶催化一步反应制备结构脂质
常用的一步催化方法有醇解、酸解酸和甘油上的脂肪酸、酯交换。
最近关于1,3-二油酰基-2棕榈酰甘油(含有或不含有溶剂)合成的文章报道了在ST的Sn-2碳上具有16个碳原子的羧酸(C16:0,PA)为92.9% 和86.6%使用溶剂或在无溶剂反应介质中,而OPO含量分别为32.3%和40.2%.Lipozyme TL-IM不易重复使用,但Lipozyme RM-IM在该反应中保持近60h的活性[23]。通过超声处理强化导致OPO产量在4小时后增加到51.8%。反应介质的超声波接触1小时后OPO含量达到35.9%,而没有4小时后OPO含量达到35.9%。在超声辐照下重复使用Lipozyme RM-IM十次不会影响脂肪酶活性[24-25]。有许多研究使用Lipozyme RM IM將C8:0植入植物油中,加入或不加溶剂[26]。用1∶4摩尔芥花油或10%脂肪酶和15小时合成的ST具有几乎8%的C8∶0,52.7% C18∶1酸和28.4%亚油酸位于中心位置。此外,模型体系的研究,例如用辛酸进行的OOO反应(即O油酸),使得酸解动力学模型的发展成为可能[27]。
在实验室规模下,规划实验工作的新方法可以降低成本和时间,所以响应面法被应用于结构脂质合成中[28]。即使许多方法扩大到工业生产很难实现,但在实验室规模上仍在继续研究,例如离子液体反应体系。
3.2.2 酶催化两步法合成结构脂质
目前科学家已经探索出很多两步法合成结构甘三酯,但其中最重要也最常用的两种方法如下。
方法一:首先用Sn-1,3特异性酶解开甘三酯1,3位上的脂肪酸,获得只有Sn-2位上存有脂肪酸的单甘脂,再用酶催化单甘脂与经过挑选的目的脂肪酸进行酯化反应,最终获得目标结构脂质。
方法二:先将目标脂肪酸与甘油反应,通过特异性脂肪酶催化,将脂肪酸连接在1,3位置上获得二酰甘脂,随后将获得的二酰甘脂与合适的脂肪酸在无特异性脂肪酶催化下反应,将Sn-2位上的脂肪酸补全。
在两种方法中,步骤一与步骤二之间还需要完成一项重要的任务,就是分离纯化步骤一的产物为步骤二提供合适的底物。分离纯化方法有多种,其中最有效的是分子蒸馏,但成本比较昂贵,代替方法有低成本的有机溶液萃取。
相关研究人员报道了一种新的酶促方法,包括两个步骤,合成对称的甘三酯且Sn-2位上的脂肪酸为花生四烯酸[29]。该方法涉及通过甘三酯与乙醇的反应制备富含2-花生四烯酰甘油(2-AG)的2-单酰甘脂。通过2-单酰甘脂和棕榈酸乙烯酯之间的酶促反应获得对称甘三酯,最终目标结构甘三酯的得率为89%。选择棕榈酸乙烯酯代替棕榈酸作为与2-单酰甘脂反应的不同羧酸部分来源。通常,EPA和DHA被认为是非常重要的PUFA。然而,由于空间和电子因素,脂肪酶不容易生成这些脂肪酸。考虑到鱼油作为来源,通过用假丝酵母(Candida cylindracea)选择性水解鱼油,在反应介质中分离EPA / DHA并最终用米氏根毛霉(Rhizomucor miehei)用乙醇进行酯交换来合成富含DHA的甘油三酯。第二种方法涉及鱼油的非选择性水解,随后分离进一步用CALB和甘油的混合物酯化的DHA/EPA混合物。
3.2.3 化学-酶法多步合成结构脂质
有研究者提出了一种合成1,3二油酸-2棕榈酸(OPO)的多步骤方法。首先,通过乙酸乙烯酯和油酸之间的反应制备油酸乙烯酯[30]。其次,在Novozym 435存在下使酯与甘油接触。存在于未纯化产物中的1,3-二烯烃量为90.8%,产率为82.3%(w/w),纯度为98.6%。在第三步中,纯化的1,3-二酰基甘油用棕榈酸酯化,产生94.8%的OPO。
Halldorsson A等[31]提出了基于甘油与中碳链脂肪酸的乙烯基酯反应的方法的突破性改进,其在0℃~48℃具有优异的性能。在实验中使用了南极假丝酵母脂肪酶B(CALB),特异性攻击甘油的羟基。随后,通过特异性极强的偶联剂EDCI/DMAP将纯EPA和DHA再次引入Sn-2位置。2010年同一组的其他出版物报道了在甘油中心位置是生物活性高的多不饱和脂肪酸(EPA或DHA)甘油骨架的Sn-1和Sn-3上是短链脂肪酸(C2,C4,C6)。在不使用酰基迁移的情况下,在两个酶促步骤中使用脂肪酶在低温下使用活化的乙烯基酯选择性地将具有低数目碳原子的羧酸引入甘油的伯羟基中,游离EPA和DHA与EDAC作为偶联剂[32-33]。
3.2.4 其他酶法合成结构脂质
研究者还探索了其他酶法合成结构脂质的方法,在一些方法中,結构脂质有时候并不是第一产物,可能作为副产物出现。使用乙酸甲酯作为酰基供体,植物油可以快速转化为脂肪酸甲酯和甘油三乙酸酯。有文献报道使用南极假丝酵母脂肪酶转化甘油三酯,高达80%的脂肪酸酯和AAA(用乙酸酯化的甘油)可以获得。这些结果是通过控制酶蛋白的有效水分和水合物含量来实现的。有研究者探索了磁性纳米颗粒在固定化脂肪酶方面的应用,还有其他一些有机无机的复合材料[34-35]。尽管有报道使用了膜技术[36],将脂质体和复合材料作为甘油三酯合成的载体,从纳米微粒到微球[37],但并没有应用于实际,主要的限制因素就是成本花费。其他学者列出来各种脂肪酶,并研究了脂肪酶在其他方面的应用[38-39]。
3.3 影响脂质交换的因素
影响脂质交换的因素有很多,除了前文提到的催化剂,还有酶载体、温度、底物混合比例、PH、水、底物空间位阻以及产物抑制。
用于脂肪催化的酶价格昂贵,所以一般都是使用固定化酶技术,方便回收,多次利用。另外,考虑到生物催化剂在生产过程(反应器操作和分离步骤)中的性能,载体的机械稳定性是一项重要的参数。生物催化剂载体对压缩和摩擦阻力具有很高的抵抗能力,这是至关重要的[40-42]。
温度对酶催化酯交换速率也有影响,一般来说温度上升,反应速度加快。最佳反应温度是70℃,并且在80℃下短时间操作也是可行的,酶活性没有严重降低[43]。
大多数脂肪酶的最大活性pH值介于7和9之间,尽管它们可以从pH 4到pH 10具有催化活性[44-45]。无机酸(来自脱胶)、柠檬酸(来自脱臭)或残留的漂白土减少生物催化剂颗粒的内部pH,并影响酶的工作寿命。包含在油中的水(<0.2%)可以溶解炼油步骤[46]中使用的漂白土中残留的柠檬酸(用作螯合剂)或无机酸(硫酸和磷酸)。
水对于蛋白质和酶的三维结构是必不可少的,脂肪酶的活性也是必不可少的。在非水介质中,所需要的水量取决于脂肪酶的来源、酶载体和有机溶剂[47]。
反应速率受底物构象的影响,脂肪酶中的疏水性通道比支链烃结构更容易吸收烃链和芳环[48]。有关研究者发现,甘三酯链长度改变了Novozym 435在无溶剂反应介质中催化甘三酯乙醇解反应的速率[49]。饱和甘油三酯(2-MG)的形成受短链或中链饱和甘三酯的限制,并受长链甘三酯的限制。
产品积累会影响酶催化酯交换的反应速度。据报道,高浓度的非酯化脂肪酸可以作为酶抑制剂。此外,甘油已被确定为脂肪酶抑制剂。
4 结 论
结构脂质由于其巨大的研究潜力,这几年来一直都是研究的热点,也取得了很多成就。许多成果已经用于产品,但也存在着许多问题,比如,酶的成本昂贵,难以用于工业化生产,且即使是酶催化反应也不能做到完全反应,所得的反应物中还含有杂质,必须进行同样昂贵的分离纯化步骤。所以,找到低价格的酶来源是迫切待解决的问题,酶反应的精度和其他简单便宜的分离纯化方法也需要探究。此外,反应中还存在其他问题,例如酰基的转移,酰基转移影响最终产物的得率;吸附剂的问题,结构脂质反应中会产生水,水会影响酶的作用效率;反应中溶剂的存在对脂质交换反应也有巨大影响。同时除了工艺上的问题,原料也一直是炙手可热的研究方向,寻找新的脂质来源是亘古不变的话题。对于研究者来说,存在的问题就是研究的方向,尽管如今已经有了一套成熟的结构脂质研究体系,但还需要不断地完善和更新。
参考文献
[1] 刘燕萍,李宁.中链甘油三酯的代谢特点及临床应用研究[J].肠外与肠内营养,2001,8(1):108-110.
[2] H.T.Osborn,C.C.Akoh.Enzymatically Modified Beef Tallow as a Substitute for Cocoa Butter[J].Food Science,2002,67(7):2480-2485.
[3] Casimir C.Charment O.Moussata.Lipase-catalyzed modification of borage oil: Incorporation of capric and eicosapentaenoic acids to form structured lipids[J].Journal of the American Oil Chemists'Society,1998(75):697-701.
[4] Arab-Tehrany E,Jacquot M ,Gaiani C ,et al.Beneficial effects and oxidative stability of omega-3 long-chain polyunsaturated fatty acids[J].Trends in Food Science & Technology,2012,25(1):24-33.
[5] Véronique Gibon.Enzymatic interesterification of oils[J].Lipid Technology,2011,23(12):274-277.
[6] Ferreira,María Luján,Tonetto G M.[SpringerBriefs in Molecular Science]Enzymatic Synthesis of Structured Triglycerides ||[J].Springerbriefs in Molecular Science,2017;10.
[7] Saito S,Yamaguchi T,Shoji K,et al.Effect of low concentration of diacylglycerol on mildly postprandial hypertriglyceridemia[J].Atherosclerosis,2010(213):539-544.
[8] Deckere EAM,Verschuren PM.Functional fats and spreads.In:Gibson G,Williams Functional foods——concept to product[J].Woodhead Cambridge,2000:233–257.
[9]Hou CT. Handbook of industrial biocatalysis[M].Boca Raton:Taylor & Francis,2005.
[10] Auerbach MH,Chang PW,Kosmark R,et al.Salatrim: a family of reduced-calorie structured lipids[J].AOCS Champaign,1998:89-116.
[11] Wiley.Kirk-othmer food and feed technology[M].New York:Wiley-Interscience,2007.
[12] Havlicekova Z,Jesenak M,Banovcin P,et al.Beta-palmitate–a natural component of human milk in supplemental milk formulas[J].Nutrition Journal,2015,15(1):28.
[13] Breckenridge W C,Marai L,Kuksis A.Triglyceride structure of human milk fat[J].Canadian Journal of Biochemistry,1969,47(8):761-769.
[14] Jensen RG.Lipids in human milk[J].Lipids,1999(34):1243-1271.
[15] Bar-Yoseph F,Lifshitz Y,Cohen T.Review of sn-2 palmitate oil implications for infant health[J].Prostaglandins Leukot Essent Fatty Acids,2013(89):139-143.
[16] Vasudevan D M,Sreekumari S,Vaidyanathan K.Textbook of biochemistry for medical students[M].New Delhi:JP Medical Ltd,2013.
[17] Innis,S.M.Dietary Triacylglycerol Structure and Its Role in Infant Nutrition[J].Advances in Nutrition: An International Review Journal,2011,2(3):275-283.
[18] Kadivar S,De Clercq N,Davy V D W,et al.Optimisation of enzymatic synthesis of cocoa butter equivalent from high oleic sunflower oil[J].Journal of the Science of Food and Agriculture,2014,94(7):1325-1331.
[19] Smith KW.Structured triacylglycerols:Properties and processing for use in food[M].Woodhead, Cambridge,2015:207-218.
[20] Mohamed I. Enzymatic synthesis of cocoa butter equivalent from olive oil and palmitic-stearic fatty acid mixture[J].Applied Biochemistry and Biotechnology,2015(175):757-769.
[21] Zang X,Xie W.Enzymatic interesterification of soybean oil and methyl stearate blends using lipase immobilized on magnetic Fe3O4/SBA-15 composites as a biocatalyst[J].Journal Of Oleo Science,2014(63):1027-1034.
[22] Klonoff D.Replacements for trans fats—will there be an oil shortage[J].Diabetes Technology & Therapeutics,2007(1):415-422.
[23] Siti Hazirah Mohamad Fauzi.Effects of chemical interesterification on the physicochemical, microstructural and thermal properties of palm stearin, palm kernel oil and soybean oil blends[J].Food Chemistry,2013(137):8-17.
[24] Wei W,Feng Y,Zhang X,et al.Synthesis of structured lipid 1,3-dioleoyl- 2-palmitoylglycerol in both solvent and solvent-free system[J].LWT-Food Science and Technology,2015(60):1187-1194.
[25] Liu S,Dong X,Wei F,et al.Ultrasonic pretreatment in lipase-catalyzed synthesis of structured lipids with high 1,3-dioleoyl-2- palmitoylglycerol content[J].Ultrasonics Sonochemistry,2015(23):100-108.
[26] Wanga Y,Xia L,Xu X,et al.Lipase-catalyzed acidolysis of canola oil with caprylic acid to produce medium-, long- and medium-chain-type structured lipids[J]. Food and Bioproducts Processing,2012(90):707-712.
[27] Camacho Paez B,Robles Medina A,Camacho Rubio F, et al.Kinetics of lipase-catalysed interesterification of triolein and caprylic acid to produce structured lipids[J].Journal of Chemical Technology and Biotechnology,2003(78):461-470.
[28] Moghaddama MG,Yekke Ghasemi Z,Khajeha M, et al.Application of response surface methodology in enzymatic synthesis: a review [J].Russian Journal of Bioorganic Chemistry,2014,40(3):252-262.
[29] Tang W,Wang X,Huang J,et al.A novel method for the synthesis of symmetrical triacylglycerols by enzymatic transesterification[J].Bioresoure Technology,2015(196):559-565.
[30] Wang X,Zou W,Sun X,et al.Chemoenzymatic synthesis of 1,3-dioleoyl-2-palmitoylglycerol[J].Biotechnology Letters,2015(37):691-696.
[31] Halldorsson A,Magnusson CD,Haraldsson GG.Chemoenzymatic synthesis of structured triacylglycerols by highly regioselective acylation[J].Tetrahedron,2003(59):9101-9109.
[32] Magnusson CD,Haraldsson GG.Chemoenzymatic synthesis of symmetrically structured triacylglycerols possessing short-chain fatty acids[J].Tetrahedr,2010(66):2728-2731.
[33] Usai EM,Gualdi E,Solinas V,et al.Simultaneous enzymatic synthesis of FAME and triacetyl glycerol from triglycerides and methyl acetate[J].Bioresource Technology,2010,101(20):7745-7750.
[34] Akil E,Barea B,Finotelli P,et al.Accesing regio and typo selectivity of Yarrowia lipolytica lipase in its free form and immobilized onto magnetic nanoparticles[J].Biochemical Engineering Journal,2016(109):101-111.
[35] Meng X,Xu G,Zhou QL,et al.Highly efficient solvent-free synthesis of 1,3-diacylglycerols by lipase immobilised on nano-sized magnetite particles[J]. Food Chemistry,2014(143):319-324.
[36] Gupta S,Bhattacharya A,Murthy CN.Tune to immobilize lipases on polymer membranes: techniques, factors and prospects[J].Biocatalyst Agricultural Biotechnology,2013,2(3):171-190.
[37] Hwang ET,Gu MB.Enzyme stabilization by nano/microsized hybrid materials[J].Engineering in Life Sciences,2013,13(1):49-61.
[38] Rodrigues RC,Fernández-Lafuente R.Lipase from Rhizomucor miehei as a biocatalyst in fats and oils modification[J].Journal of Molecular Catalysis B-enzymatic,2010,66(1-2):15-32.
[39] Fernandez-Lafuente R.Lipase from thermomyces lanuginosus:uses and prospects as an industrial biocatalyst[J].Journal of Molecular Catalysis B-enzymatic,2010,62(3-4):197-212.
[40] Liese A,Hilterhaus L.Evaluation of immobilized enzymes for industrial applications[J].Chemical Society Reviews,2013(42):6236-6249.
[41] Hartmann M,Jung D.Biocatalysis with enzymes immobilized on mesoporous hosts:the status quo and future trends[J].Journal of Materials Chemistry,2010(20):844-857.
[42] Schafer De Martini Soares F,Osorio N,da Silva R,et al.Batch and continuous lipase-catalyzed interesterification of blends containing olive oil for trans-free margarines[J].European Journal of Lipid Science and Technology,2013(115):413-428.
[43] Cowan D,OxenbØll K,Holm H.Enzymatic bioprocessing of oils and fats[J].Information sciences,2008(4):210-212.
[44] Malcata F,Reyes H,Garcia H,et al.Kinetics and mechanisms of reactions catalysed by immobilized lipases[J].Enzyme and Microbial Technology,1992(14):426-446.
[45] Yamane T.Enzyme technology for the lipids industry: an engineering overview[J].Journal of the American Oil Chemists Society,1987(64):1657-1662.
[46] Yamada N,Matsuo N,Watanabe T,et al.Enzymatic production of diacylglycerol and its beneficial physiological functions[M]. Boca Raton:Handbook of industrial biocatalysis CRC,2005.
[47] Camacho Páez B,Robles Medina A,Camacho Rubio F, et al.Modeling the effect of free water on enzyme activity in immobilized lipase-catalyzed reactions in organic solvents[J].Enzyme and Microbial Technology,2003(33):845-853.
[48] Miller C,Austin H,Porsorske L,et al.Characteristics of an immobilized lipase for the commercial synthesis of esters[J].Journal of the American Oil Chemists Society,1988(65):927-935.
[49] Sanchez D,Tonetto G,Ferreira M.An insight on acyl migration in solvent-free ethanolysis of model triglycerides using Novozym 435[J].Biotechnology,2016(220):92-99.
收稿日期:2019-12-18
基金項目:“十三五”国家重点研发计划重点专项(2016YFD0400206);江苏省高校优势学科建设工程资助项目(PAPD);江苏省研究生科研创新项目(KYCX18_1401);江苏省研究生科研创新项目 (KYCX18_1425)。
作者简介:吴进,男,硕士,研究方向为功能性食品开发。
通讯作者:鞠兴荣,男,博士,教授,研究方向为食品营养,功能食品及农产品深加工。
Research Progress on the New Member of Lipid Family——Structural Lipids
Wu Jin,Dong Xue,Ji Shengyang,Wu Ying,Xu Feiran,Ju Xingrong
College of Food Science and Engineering, Nanjing University of Finance and Economics/Jiangsu Modern Grain Circulation and Safety Collaborative,Nanjing,Jiangsu 210000)
Abstract:This paper mainly introduces the definition, application, preparation method of structured lipids and the factors restricting their industrial production. After years of research, structured lipids have a set of mature systems, and also have many functional applications in the market, mainly including medium and long chain fatty acid structured lipids, low calorie structured lipids, human milk instead of fat and cocoa butter and other functional fat substitutes. The synthesis of structured triglycerides requires the participation of enzyme catalyst, so the catalytic reaction can be divided into chemical catalysis and enzyme catalysis. According to the reaction steps, it can be divided into one-step catalytic reaction, two-step catalytic reaction and multi-step catalytic reaction. Even though the research methods of structured lipids are relatively mature, there are still a few used in industrial production, the main limiting factor is cost, and the most important is enzyme, so the subject of structured lipids needs further research and exploration.
Key Words:structural lipid,lipase,chemical catalysis,functional application

