药用植物灯盏花种子储存条件及萌发特性研究
赵陆滟 李唯奇 王丹丹







摘要: 該文以云南春季野外采收灯盏花种子为材料,研究了不同储存湿度、储存温度、储存时间及不同光照、温度、吸胀条件等对其萌发率的影响。结果表明:(1)降低储存湿度(15%RH)和储存温度(-20、4 ℃)有利于种子保存,种子寿命可延长2 a多,萌发率在80%以上;高温(35、45 ℃)和高湿(60% RH)加快了种子衰老,不利于保存,种子为短命种子。(2)光照与否对种子萌发率无显著影响,为光中性种子,但光照有利于种子萌发后幼苗的形成。(3)25 ℃为该种子萌发的最适宜温度,萌发率可达84.37%。(4)生产上播种时,尽量避免低温(4 ℃)和高温(30、35 ℃),有利于提高出苗率。(5)该种子对吸胀冷害不敏感,为抗冷型种子。因此,在种子研究和药材生产上,成熟种子采收后应及时干燥并密封存于低温下,来年春季及早播种;在育苗生产上,应提供适宜的光照条件,设置单独的恒温(25 ℃)育苗间,并避免低温季播种。通过研究灯盏花种子的适宜储存条件和萌发特性,为该珍稀药用物种的合理储存和高产栽培提供有效指导。
关键词: 灯盏花, 种子, 储存条件, 萌发特性, 萌发率, 短命种子
中图分类号: Q945.34文献标识码: A文章编号: 1000-3142(2019)12-1636-12
Abstract: Seeds of Erigeron breviscapus collected from Yunnan in spring were used as the test materials, the effects of storage humidity, storage temperature, storage duration and illumination, temperature, imbibitional condition on seed germination rate were studied. The results were as follows: (1) Reducing the storage humidity (15%RH) and the storage temperature (-20, 4 ℃) of the seeds was beneficial to the seed preservation, which could prolong the seed life to more than two years, and the germination rate could reach more than 80%; High temperatures (35, 45 ℃) and high humidity (60% RH) accelerated the aging of seeds, which was not conducive to preservation, so the seeds were short-lived seed. (2) There was no significance of germination rate in either light or dark, so the seeds were light-neutral, but light was beneficial to the seedling formation after seed germination. (3) The optimum temperature for the seed germination was 25 ℃, and the germination rate was 84.37%. (4) The low temperature (4 ℃) and high temperatures (30, 35 ℃) must be avoided for seed germination in production, which was beneficial to increase the emergence rate. (5) The seeds were insensitive to imbibitional damage, so the seeds were cold-resistant. Therefore, in seed research and production of medicinal materials, mature seeds should be dried and sealed in low temperature immediately after harvest, and sown early in spring; In seedling production, suitable lighting condition is necessary, a separate constant temperature (25 ℃) culture room should be set, and cold season sowing should also be avoided. This paper studying the suitable storage conditions and germination characteristics for the seeds of E. breviscapus, will provide effective guidance for the reasonable storage of the rare medicinal species and high yield planting in future studies.
Key words: Erigeron breviscapus, seed, storage conditions, germination characteristics, germination rate, short-lived seed
灯盏花(Erigeron breviscapus),又名灯盏细辛、短葶飞蓬,为菊科飞蓬属多年生植物,在云南、四川、贵州、广西、湖南及西藏等省(区)都有分布,是民族、民间常用中草药(赵峥等,2013)。灯盏花首载于《滇南本草》《中国药典》1977年版一部曾予以收载(马宇辉等,2004)。药物化学研究结果表明,灯盏花含有黄酮、植物甾醇、挥发油、焦性儿茶酚、氨基酸及微量元素等多种成分(刘宏等,2002)。其产品主要有浸膏、胶囊、针剂、片剂、冲剂及口服液等(赵猛等,2018)。其性寒、微苦、甘温辛,具有微寒解毒、祛风除湿、活血化瘀、通经活络、消炎止痛的功效。目前灯盏花注射液在临床上除主要用于心脑血管系统疾病外,在糖尿病、肾病、颈性眩晕、老年性疾病的治疗上也有较好的疗效(张俐等,2012)。灯盏花主要用于治疗的心血管类疾病是世界第四大疾病,该类药在国内处于中西医各占一半的状况,其市场需求以每年15%~20%的比例持续增加(张薇等,2013)。近年来对灯盏花原分布区进行资源调查时,已难见到成片分布的种群,野生分布频度已接近稀少和枯竭(熊勇等,2012)。随着市场需求的逐渐增加,野生优质种源已成为灯盏花药业发展的瓶颈。
灯盏花在生产上主要以种子繁殖为主,自然条件下其种子发芽率保持时间为3~5个月。常温下贮存其种子活力随贮存时间而降低,平均寿命约为6个月(李鹂等,2005)。给种质资源研究和药材生产带来很大困难。如果能对该物种进行长期储存,不仅可以高效率、低成本地保存灯盏花的种质资源,而且还可以给药材生产提供优质的灯盏花种子。由于种子储存寿命是由储存温度和储存湿度两个重要因素决定的。因此,测定种子的最佳储存温度和湿度,是该物种有效储存的关键。
种子能否萌发和产生正常幼苗,受外界生态条件如水分、温度、氧气、光照等条件的综合影响,但充足水分、适宜温度和足够氧气是种子萌发不可缺少的;某些种子萌发时,光也是一个必要因素(禹晓梅,2012)。本文主要探讨了光照、温度、吸胀处理对灯盏花种子萌发的影响。种子萌发可分为四个阶段,即吸胀、萌动、发芽、成苗阶段。吸胀为种子萌发的第一阶段,很多栽培植物种子在低温下快速吸水会遭受吸胀冷害,不只是在高寒和低温冷湿地区,在干旱地区早春灌溉播种时也同样发生,敏感性种子更为突出。吸胀冷害是由低温与快速吸水共同作用所产生的傷害,轻者影响成苗率,重者使种子失去活力,造成大面积缺苗,造成严重经济损失(禹晓梅,2012)。因此,确定灯盏花种子的需光特性,最佳萌发温度及种子是否存在吸胀冷害对灯盏花的生产具有重要的指导作用。
近年来,关于灯盏花栽培、组培、药理、提取等方面已经有较多的研究(张俐等,2012;林丽飞等,2009;柯细彤等,2017;赵猛等,2018),但种子方面的研究报道较少(李鹂等,2005;曹琦等,2012;林丽飞等,2008),对其种子的储存条件、需光特性、最佳萌发温度以及吸胀冷害特性等未进行系统研究。这些研究内容不仅具有重要的理论意义,同时对灯盏花的生产具有重要的指导作用。
1材料与方法
1.1 材料
选用2015年5月采自云南大理的野生成熟灯盏花种子为研究材料,种子保存于中国科学院昆明植物研究所西南野生生物种质资源库双十五(15% Relative Humidity-RH, 15 ℃)种子干燥间,经手工揉搓去掉冠毛,再使用种子重力分离机(Selecta Gravity Separator ZigZag-1, Machinefabriek BV Enkhuizen, Holland)去除杂质和冠毛,挑选籽粒饱满、无病虫害、无破损的优质种子用于实验。
1.2 种子形态观察和质量检验
从清理干净的种子中取部分样品,使用解剖镜观察并进行拍照。通过观察种子形态特征,判断种子饱满度,测量种子长度和宽度,确定种子大小。确定实验所用种子为饱满无破损和未经虫食的种子。取部分测量种子千粒重(曹琦等,2012),并检测种子初始萌发率:种子经表面消毒后,点到MS培养基中,每皿种子为36~40粒,6个重复,培养皿用封口膜封好,放置于25 ℃恒温步入式培养间进行萌发。光照萌发条件:光照强度为15 μmol·m-2·s-1、昼/夜光周期为12 h/12 h,记录一个月后种子的萌发总数,计算种子萌发率(曹琦等,2012),以下检测萌发率方法以此同。
1.3 种子最佳储存条件的确定
1.3.1 低湿下不同温度储存处理种子存放于双十五种子干燥间,用放置于恒温房间(15 ℃)的密闭台式水分活度仪(Hygrolab3-set40, Rotronic, Switzerland)进行测量,当湿度达到15%时,将种子分装于30 mL装有硅胶袋(硅胶袋先在15%相对空气湿度中平衡)的小密封瓶里,再将种子分装于5个1 L密封罐中,分别于-20、4、25、35、45 ℃条件下贮藏,储存时检测的萌发率设为对照(CK)、-20、4、25 ℃储存30个月,每3个月检测一次萌发率,-20 ℃小密封瓶的种子萌发实验前一天需拿出到双十五种子干燥间回温;35、45 ℃储存21周,分别于2、5、8、13、21周检测萌发率。
1.3.2 高湿下不同温度储存处理在20 ℃条件下,用30%无水氯化锂溶液平衡湿度(Hay et al.,2008),使用密闭台式水分活度仪进行测量,当种子与周围湿度平衡达到60%时,将种子进行分装,分别于-20、4、20、35、45 ℃恒温下储存,储存时检测的萌发率设为CK,-20、4、20 ℃储存24周,分别于1~6、12、16、20、24周检测萌发率,-20 ℃小密封瓶的种子萌发实验前一天需拿出到双十五种子干燥间回温;35、45 ℃储存12周,每1周检测一次萌发率。
1.4 种子萌发需光特性的确定
设置光照条件为昼/夜光周期12 h/12 h和24 h全黑暗两个处理,全黑暗处理条件下将点种后的培养皿包上锡箔纸并装进密封纸盒中放置于昼/夜光周期12 h/12 h下,检测萌发率。
1.5 不同基质上种子萌发最适温度的确定
1.5.1 MS培养基上不同温度梯度处理设置10、15、20、25、30、35 ℃六个温度处理,把种子点到MS培养基上,每皿36粒,每个温度6皿,分别在六个温度暖白色荧光(光照强度15 μmol·m-2·s-1,昼/夜光周期为12 h/12 h)的条件下进行萌发。
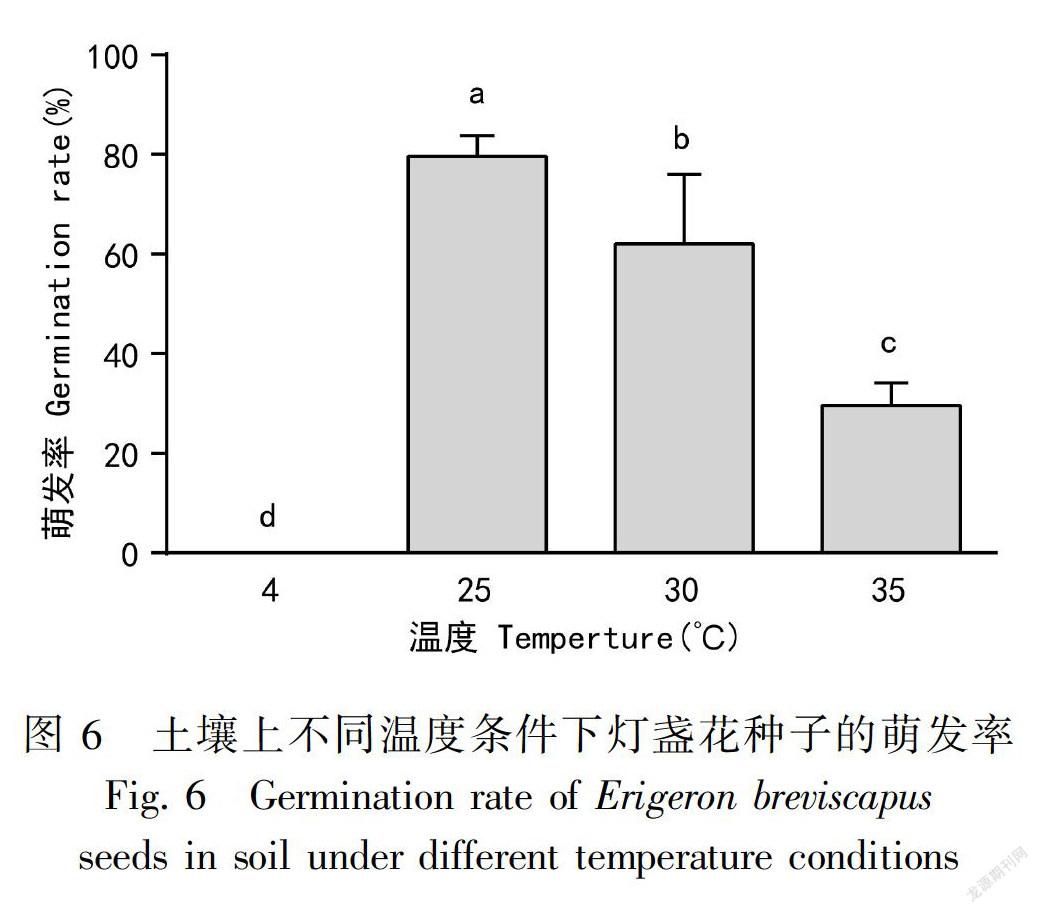
1.5.2 土壤上不同温度处理设置4、25、30、35 ℃四个温度处理,把种子点到腐殖土∶红土=1∶1的土壤中,每盆36粒,每个温度点6盆,分别在四个温度暖白色荧光的条件下进行萌发。
1.6 种子吸胀冷害的确定
种子分别经表面消毒后进行四种吸胀处理(禹晓梅,2012),各处理取36~40粒,6个重复,(1)温浸:放到无菌的1.5 mL离心管中,在25 ℃的去离子水中浸泡;(2)冷浸:放到无菌的1.5 mL离心管中,在4 ℃的去离子水中浸泡;(3)温湿吸胀:在25 ℃ 1%的琼脂培养基上吸胀;(4)冷湿吸胀:在4 ℃ 1%的琼脂培养基上吸胀。四个处理吸胀24 h后再置于MS培养基上,在25 ℃暖白色荧光的条件下进行萌发。
1.7 种子表面消毒
种子表面消毒方法(禹晓梅,2012):将种子放到1.5 mL离心管中,加入1 mL 75%(v/v)的乙醇,涡旋仪上涡旋4 min,离心弃上清液;加入1 mL 5%(v/v)的次氯酸钠溶液,涡旋仪上涡旋4 min,离心弃上清液;加1 mL無菌水,涡旋洗涤2 min,离心弃上清液;无菌水反复漂洗种子3次,最后在离心管中加入1 mL无菌水。
1.8 MS培养基配制
MS培养基配制参照Murashige et al.(1962)的方法。大量元素母液(40X,25 mL·L-1,40倍的母液,每升培养基加25 mL母液):MgSO4(7.22 g·L-1,每升培养基加7.22g MgSO4)、NH4NO3(66 g·L-1)、KH2PO4(6.8 g·L-1)、KNO3(76 g·L-1)、CaCl2(13.29 g·L-1)。微量元素母液(200X、5 mL·L-1):MnSO4·H2O(3.380 4 g·L-1)、ZnSO4·7H2O(1.72 g·L-1)、H3BO3(1.24 g·L-1)、KI(0.166 g·L-1)、Na2MoO4·2H2O(0.05 g·L-1)、CuSO4·5H2O(0.005 g·L-1)、CoCl2·6H2O(0.005 g·L-1)。铁盐母液(100X、10 mL·L-1):Na2-EDTA·2H2O(3.725 g·L-1)、FeSO4·7H2O(2.78 g·L-1)。有机元素母液(200X、5 mL·L-1):烟酸(0.1 g·L-1)、硫胺素(0.02 g·L-1)、吡哆素(0.1 g·L-1)、甘氨酸(0.4 g·L-1);肌醇母液(100X、10 mL·L-1):肌醇(10 g·L-1)。所有母液混合后,加入蔗糖(30 g·L-1),先用去离子水定容,再调pH至5.85,最后加植物凝胶(3.5 g·L-1)。放到灭菌锅中高温高压灭菌,灭菌条件:121 ℃,260 kPa,25 min。
1.9 相对湿度检测和萌发率计算
使用放置于恒温(15 ℃)房间的密闭台式水分活度仪检测种子储存时的相对湿度(陈虹颖等,2011)。
种子萌发率(germination rate, GR)(曹琦等,2012)是用来检测种子活力的一个常用指标。种子的新鲜胚根伸出种皮视为已发芽,发芽开始后,每天记录萌发的正常幼苗数直至无萌发种子出现为止。计算公式如下:
萌发率GR = (n/N)×100%
式中:n为最终达到的正常发芽粒数;N为供试种子数。
1.10 数据分析
先采用Q校验去除异常值,再用SPSS 17.0数据分析软件和T校验进行数据显著性分析,最后利用GraphPad Prism 5.0、Adobe Photoshop CS6作图软件进行作图。
2结果与分析
2.1 种子形态及品质
瘦果狭长圆形,长1.5~2.0 mm,扁压,背面常具1肋,全身被细小种毛,顶端有白色冠毛,刚毛状。成熟种子饱满,具有清亮光泽(图1)。千粒重达0.2 g,初始萌发率为90.71%。
2.2 储存湿度和温度对种子萌发率的影响
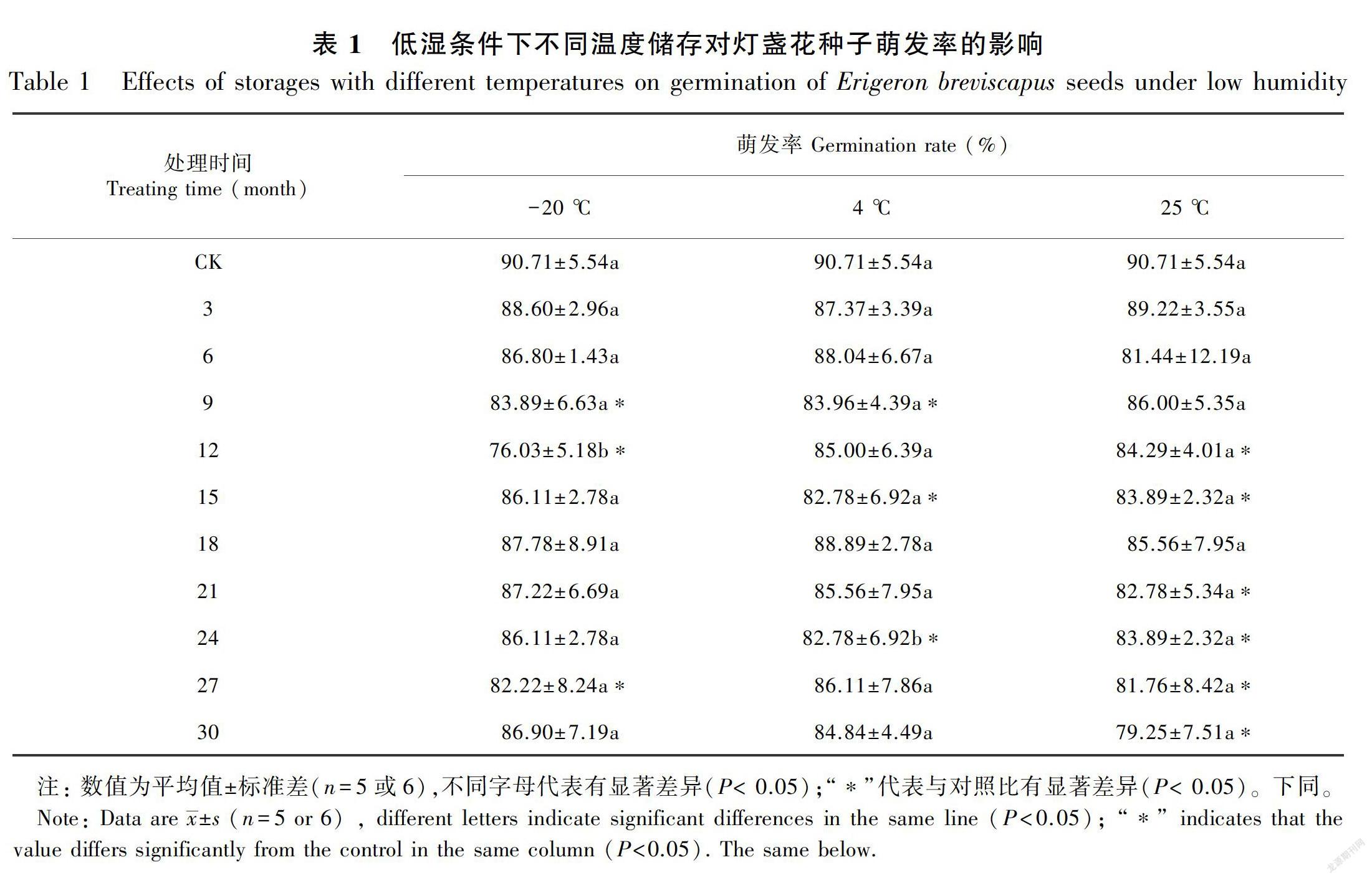
2.2.1 在低湿下不同储存温度对种子萌发率的影响在低湿(15%RH)条件、-20 ℃下储存3、6、15、18、21、24、30个月内萌发率与对照无显著差异,但9、12、27个月有显著差异;4 ℃下储存,3、6、12、18、21、27、30个月内萌发率与对照无显著差异,但9、15、24个月内萌发率与对照存在显著差异;25 ℃下储存,3、6、9、18个月内萌发率与对照无显著差异,但12、15、21、24、27、30个月内萌发率与对照存在显著差异。总体看来,储存30个月内,不同温度间萌发率基本无显著差异,-20、4 ℃与对照在多数储存时段无显著差异,而25 ℃在多数时段显著低于对照(CK),储存30个月后,-20、4 ℃的萌发率分别达86.90%、84.84%,而25 ℃仅有79.25%。这表明低温(-20、4 ℃)和低湿(15%RH)有利于延长储存的寿命(表1)。如果在室温下储存种子不超过两年,可低湿(15%RH)密封储存,降低生产成本,延长种子生活力。
在低湿(15%RH)条件下,35 ℃储存2~21周,45 ℃储存2~13周,萌发率与对照均无显著差异,但45 ℃储存21周后萌发率与对照存在显著差异。总体看来,在储存的21周内,除45 ℃储存21周显著低于对照外,35 ℃和45 ℃其他储存时段与对照均无显著差异,35、45 ℃储存21周后萌发率分别为75.46%、68.98%(表2)。结果表明, 高温(35、45 ℃)、低湿(15%RH)条件下短期内储存,种子的萌发率无显著下降,但随着储存时间的继续延长,萌发率会出现缓慢的下降,储存温度越高,下降越快。
2.2.2 高湿下不同温度对种子萌发率的影响在高湿条件(60%RH)、-20 ℃下储存1、2、5周,萌发率与对照有显著差异,但2、3、4、6、12、16、20、24周无显著差异;4 ℃下储存1、4、5、6、12、16、20、24周,萌发率与对照有显著差异,2、3周则无显著差异;20 ℃下储存,1、3、4、5、6、12、16、20、24周内萌发率与对照有显著差异,但在2周时无显著差异。总体来看,储存24周内,不同温度萌发率下降出现在储存的第1周,-20 ℃在储存的3至24周内种子萌发率与对照基本无显著差异,4、20 ℃在贮藏的24周内萌发率下降显著快于-20 ℃,-20、4、20 ℃储存24周后的萌发率分别为76.39%、66.27%、62.96%。说明低温(-20 ℃)、高湿(60% RH)条件下短期储存,种子萌发率无显著变化,随着储存时间的延长,萌发率逐渐下降,且4、20 ℃萌发率下降显著快于-20 ℃(表3)。因此,高湿(60% RH)不利于储存,如果条件限制,在高湿(60% RH)时短期储存,可密封储存于-20 ℃低温下。
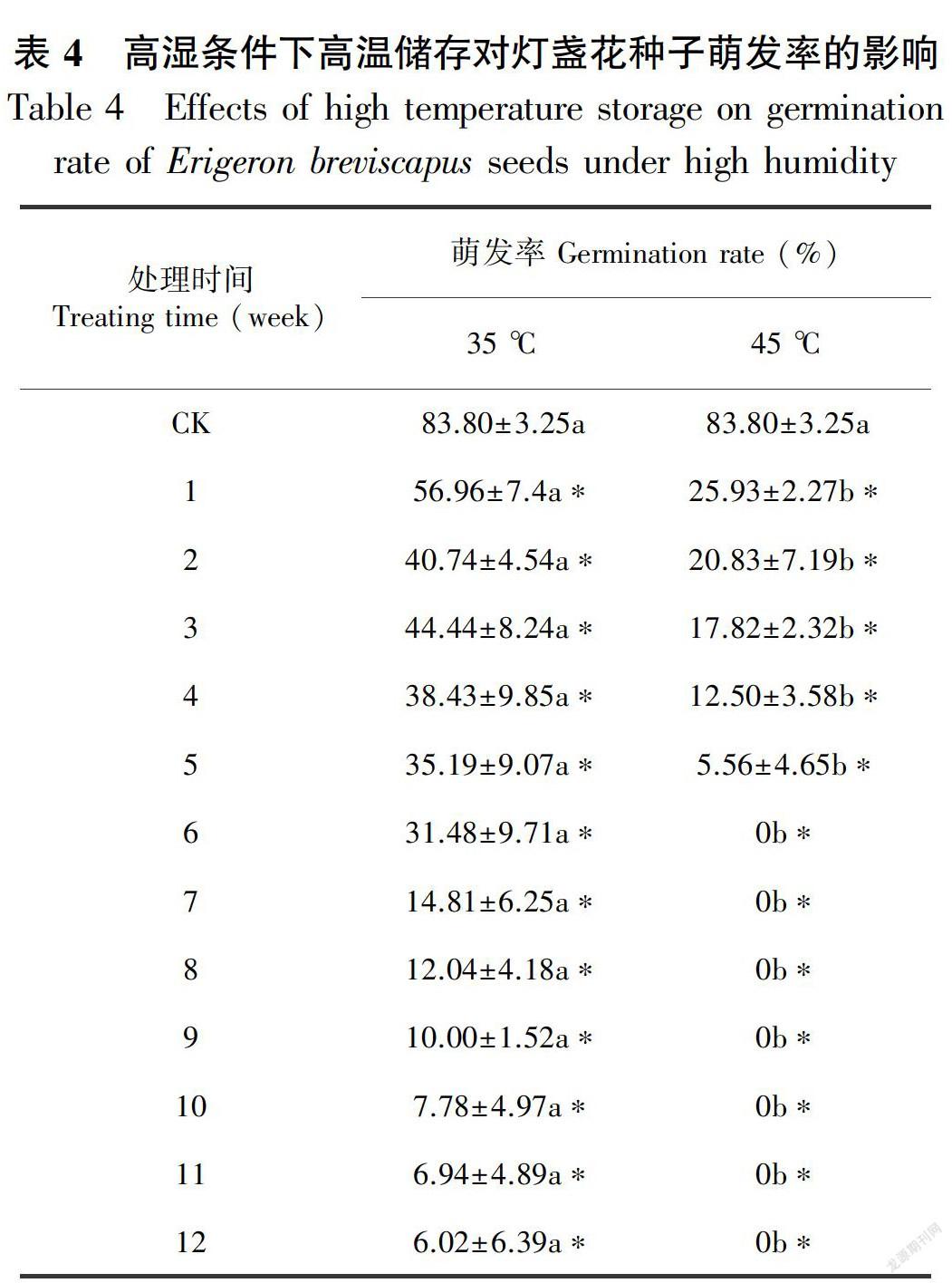
在高湿(60% RH)条件下,35、45 ℃储存的12周内萌发率与对照均有显著差异,随着储存时间的延长,萌发率均显著下降。35 ℃贮藏12周后萌发率从83.8%降到6.02%,45 ℃储存6周后从83.8%降到0(表4)。总体来看,在储存的12周内,差异,不同字母代表有显著差异(P<0.05)。下同。
35、45 ℃储存1周后,萌发率开始下降,45 ℃储存萌发率下降显著快于35 ℃。
2.3 光照对种子萌发率的影响
光照条件下萌发率为84.37%,黑暗条件下为81.48%。光照与否对种子萌发率无显著影响,种子为光中性种子(图2,图3)。从图3可以看出,黑暗条件下萌发后幼苗黄化、瘦弱。因此,在种子萌发过程中应提供适宜光照以利于幼苗生长发育。
2.4 不同萌发基质上不同温度对种子萌发率的影响
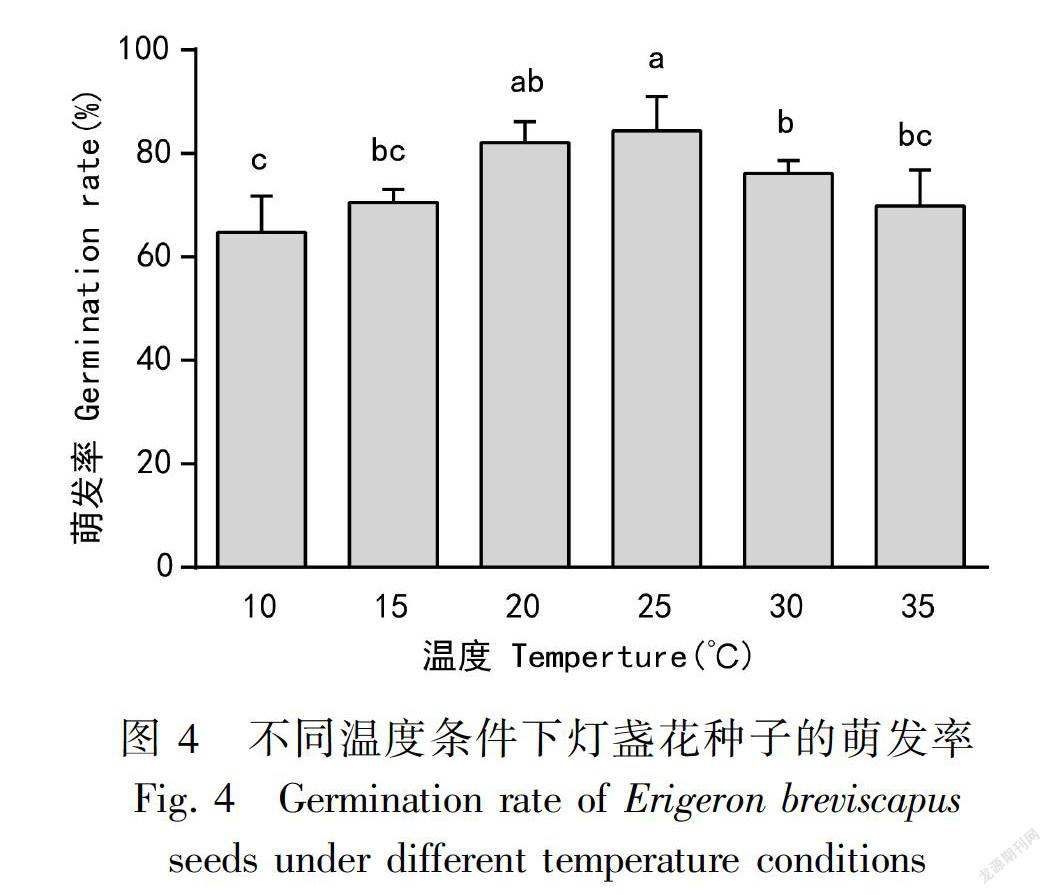
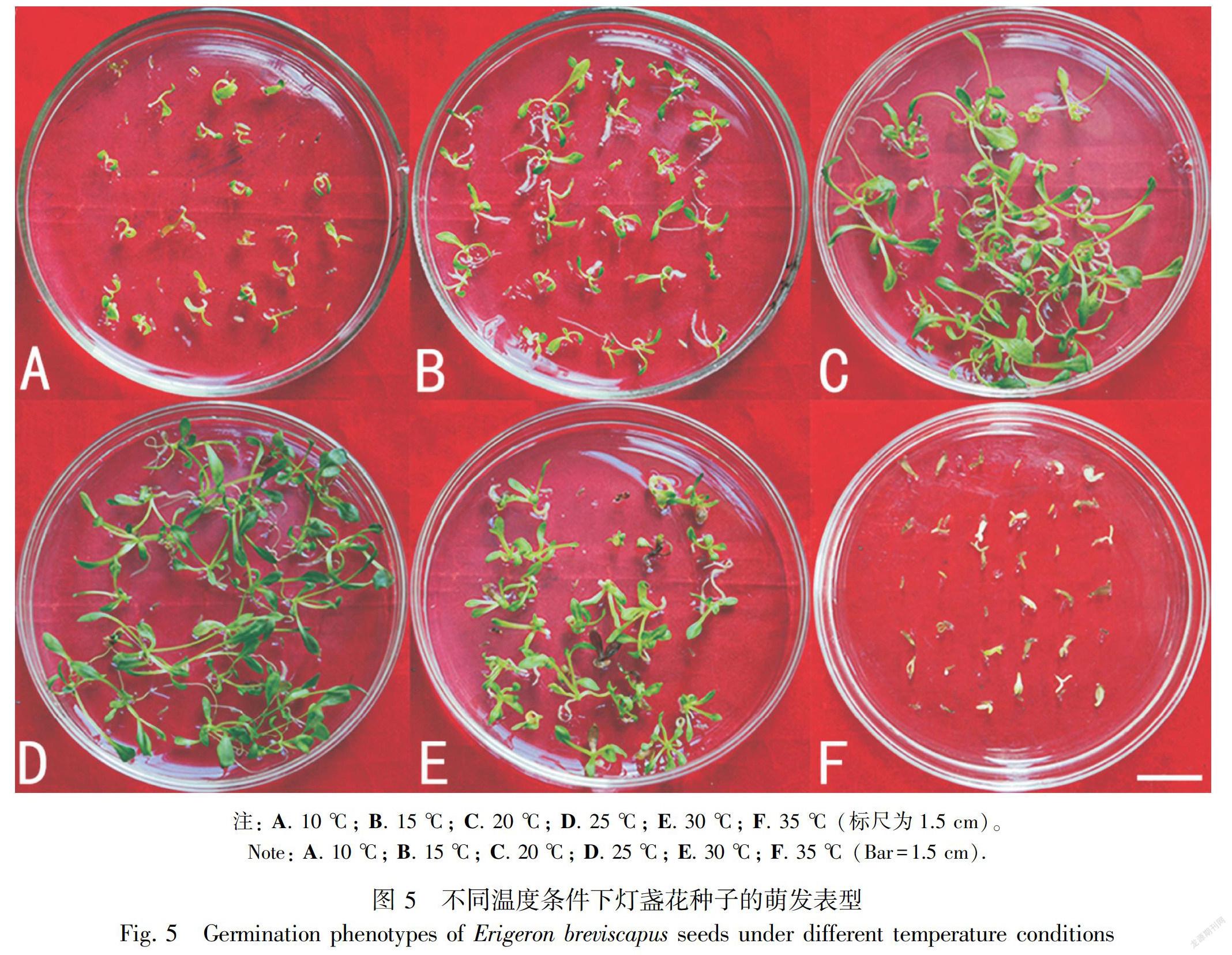
2.4.1 MS培养基上不同温度对种子萌发率的影响10、15、20、25、30、35 ℃条件下种子的萌发率分别为64.81%、70.56%、82.11%、84.37%、76.11%、69.91%。25 ℃时的萌发率显著高于10、15、30、35 ℃,虽然与20 ℃时的萌发率无显著差异(图4),但幼苗较20 ℃整齐粗壮(图5),说明,25 ℃为萌发最适温度。
2.4.2 土壤上不同温度对种子萌发率的影响4 ℃低温下的种子萌发率为0,25 ℃为79.44%,30、35 ℃高温分别为58.33%、31.11%。结果表明,低温(4 ℃)、高温(30、35 ℃)条件下萌发率均显著低于25 ℃,且35 ℃的萌发率显著低于30 ℃,4 ℃显著低于35 ℃(图6)。由图7可知,35 ℃条件下种子萌发一个月后,幼苗基本死亡,说明35 ℃高温不仅影响种子的萌发,还影响种子萌发后幼苗的成活。因此,25 ℃为土壤播种最适萌发温度。
为验证土壤上4 ℃低温、高湿(80%~90% RH)条件下放置一个月后未萌发的种子是否还具有生活力,把4 ℃下放置一个月后的种子再回放到25 ℃下继续萌发,统计一个月后萌发率,萌发率为77.78%。结果表明,4 ℃下放置一个月后的种子再回放到25 ℃下的萌发率显著高于4 ℃下放置一个月后的萌发率,而由图6和图7可知,4 ℃下放置一个月后的种子再回放到25 ℃时的萌发率与25 ℃常温条件下的萌发率比较无显著差异,因此,一个月的低温、高湿条件虽然抑制了种子的萌发,延长了种子的萌发时间,但并未对种子造成伤害,放到室温后种子又能正常萌发和形成正常幼苗(图8,图9)。
2.5 不同吸胀处理对灯盏花种子萌发率的影响
4 ℃下,冷浸和冷湿吸胀24 h后萌发率分别为86.57%、87.22%;25 ℃下,温浸和温湿吸胀24 h后萌发率分别为88.42%、85.56%;快速吸胀(温浸、冷浸)24 h后,4 ℃和25 ℃的萌发率分别为86.57%、88.42%;慢速吸胀(温湿吸胀、冷湿吸胀)24 h后,4 ℃和25 ℃的萌发率分别为87.22%、85.56%。注: A. 10 ℃; B. 15 ℃; C. 20 ℃; D. 25 ℃; E. 30 ℃; F. 35 ℃ (标尺为1.5 cm)。
Note: A. 10 ℃; B. 15 ℃; C. 20 ℃; D. 25 ℃; E. 30 ℃; F. 35 ℃ (Bar=1.5 cm).
4种吸胀处理间萌发率无显著差异(图10,图11)。因此,灯盏花种子不存在吸胀冷害,种子萌发初期对吸水温度和吸胀速度不敏感,故为抗冷型种子。
3 讨论与结论
对种子储存的研究,在种子保藏库中,15%相对湿度是种子储存的最佳条件(Smith et al.,1992)。目前,45 ℃和60% RH是用于研究种子老化的标准环境(Hay et al.,2008)。本研究结果显示,灯盏花种子在低湿条件下,总体耐储存,-20、4 ℃贮藏最佳,原因可能是低温下,种子呼吸作用变弱,种子内储存物质消耗的速率变慢,利于种子生活力的保持,而低湿下,种子代谢速率比高湿下低,膜完整性以及各种酶的活性都得到了较好的保存,最大限度地保持了种子寿命;种子在高湿下,总体不耐储存,45 ℃时萌发率下降最快,原因可能是高温下,种子呼吸作用变强,种子内储存物质消耗的速率变快,加快了种子的衰老,随着种子含水量的增加,电解质的渗透加强,超氧化物歧化酶(SOD)、过氧化氢酶(CAT)等一系列抗氧化酶的活性下降,种子应对氧胁迫的能力减弱,种子寿命缩短。在自然条件下,灯盏花种子采收后室温储存,种子不耐储存的原因可能是采收后未经干燥处理或储存不当。因此,在种子研究上,种子采收后应及时存放双十五干燥间,干燥后经去杂处理存于密封罐中低温储存。在生产上,考虑到储存条件的限制,应选择晴天采收成熟种子,采收后及时晾干存于密封袋中低溫储存,保证来年生产上高质量的种源,避免雨天采种,采后避免存放于温热潮湿的环境中,造成生活力下降,优质种源受损。
种子寿命是从种子完全成熟到丧失生活力为止所经历的时间(申丽霞等,2004)。种子寿命的一般概念是指从种子采收到萌发率下降到50%所经历的时间,即种子的平均寿命,也称半活期,农业生产上种子寿命的概念是指在一定条件下种子萌发率能在80%以上的期限(孙长生等,2016)。依据种子寿命的长短,可将种子分为短命种子、中命种子和长命种子3大类,短命种子的寿命一般在3 a以内,寿命在3~15 a的属中命种子,也称常命种子,15 a以上的为长命种子(申丽霞等,2004)。在目前报道的短命种子中,山豆根(Sophora tonkinensis)种子其寿命按一般标准为6个多月,按农业生产标准则为3个月,5 ℃的低温储存环境能延长寿命3个月(孙长生等,2016);华北驼绒藜(Krascheninnikovia ceratoides)种子野外储存一年种子活力降低至4%,高温、高湿显著影响种子活力,而低温、低湿储存显著延长种子的活力(何青山,2015);蒙古柳(Salix linearistipularis)种子常温下贮存45 d左右萌发率为3%,在80 ℃冷藏的种子1 a后仍有50%的发芽率(钱璐,2015)。据以上文献报道可知,短命种子在室温和自然条件下不耐储存,种子的寿命一般在3 a以内,低温或干藏能显著提高短命种子的寿命。灯盏花种子在室温下储存寿命较短,6个月后种子萌发率为53.3%,12个月后种子的萌发率仅为17.7%,4 ℃低温储存能显著延长其寿命至1 a多(李鹂等,2005)。在本研究中,低温、低湿储存环境能显著延长其寿命至2 a多,而高温、高湿存放一周后萌发率就出现显著下降。综上所述,可推测灯盏花种子为短命种子。已有研究表明,灯盏花种子休眠特性不明显(李鹂等,2005)。因此,在灯盏花实际育苗生产中,有条件的地方,最好随采随播,没条件的地方,应晾干后密封储存于-20 ℃或4 ℃的低温环境中,或者存于种子干燥箱中经干燥处理后低温密封储存,来年春季应及早播种。
光照对某些植物种子的萌发是必不可少的,不同植物的种子萌发对光照的要求也不同(韦春强等,2012)。本研究结果显示,灯盏花种子无论在光照还是黑暗中都能萌发,但光照更有利于种子萌发后幼苗的形成,且萌发率相对较高。灯盏花为阳生植物,其种子萌发的需光性可能是一种适应环境和充分利用环境的适应性策略。可利用灯盏花种子的需光特性,在生產上,选择光照充足的山坡草地种植,避免林荫下种植;播种土层不宜过深,播后覆盖一层薄薄的细土,有利于种子萌发和壮苗的形成。
适宜的温度促进种子的吸水速度,加强酶促过程和呼吸作用、加速转化储藏物为可供利用的可溶性状态(张德楠等,2013),进而促进种子萌发和幼苗生长;温度过高或过低均对种子的萌发产生显著影响(汪建军等,2016; 李东霞等,2019)。通过本实验发现灯盏花种子萌发的适宜温度为25 ℃,该结果与李鹏等(2005)的研究结果一致。同时还发现,在20~35 ℃内,温度的升高有利于灯盏花种子的提前萌发,这可能是灯盏花的生存策略之一。当温度降低时,延长萌发时间,以度过不良环境,当温度升高,灯盏花则缩短萌发时间,抢占有利因素。因此把4 ℃低温、高湿下放置一个月后萌发率为0的种子再转移到25 ℃后并未影响种子的正常萌发和幼苗的形成。在生产上,为了获得整齐、健壮的小苗,应该设置单独的恒温(25 ℃)育苗间。
种子吸胀冷害是种子在低温下的吸胀损伤(郑光华等,2001)。吸水速度和温度是吸胀冷害发生与否的两个重要因素(陶宗娅等,2000)。本研究结果显示,灯盏花种子不存在吸胀冷害。原因可能跟种子吸胀前的基础含水量有关,种子含水量越低吸胀冷害越严重(陶宗娅等,2000),说明灯盏花种子的含水量可能在吸胀冷害的安全范围内;也可能是因为种子在低温过程中,同时存在生物膜的物理修补过程和生化修补过程,“双修补”的完善度较好,而且细胞具有“封存”的持久效应(郑光华等,2001)。虽然灯盏花种子不存在吸胀冷害,但在灯盏花的大田生产中,播种应避免低温季,提高种植产量。
灯盏花作为一种市场需求量非常大的中草药,近年随着人工种植的逐年增加,急需大量优质种源和种苗来满足生产需求。本研究采用种子分离机技术和解剖镜观察法,降低了种子的空瘪率,节省了储存空间,减小了实验的误差,为生产提供了优质的种子。本研究通过对储存条件和萌发特性的系统研究,解决了灯盏花种子不耐储存的难题,为科研和生产提供了经济高效的储存方案,通过本研究的储存方法,可将灯盏花种子储存2 a多,萌发率仍在80%以上,该研究中可推测灯盏花种子为短命种子,这一推测为上述研究提供了一个新的证据,对于菊科种子的进一步研究具有重要的意义,此推测也可为进一步研究该物种种子提供一个新的线索;而种子最佳萌发条件的确定,为生产上播种和育苗提供了有效的指导,为灯盏花优质高产奠定了良好基础。
参考文献:
CAO Q, WANG KL, SUN WB, 2012. Study on seed quality grading standards of Erigeron breviscapus (Vant.) Hand.Mazz. [J]. Seed, 31(1): 107-109. [曹琦, 王慷林, 孙卫邦, 2012. 灯盏花种子质量分级标准研究 [J]. 种子, 31(1): 107-109.]
CHEN HY, SUN WB, LI WQ, 2011. Seed storage behavior of Formanodendron doichangensis (Fagaceae), a rare and endangered plant [J]. Plant Divers Res, 33(5): 540-546. [陈虹颖, 孙卫邦, 李唯奇, 2011. 珍稀濒危植物三棱栎种子的储藏特性鉴定 [J]. 植物分类与资源学报, 33(5): 540-546.]
HAY FR, ADAMS J, MANGER K, et al., 2008. The use of nonsaturated lithium chloride solutions for experimental control of seed water content [J]. Seed Sci Technol, 36(36): 737-746.
HE QS, 2015. Responses of seed germination and seedling growth of Krascheninnikovia arborescens to environmental factors [D]. Zhengzhou: Henan Agricultural University. [何青山, 2015. 華北驼绒藜种子萌发及幼苗生长对环境因子的响应 [D]. 郑州:河南农业大学.]
KE XT, ZHANG YF, ZHU ZY, et al., 2017. Research progress of prevention and cue effects of caffeoylquinic acids from Erigeron breviscapus on ischemic stroke [J]. Chin Trad Herb Drugs, 48(3): 609-615. [柯细彤, 章瑜芳, 朱兆云, 等, 2017. 灯盏细辛中咖啡酰奎宁酸防治缺血性脑卒中的研究进展 [J]. 中草药, 48(3): 609-615.]
LI DX, HUANG LY, XU ZL, et al., 2019. Effects of different temperatures on germination and physiological characteristics of date palm seed [J]. J S Agric, 50(8): 1764-1770. [李东霞, 黄丽云, 徐中亮, 等, 2019. 温度对椰枣种子发芽和生理特征的影响 [J]. 南方农业学报, 50(8): 1764-1770.]
LI P, DANG CL, 2005. Seed germination characteristics of Erigeron breviscapus [J]. J Chin Med Mat, 28(11): 975-976. [李鹂, 党承林, 2005. 灯盏花种子萌发特性 [J]. 中药材, 28(11): 975-976.]
LIN LF, TAO FQ, HU XQ, et al., 2009. Rapid propagation and plant regeneration of Erigeron breviscapus (Vaniot) Hand. Mazz. [J]. J Anhui Agric Sci, 37(4): 1580-1581. [林丽飞, 陶发清, 胡先奇, 等, 2009. 灯盏花组培快繁与植株再生 [J]. 安徽农业科学, 37(4): 1580-1581.]
LING LF, LIU CG, TAO HZ, 2008. Effects of several reagent on germination Erigeron breviscapus seed [J]. J Anhui Agric Sci, 36(21): 9118-9119. [林丽飞, 刘春国, 陶宏征, 2008. 不同试剂对灯盏花种子萌芽的影响 [J]. 安徽农业科学, 36(21): 9118-9119.]
LIU H, YANG XL, XU HB, 2002. Advances in studies on Erigeron breviscapus [J]. Chin Trad Herb Drugs, 33(6): 566-568. [刘宏, 杨祥良, 徐辉碧, 2002. 灯盏花的研究进展 [J]. 中草药, 33(6): 566-568.]
MA YH, LUO GA, WANG YM, 2004. Research status of Erigeron breviscapus [J]. Chin Trad Pat Med, 26(1): 63-65. [马宇辉, 罗国安, 王义明, 2004. 灯盏花研究近况 [J]. 中成药, 26(1): 63-65.]
MURASHIGE T, SKOOG F, 1962. A revised medium for rapid growth and bioassays with tobacco tissue cultures [J]. Physiol Plant, 15(3): 473-497.
QIAN L, 2015. Influence of environmental factors on seed germination of Salix linearistipularis [D]. Harbin: Northeast Forestry University. [钱璐, 2015. 环境因子对蒙古柳(Salix linearistipularis)种子萌发的影响 [D]. 哈尔滨:东北林业大学.]
SHENG LX, WANG P, ZHANG RB, 2004. The relation between seed life and ultradry preservation [J]. Seed, 23(2): 45-47. [申丽霞, 王璞, 张软斌, 2004. 种子寿命与超干贮藏 [J]. 种子, 23(2): 45-47.]
SUN CS, ZHU H, LONG XY, et al., 2016. Study on the storage and longevity of Sophora tonkinensis Gapnep seeds [J]. Seed, 35(1): 90-92. [孙长生, 朱虹, 龙祥友, 等, 2016. 山豆根种子贮藏与寿命研究 [J]. 种子, 35(1): 90-92.]
SMITH RD, 1992. Seed storage, temperature and relative humidity [J]. Seed Sci Res, 2(2): 113-116.
TAO ZY, ZOU Q, 2000. Imbibitional chilling injury and imbibition damage in seeds [J]. Plant Physiol J, 36(4): 368-376. [陶宗娅, 邹琦, 2000. 种子的吸胀冷害的吸胀伤害 [J]. 植物生理学报, 36(4): 368-376.]
WANG JJ, MA AW, WANG ZG, et al., 2016. Effects of different temperature and moisture conditions on seed germination of Festuca sinensis [J]. Pratac Sci, 25(4): 73-80. [汪建军, 麻安卫, 汪治刚, 等, 2016. 不同温度和PEG处理对中华羊茅种子萌发的影响 [J]. 草业学报, 25(4): 73-80.]
WEI CQ, LIU MC, TANG SC, et al., 2012. Effects of light and temperature on seed germination of Eupatorium odoratum [J]. Guihaia, 32(4): 527-530. [韦春强, 刘明超, 唐赛春, 等, 2012. 光照和温度对飞机草种子萌发的影响 [J]. 广西植物, 32(4): 527-530.]
XIONG Y, DU RH, MA JL, 2012. Construction of DNA fingerprinting and analysis of genetic diversity with ISSR for Erigeron breviscapine [J]. Biotechnology, 22(5): 45-48. [熊勇, 杜荣花, 马金林, 2012. 栽培灯盏花DNA指纹图谱研究及遗传多样性分析 [J]. 生物技术, 22(5): 45-48.]
YU XM, 2012. Lipidomic analysis the effect of low temperature and water stress on seed germination and storage [D]. Beijing: University of Chinese Academy of Sciences. [禹晓梅, 2012. 脂类组学解析低温和水分胁迫对种子萌发及储藏影响的机制 [D]. 北京:中国科学院大学.]
ZHANG DN, LUO AY, XU GP, et al., 2013. Influence of temperature and soil moisture on seed germination of Cyclobalanopsis [J]. Guihaia, 33(3): 306-312. [张德楠, 罗艾滢, 徐广平, 等, 2013. 温度和土壤含水量对青冈栎种子萌发的影响 [J]. 广西植物, 33(3): 306-312.]
ZHANG L, YU LN, MA YL, 2012. Relevant patent information analysis on cultivation techniques and compatibility of whole herb of Erigeron breviscapus [J]. Chin Trad Herb Drugs, (6): 1241-1244. [張俐, 佘丽娜, 马艳丽, 2012. 灯盏花栽培技术和原药配伍相关专利信息分析 [J]. 中草药, (6): 1241-1244.]
ZHANG W, YANG SC, ZHANG GH, et al., 2013. Present situation and countermeasures of Erigeron breviscapine planting [J]. Chin J Mat Med, 38(14): 2227-2230. [张薇, 杨生超, 张广辉, 等, 2013. 灯盏花种植发展现状及对策 [J]. 中国中药杂志, 38(14): 2227-2230.]
ZHAO M, WANG PF, WANG XM, et al., 2018. Structural identification of related substances in breviscapine by UPLCQTOFMS [J]. Chin J Mat Med, (14): 2872-2777. [赵猛, 王鹏飞, 王晓梅, 等, 2018. UPLCQTOFMS鉴定注射用灯盏花素原料药中相关物质的结构 [J]. 中国中药杂志, (14): 2872-2777.]
ZHAO Z, WANG DK, YANG JW, et al., 2013. Identification and anther development cytological studies of the male sterile individuals in Erigeron breviscapus [J]. Acta Bot BorealOccident Sin, 33(2): 287-294. [赵峥, 王定康, 杨建文, 等, 2013. 灯盏花雄性不育种质鉴定与花药发育的细胞学研究 [J]. 西北植物学报, 33(2): 287-294.]
ZHENG GH, LIANG Z, LIN J, 2001. Studies on the imbibitional chilling injury in seeds and osmoconditioning [J]. Bull Chin Acad Sci, 16(3): 182-187. [郑光华, 梁峥, 林坚, 2001. 种子吸胀冷害和渗透调控的研究 [J]. 中国科学院院刊, 16(3): 182-187.]

