高粱不同类型胚性和非胚性愈伤组织的生理生化差异
季艳丽 程云伟 陈发菊 张德春 周超
摘要: 植物体细胞胚胎发生过程中伴随着复杂的生理生化变化,为进一步揭示胚性愈伤组织的再生潜力,该研究以高粱Sb19未成熟胚诱导产生的两种胚性愈伤组织和一种非胚性愈伤组织为材料,通过测定各愈伤组织中可溶性蛋白、游离脯氨酸和可溶性糖的含量,采用方差分析法对高粱体细胞胚胎发生过程中不同类型愈伤组织的生理生化指标进行了差异比较研究。结果表明:(1)高粱两种胚性愈伤组织中可溶性蛋白、游离脯氨酸和可溶性糖的含量均显著高于非胚性愈伤组织,表明胚性愈伤组织中的代谢活性高于非胚性愈伤组织,能够为体细胞胚胎发生提供更多的物质能量基础。(2)两种类型胚性愈伤组织之间生理生化差异显著,其中,Ⅱ型胚性愈伤组织中可溶性蛋白和游离脯氨酸含量均显著高于I型胚性愈伤组织,相反,Ⅱ型胚性愈伤组织中可溶性糖含量显著低于I型胚性愈伤组织,这种生理生化差异在一定程度上影响了后期的分化。该研究结果为愈伤组织的胚胎发生能力与生化代谢的关系提供理论依据。
关键词: 高粱, 胚性愈伤组织, 非胚性愈伤组织, 可溶性蛋白, 游离脯氨酸, 可溶性糖
中图分类号: Q945.6文献标识码: A文章编号: 1000-3142(2019)12-1613-06
作者简介: 季艳丽(1994-),女,湖北随州人,硕士研究生,主要从事植物遗传育种与发育研究,(E-mail)1975891532@qq.com。
Abstract: There are complex physiological and biochemical changes in the process of plant somatic embryogenesis. In order to reveal the regenerative potential of embryogenic callus, we determined the content of soluble protein, free proline and soluble sugar in two kinds of embryogenic calluses and a non-embryonic callus which were from the induction of Sb19 Sorghum bicolor immature embryos. The differences of physiological and biochemical parameters between different types of callus in S. bicolor somatic embryogenesis were compared by variance analysis. The results were as follows: (1) The contents of soluble protein, free proline and soluble sugar in two kinds of embryogenic callus were significantly higher than that of non-embryogenic callus, which indicates that the metabolic activity in embryogenic callus is higher than that in non-embryonic callus, and embryogenic callus can provide more material energy basis for somatic embryogenesis. (2) The physiological and biochemical differences between the two types of embryogenic callus were also significant. Among them, the contents of soluble protein and free proline in Type Ⅱ embryogenic callus were significantly higher than that of Type I embryogenic callus. In contrast, the content of soluble sugar in Type Ⅱ embryogenic callus was significantly lower than that of Type I embryogenic callus. We draw a conclusion that the differences of physiological and biochemical affect the differentiation on a certain degree. This study provides a theoretical basis for the relationship between embryogenic ability and biochemical metabolism of callus.
Key words: Sorghum bicolor, embryogenic callus, non-embryonic callus, soluble protein, free proline, soluble sugar
高粱(Sorghum bicolor)是世界上五大谷類作物之一,具有较强的耐旱性,能够较好地适应半干旱气候,具有比玉米更高的水利用效率(Roby et al., 2017),在食品保障和可再生能源开发中发挥着独特的作用(Mullet et al., 2014; De et al., 2017)。目前,全球粮食、能源危机日益严重,发展高粱生产,将有助于缓解这些危机。建立高效的高粱再生体系和遗传转化体系是高粱分子育种的基础。但是,高粱体细胞胚胎发生当前面临的最大问题就是胚性愈伤组织再生能力的保持,其次是基因型和褐化问题。近年来,关于高粱愈伤组织继代培养后再生能力下降的研究多有报道(Liu et al., 2015; Li et al., 2017),但是未见对其再生率下降机理的研究。同时,在对其他禾本科植物如水稻的研究中发现,随着继代次数的增加,愈伤组织形态逐渐由胚性向非胚性转化,从而导致愈伤组织胚性的丧失(都晓龙等,2016)。因此,如何使体细胞转变为具胚性能力的细胞是保持愈伤组织分化能力的关键。
植物体细胞胚胎发生过程中伴随着复杂的生理变化。其中,蛋白质是胚胎发育的重要代谢物组之一,在胚胎发生初期激活细胞代谢以建立胚胎发生能力(Cangahuala-Inocente et al., 2014)。王慧纯等(2017)发现连香树胚性愈伤组织中可溶性蛋白含量显著高于非胚性愈伤组织,并表明胚性愈伤组织蛋白质的积累为体胚发生提供物质基础。脯氨酸在调节细胞形态和分化中起重要作用(Nanjo et al., 1999)。孟姣等(2015)报道栓皮栎胚性愈伤组织中游离脯氨酸含量均显著高于非胚性愈伤组织,表明了脯氨酸在体细胞胚胎发生中的重要性。可溶性糖在胚胎发育早期也具有重要作用,它不仅为细胞发育提供能源物质,构成碳骨架,而且具有信号传导的功能(赵江涛等,2006)。李华(2010)对珍珠黄杨的研究显示,胚性愈伤组织中可溶性糖含量高于非胚性愈伤组织,并表明可溶性糖能够为体细胞胚胎的发生提供能量和物质基础。因此,探究高粱胚性愈伤组织与非胚性愈伤组织生理生化差异对高粱体细胞胚胎发生机理的研究具有重要意义。
本研究以高粱 Sb19未成熟胚诱导产生的两种胚性愈伤组织和一种非胚性愈伤组织为材料,测定不同愈伤组织中可溶性蛋白、可溶性糖和游離脯氨酸含量,分析高粱两种胚性愈伤组织和非胚性愈伤组织生理生化特性的差异,以期为愈伤组织的胚胎发生能力与生化代谢的关系提供理论基础。
1材料与方法
1.1 材料
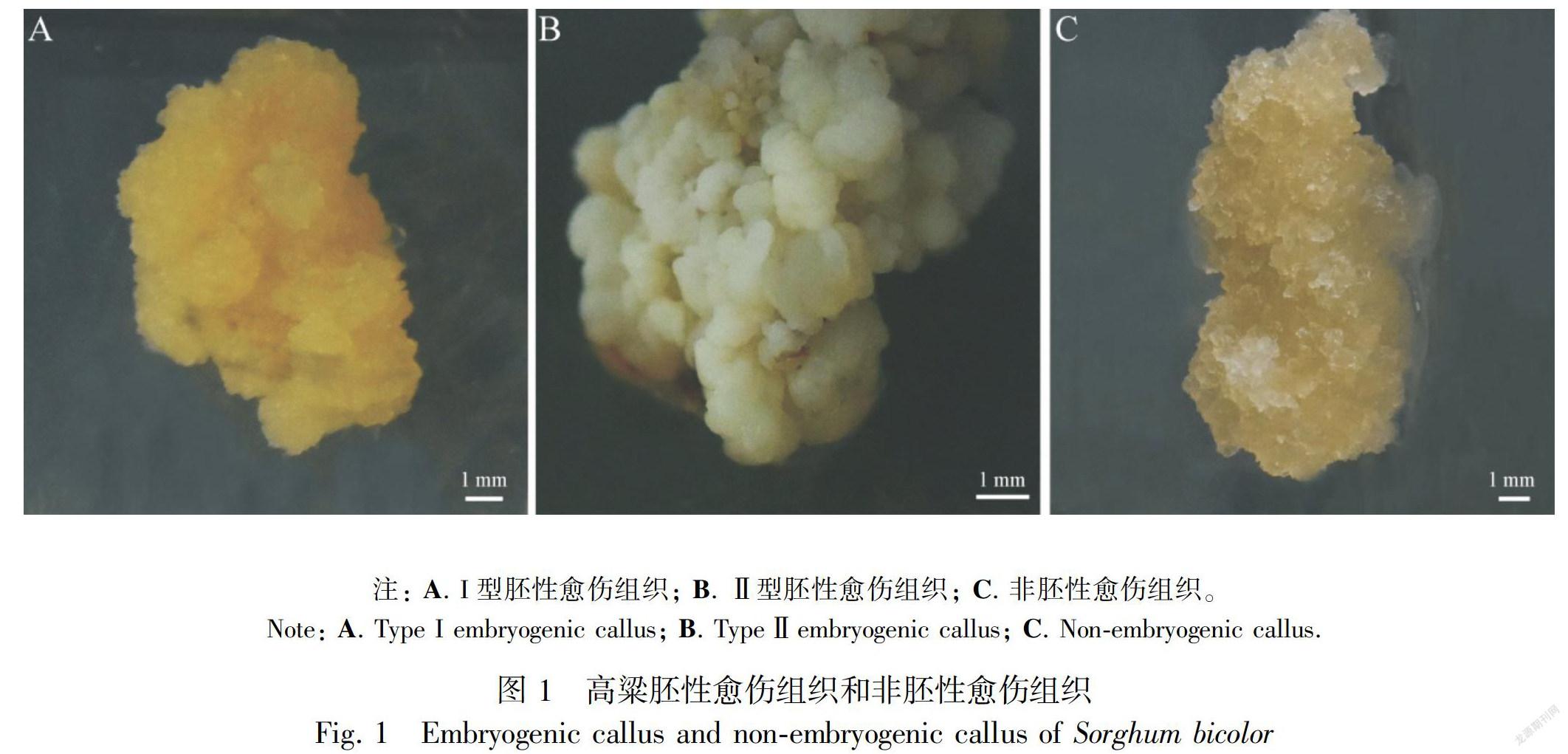
参考彭祥(2018)的方法,采集Sb19花后14 d的未成熟种子,经消毒后将未成熟胚剥离出来,将未成熟胚正面朝上放置在含1.0 mL·L-1 B5有机质、1.0 g·L-1 L-Pro、1.0 g·L-1 Asn、1.0 g·L-1 KH2PO4、1.0 g·L-1 PVP、2.5 mg·L-1 CuSO4·5H2O、2.0 mg·L-1 2,4-D、30.0 g·L-1蔗糖和8 g·L-1琼脂,pH为5.8的MS培养基上,置于25 ℃黑暗条件下培养30 d后, 得到三种愈伤组织(图1)。其中,注: A. I型胚性愈伤组织; B. Ⅱ型胚性愈伤组织; C. 非胚性愈伤组织。
I型胚性愈伤组织呈黄色,色泽鲜艳,呈细胞团状;Ⅱ型胚性愈伤组织呈白色颗粒或褶皱状,质地较硬;非胚性愈伤组织呈透明、水渍状,质地稀软。
1.2 方法
1.2.1 可溶性蛋白含量的测定愈伤组织中可溶性蛋白的提取:称取0.30 g的愈伤组织鲜样,用5 mL蒸馏水研磨成匀浆,于25 mL容量瓶中定容,放置30 min以充分提取,离心,上清液即为样品的蛋白提取液。采用考马斯亮蓝G-250法(王孝平和邢树礼,2009)测定各愈伤组织提取液中可溶性蛋白的含量。
1.2.2 游离脯氨酸含量的测定愈伤组织中游离脯氨酸的提取:称取0.3 g的愈伤组织鲜样,加5 mL 3%的磺基水杨酸溶液,沸水浴中提取10 min,提取时要时常摇动,冷却后过滤,滤液即为样品的脯氨酸提取液。采用酸性茚三酮法(王学奎,2006)测定各愈伤组织提取液中游离脯氨酸的含量。
1.2.3 可溶性糖含量的测定愈伤组织中可溶性糖的提取:称取0.3 g的愈伤组织鲜样,用1 mL水研磨成匀浆后转入试管中,并用5 mL蒸馏水分次洗涤,洗涤液转入试管中,沸浴提取10 min,冷却后过滤,将滤液定容于50 mL容量瓶中,即为样品的可溶性糖提取液。采用蒽酮比色法(丁雪梅等,2014)测定各愈伤组织提取液中可溶性糖的含量。
1.3 数据分析
每组样品重复取样3次,使用Excel 2010计算各指标含量,在SPSS19.0中采用单因素ANOVA法分析不同愈伤组织生理指标的差异,并采用 Duncan 法进行多重比较,使用Origin 9.0作图。检验显著性概率设置为α=0.05。
2结果与分析
2.1 可溶性蛋白含量的差异
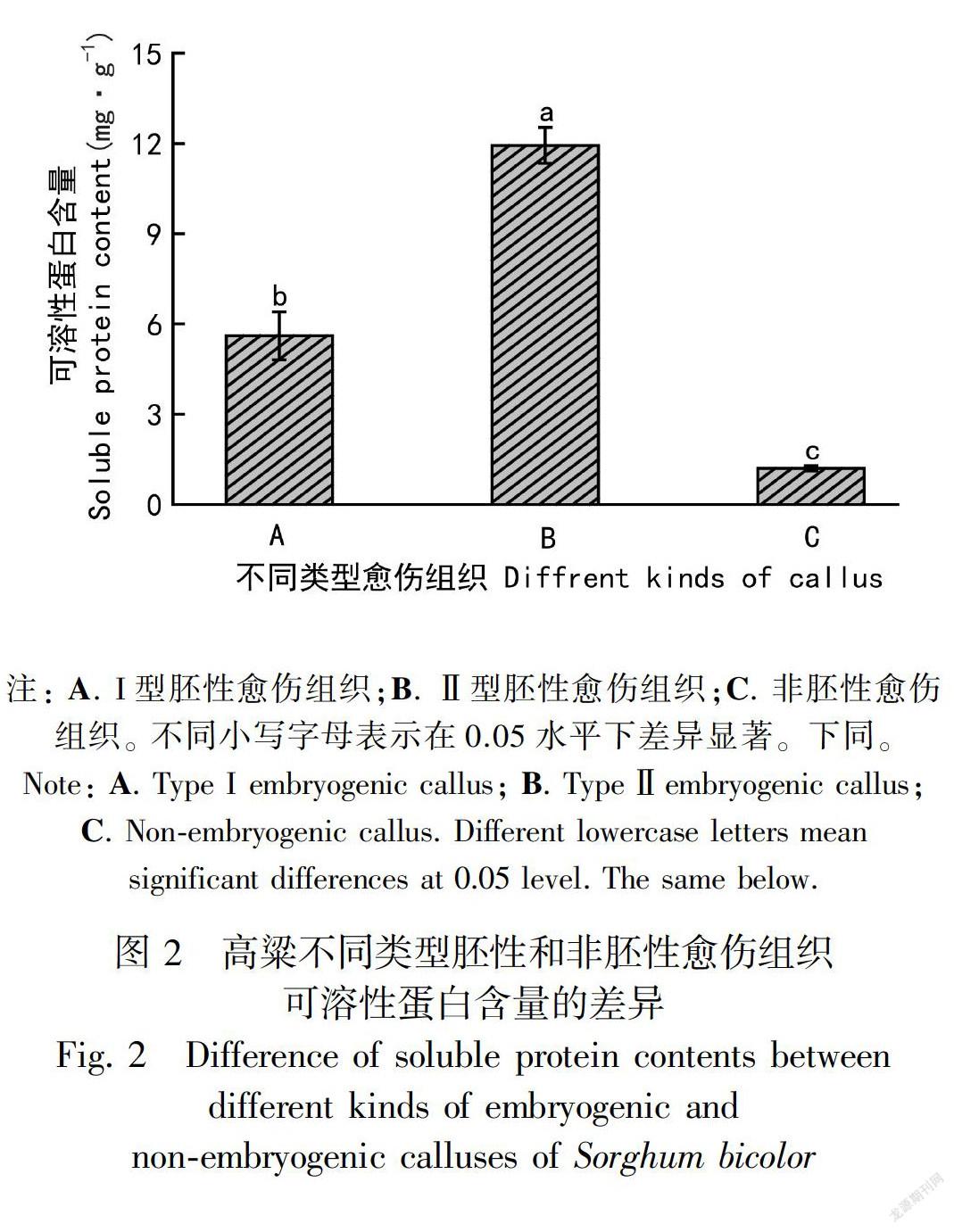
植物的可溶性蛋白中大部分是具有特异性作用的酶类,是重要的渗透调节物质和营养物质,其含量是了解植物细胞总代谢的一个重要指标,其积累与胚胎发育有关(Jiménez, 2001)。高粱不同类型胚性和非胚性愈伤组织可溶性蛋白含量的差异较大(图2),高粱两种胚性愈伤组织的可溶性蛋白含量均显著高于非胚性愈伤组织,且Ⅱ型胚性愈伤组织的可溶性蛋白含量显著高于I型胚性愈伤组织。
2.2 游离脯氨酸含量的差异
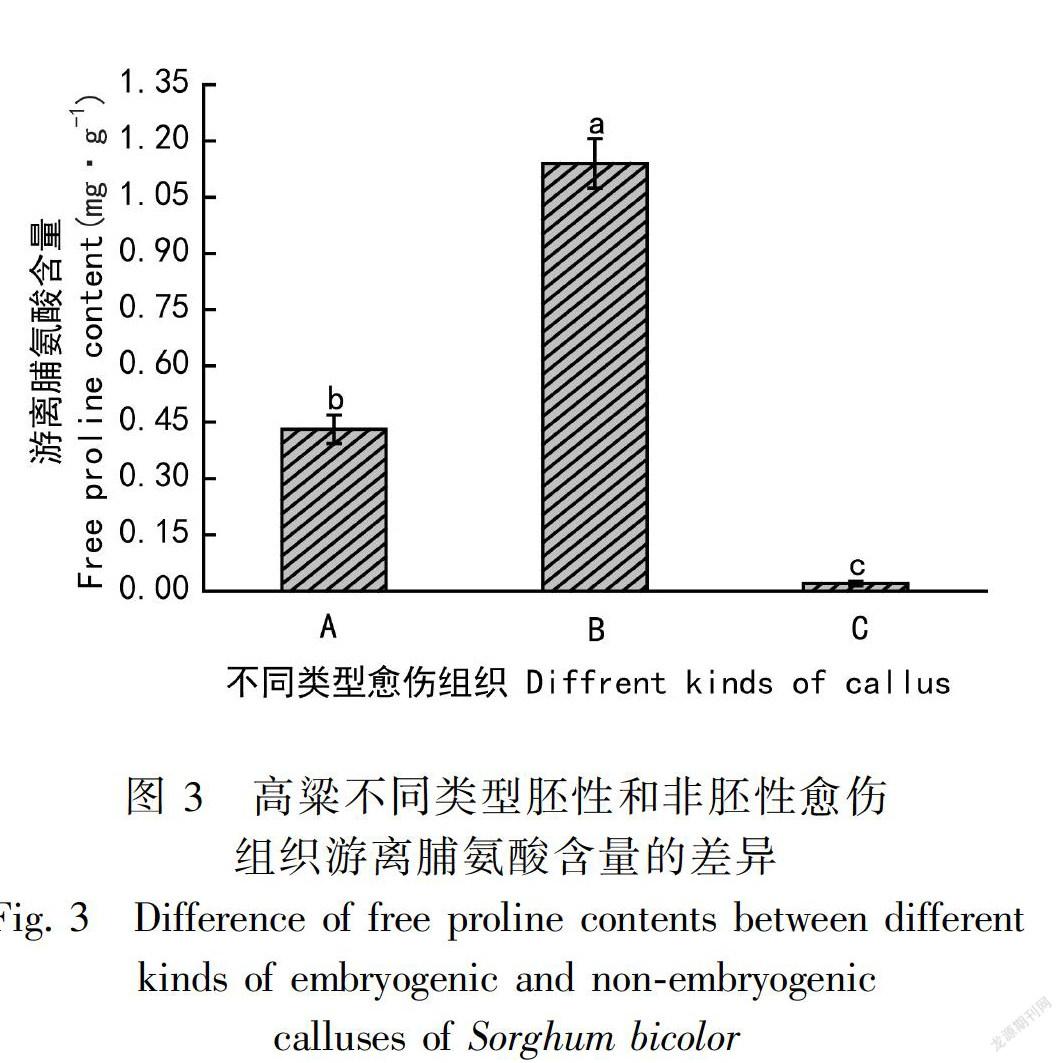
游离脯氨酸是细胞质中渗透调节的重要有机溶质,即使在没有应激情况下,对细胞形态和分化的调节也起重要的作用(Nanjo et al., 1999)。高粱不同类型胚性和非胚性愈伤组织游离脯氨酸含量的差异较大(图3),两种胚性愈伤组织的游离脯氨酸含量均显著高于非胚性愈伤组织,且Ⅱ型胚性愈伤组织的游离脯氨酸含量显著高于I型胚性愈伤组织。
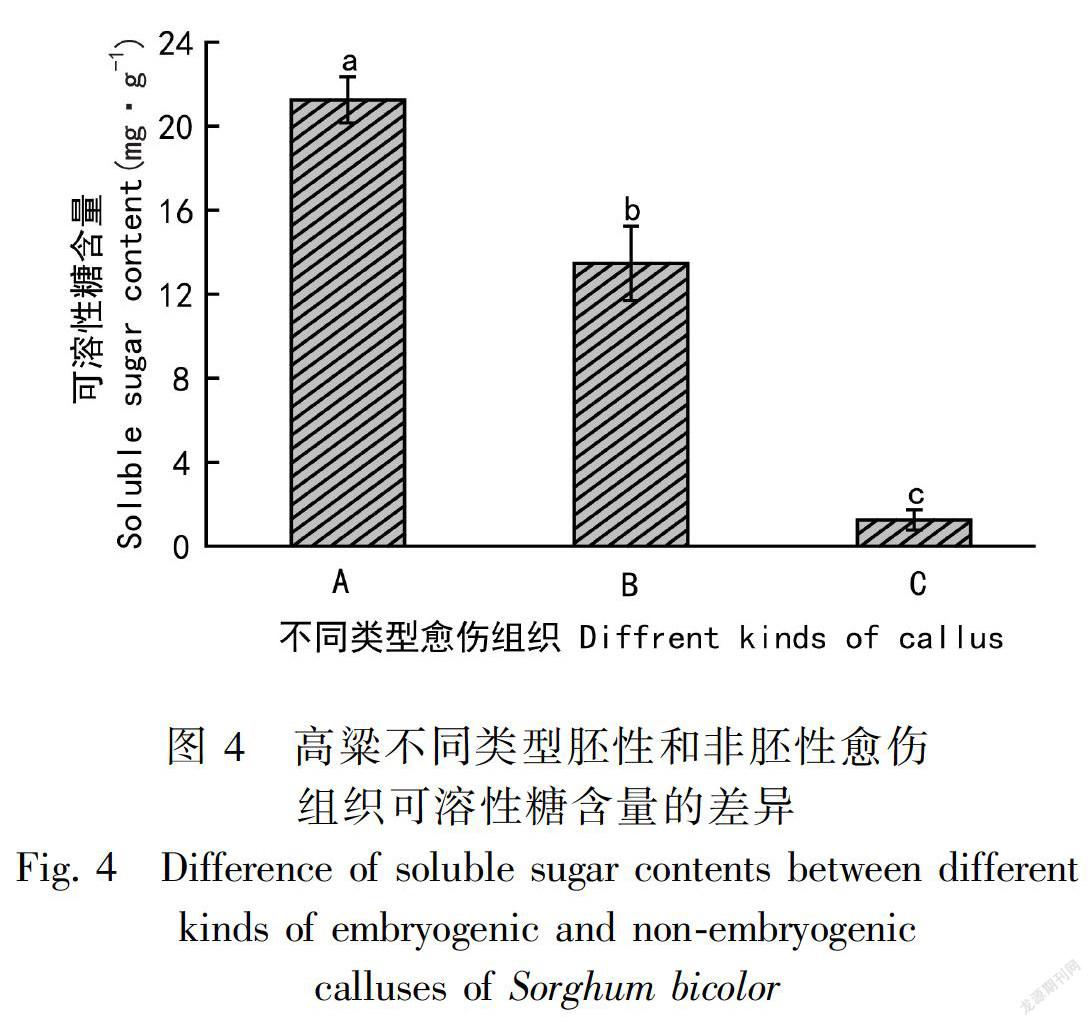
可溶性糖在植物胚胎发育的早期阶段具有重要作用,是碳骨架合成和信号传导的主要能量来源(赵江涛等, 2006)。高粱不同类型胚性和非胚性愈伤组织可溶性糖含量的差异较大(图4),两种胚性愈伤组织的可溶性糖含量均显著高于非胚性愈伤组织,且I型胚性愈伤组织的可溶性糖含量显著高于Ⅱ型胚性愈伤组织。
3讨论与结论
体细胞胚胎发生的实质是基因表达调控的结果,蛋白质是基因表达的产物,因此在体胚发生过程中必然伴随着蛋白质含量的变化(崔凯荣等,2001)。高粱两种胚性愈伤组织的可溶性蛋白含量均显著高于非胚性愈伤组织,说明高粱胚性愈伤组织代谢活动旺盛,高含量的可溶性蛋白能够为胚性细胞的分化奠定分子基础。赵舒野(2013)对胡桃楸体细胞胚发生过程生理生化特性的研究发现,胚性愈伤组织中的可溶性蛋白和可溶性糖含量始终高于非胚性愈伤组织,并表明胚性愈伤组织代谢较旺盛,能够从培养基中获得营养物质并积累,从而为后期分化做准备。
胚性愈伤组织中游离脯氨酸的积累与体细胞胚胎发生有重要联系(Fatima et al., 2011)。高粱两种胚性愈伤组织游离脯氨酸含量均显著高于非胚性愈伤组织,说明愈伤组织中游离脯氨酸含量的高低可能会影响组织分化。张永华等(2007)在对番茄花药组织培养的研究中也表明游离脯氨酸含量与苗分化有关。孙政等(2017)研究了楸树胚性愈伤组织与非胚性愈伤组织的生理生化差异,发现胚性愈伤组织中游离脯氨酸含量高于非胚性愈伤组织,并表明具有较高含量游离脯氨酸的愈伤组织其体胚发生能力也较强。
可溶性糖是植物胚胎发育过程中的主要能量来源(Pescador et al., 2008),能够为蛋白质的合成提供能源物质(孙政等,2017)。高粱两种胚性愈伤组织可溶性糖含量均显著高于非胚性愈伤组织,说明高粱胚性愈伤组织代谢速率高于非胚性愈伤组织,为后期的分化提供能源物质。邹玉霞等(2018)在对瘤毛獐牙菜愈伤组织生理生化差异的研究中发现,胚性愈伤组织中的可溶性糖含量是非胚性愈伤组织的2.5倍,表明高含量的可溶性糖和可溶性蛋白能够为后期细胞分化做准备。
高梁两种胚性愈伤组织的生理生化指标均有差异。其中,I型胚性愈伤组织的可溶性蛋白和游离脯氨酸含量显著低于Ⅱ型胚性愈伤组织,而可溶性糖含量显著高于Ⅱ型胚性愈伤组织。彭祥(2018)对这两种胚性愈伤组织的研究发现,I型胚性愈伤组织易分化成根,Ⅱ型胚性愈伤组织易分化成苗。我们认为两种愈伤组织生理生化的差异一定程度上影响了后续的分化。王海波和范云六(2006)在对小麦的组织培养中表明,可以通过控制外源因子(如培养基、温度、光照等),对培养物生理生化过程进行调控进而影响愈伤组织状态。因此,我们是否可以通过跟踪愈伤组织中生理生化的变化,对愈伤组织状态进行调控使其能够实现长期继代而不丧失分化能力,这值得我们进一步探讨。
参考文献:
CANGAHUALA-INOCENTE GC, SILVEIRA V, CAPRESTANO CA, et al., 2014. Dynamics of physiological and biochemical changes during somatic embryogenesis of Acca sellowiana [J]. In Vitro Cell Dev Biol-Plant, 50(2): 166-175.
CUI KR, XING GS, ZHOU GK, et al., 2001. The biochemical base of somatic embryogenesis [J]. Chin Bull Life Sci, 13(1): 28-33. [崔凯荣, 邢更生, 周功克, 等, 2001. 体细胞胚发生的生化基础 [J]. 生命科学, 13(1): 28-33.]
DE ML, PINHEIRO SS, MARTINO HS, et al., 2017. Sorghum (Sorghum bicolor L.): Nutrients, bioactive compounds, and potential impact on human health [J]. Crc Crit Rev Food Sci Nutr, 57(2): 372-390.
DING XM, ZHANG XJ, ZHAO Y, et al., 2014. Improvement of test method for determination of soluble sugar content by anthrone colorimetry [J]. Heilongjiang Anim Sci Vet Med, 467(23): 230-233. [丁雪梅, 张晓君, 赵云, 等, 2014. 蒽酮比色法测定可溶性糖含量的试验方法改进 [J]. 黑龙江畜牧兽医, 467(23): 230-233.]
DU XL, SUN CY, ZHANG MP, et al., 2016. Effects of transgenerational times on rice (Jijing88) callus physio-biochemistry indexes and the cell morphology [J]. J Anhui Agric Sci, 44(5):155-158. [都晓龙, 孙春玉, 张美萍, 等, 2016. 继代次数对吉粳88愈伤组织生理生化指标及细胞形态的影响 [J]. 安徽农业科学, 44(5):155-158.]
FATIMA S, MUJIB A, SAMAJ J, 2011. Anti-oxidant enzyme responses during in vitro embryogenesis in Catharanthus roseus [J]. J Pomol Hortic Sci, 86(6): 569-574.
JIMNEZ V, 2001. Regulation of in vitro somatic embryogenesis with emphasis on to the role of endogenous hormones [J]. Braz J Plant Physiol, 13(2): 196-223.
LI G, WANG L, LIU Y, et al., 2017. Construction of an efficient tissue culture system for sorghum using mature embryos [J]. Pakistan J Bot, 49(3): 995-1000.
LI H, 2010. Study on embryogenic callus induction of Buxus sinica var. parvifolia [D]. Nanjing: Nanjing Forest Univer-sity: 36-38. [李華, 2010. 珍珠黄杨胚性愈伤组织诱导的研究 [D]. 南京: 南京林业大学: 36-38.]
LIU G, GILDING EK, GODWIN ID, 2015. A robust tissue culture system for sorghum [Sorghum bicolor (L.) Moench] [J]. S Afr J Bot, 98(2015): 157-160.
MENG J, ZHANG CX, SUN L, et al., 2015. Biochemical cha-racteristic variations of embryogenic and non-embryogenic callus of Quercus variabilis [J]. J NW For Univ, 30(5): 106-110. [孟姣, 张存旭, 孙琳, 等, 2015. 栓皮栎胚性和非胚性愈伤组织生化特性研究 [J]. 西北林学院学报, 30(5): 106-110.]
MULLET J, MORISHIGE D, MCCORMICK R, et al., 2014. Energy sorghum — A genetic model for the design of C4 grass bioenergy crops [J]. J Exp Bot, 65(13): 3479-3489.
NANJO T, KOBAYASHI M, YOSHIBA Y, et al., 1999. Biological functions of proline in morphogenesis and osmotolerance revealed in antisense transgenic Arabidopsis thaliana [J]. Plant J, 18(2):185-193.
PENG X, 2018. Research in establishment of sorghum (Sorghum bicolor L. Moench) regeneration system and Agrobacterium-mediated genetic transformation [D]. Yichang: China Three Gorges University: 16-28. [彭祥, 2018. 高粱再生体系建立及其农杆菌介导的遗传转化研究 [D]. 宜昌: 三峡大学: 16-28]
PESCADOR R, KERBAUY GB, KRAUS JE, et al., 2008. Changes in soluble carbohydrates and starch amounts during somatic and zygotic embryogenesis of Acca sellowiana (Myrtaceae) [J]. In Vitro Cell Dev Biol-Plant, 44(4): 289-299.
ROBY MC, SALAS FERNANDEZ MG, HEATON EA, et al., 2017. Biomass sorghum and maize have similar water-use-efficiency under non-drought conditions in the rain-fed Midwest U.S [J]. Agric For Meteorol, 247(2017): 434-444.
SUN Z, CHEN FJ, GAO H, et al., 2017. Physiological and biochemical differences of embryogenic callus and non-embryogenic callus in Catalpa bungei [J]. Mol Plant Breed, 15(11): 4642-4646. [孫政, 陈发菊, 高晗, 等, 2017. 楸树胚性愈伤组织与非胚性愈伤组织的生理生化差异 [J]. 分子植物育种, 15(11): 4642-4646.]
WANG HB, FAN YL, 2006. Researching the mechanism in plant in vitro culture via ‘communication’ experiment and to establish the methods widely used for tissue culture of wheat [J]. Acta Agron Sin, 32(7): 964-971. [王海波, 范云六, 2006. 用“对话”试验探索植物组织培养机制并建立适用性广的小麦组织培养方法 [J]. 作物学报, 32(7): 964-971.]
WANG HC, WEI HY, LIU JZ, et al., 2017. Physiological and biochemical differences and isoenzymes analysis of embryogenic callus and non-embryogenic callus in Cercidiphyllum japonicum [J]. Genom Appl Biol, 37(10): 4449-4454. [王慧纯, 韦虹宇, 刘金炽, 等, 2017. 连香树胚性与非胚性愈伤组织生理生化差异及同工酶分析 [J]. 基因组学与应用生物学, 37(10): 4449-4454.]
WANG XK, 2006. Principles and techniques of plant physiolo-gical and biochemical experiments [M]. Beijing: Higher Education Press: 167-169. [王学奎, 2006. 植物生理生化实验原理和技术 [M]. 北京: 高等教育出版社: 167-169.]
WANG XP, XING SL, 2009. Determination of protein quantitation using the method of coomassie brilliant blue [J]. Tianjin Chem Ind, 23(3): 40-42. [王孝平, 邢树礼, 2009. 考马斯亮蓝法测定蛋白含量的研究 [J]. 天津化工, 23(3): 40-42.]
ZHANG YH, XIN JH, YUAN YW, 2007. Study on the change of proline content in tomato anther callus induction [J]. N Hortic, (6): 15-16. [張永华, 辛建华, 苑育文, 2007. 番茄花药愈伤组织诱导中脯氨酸含量变化的研究 [J]. 北方园艺, (6): 15-16.]
ZHAO JT, LI XF, LI H, et al., 2006. Research on the role of the soluble sugar in the regulation of physiological metabolism in higher plant [J]. J Anhui Agric Sci, 34(24): 6423-6425. [赵江涛, 李晓峰, 李航, 等, 2006. 可溶性糖在高等植物代谢调节中的生理作用 [J]. 安徽农业科学, 34(24): 6423-6425.]
ZHAO SY, 2013. The physiological and biochemical characteristics of somatic embryogenesis in Juglans mandshurica [D]. Harbin: Northeast Forest University: 7-15. [赵舒野, 2013. 胡桃楸体胚发生过程中生理生化特性的研究 [D]. 哈尔滨: 东北林业大学: 7-15.]
ZOU YX, MA YT, MAO SN, et al., 2017. Induction and phy-siological-biochemical characteristic study of callus of Swertia pseudochinensis Hara [J]. Pharm Clin Chin Mat Med, 49(3): 14-17. [邹玉霞, 马云桐, 毛胜楠, 等, 2018. 瘤毛獐牙菜愈伤组织诱导及生理生化特性研究 [J]. 中药与临床, 49(3): 14-17.]

