草莓KEA家族基因的克隆、鉴定及表达分析
姜玉素 李珍 王庆莲 赵密珍 宋志忠







摘要:K+/H+逆向转运体(KEA)介导细胞中K+和H+的动态平衡,在维持植物体内的离子平衡、生长发育和信号转导中起重要作用,然而,相关研究主要体现在模式作物拟南芥中,果树中KEA家族基因的功能依然未知。本研究以Yellow Wonder 5AF8草莓为材料,筛选并克隆KEA家族基因,并对其进行生物信息学鉴定和表达特征分析,为研究果树K+/H+平衡及钾素动态平衡机制提供基因资源和理论依据。结果表明,在草莓基因组中检索并克隆到5个KEA家族基因,命名为FreKEAI~FreKEA5,属于典型的植物K+/H+逆向转运体基因;编码的蛋白质与7种已报道的不同科属植物的KEA家族蛋白在氨基酸水平上具有25.00%的一致性,并可分为2个亚族(Group I和Group II),其中,草莓FveKEA1和FveKEA2属于Group I,只含有4个Motif基序,而FveKEA3~FveKEA5属于Group II,含有7个Motif基序;系统进化树表明草莓FveKEA2和FveKEA4分别与葡萄VvKEA2和苹果MdoKEA6紧密聚在一起,草莓FveKEA1、FveKEA3和FveKEA5分别与葡萄VvKEA1、白杨PtrKEA4、桃PpeKEA4等相应成员在遗传距离上较近;草莓KEA家族蛋白主要定位于细胞质膜,均含有12~14个跨膜区,除FveKEA3外,均为稳定蛋白,且只有FveKEA5含有信号肽;转录表达谱分析结果揭示草莓KEA家族基因在多种组织或器官中均有表达,实时荧光定量PCR结果表明FreKEAI在5AF8草莓不同组织中的整体表达水平最高,在花瓣和未成熟果实中的表达量最为突出,其次是FveKEA4,而其他3个基因的整体表达水平相对较低。此外,在草莓KEA基因启动子区域鉴定到至少16种顺式作用元件,且均含有光感应、胚乳表达和脱落酸(ABA)响应的作用元件。
关键词:草莓;K+/H+逆向转运体;生物信息学分析;基因克隆与表达
中图分类号:S668.4
文献标识码:A
文章编号:1000-4440(2019)02-0391-09
钾离子(K+)是细胞中含量最为丰富的金属阳离子之一,控制着细胞基础膜电位,调节细胞渗透平衡,在植物光合作用、蒸腾作用、气孔开关和信号传导等多种生命活动中起关键作用[1-2]。园艺研究中,钾素营养与果树生长发育、花开放、果实品质和产量等密切相关[3-7],但果树钾素营养高效利用的分子基础研究较少。
CPAs(Cation proton antiporters)定位于细胞质膜液泡膜和线粒体、叶绿体、内质网等细胞器膜,是一类广泛存在于植物、动物、真菌和细菌的阳离子_质子逆向转运体,可将细胞中的K+、Na+、Li+等阳离子排出,并引起细胞内H+的内流和积累[8-9],维持细胞K+和H+的动态平衡。植物中,CPAs介导细胞中离子和pH的稳态,在维持植物体内的渗透平衡、生长发育和信号转导中起重要作用[8-16]。植物CPAs被分为2个亚族:CPA1和CPA2,其中,CPA1亚族主要是NHX(Na+/H+ exchanger)转运体,CPA2亚族包括KEA(K+ efflux antiporter,K+/H+逆向转运体)和CHX(Cation/H+ exchanger)转运体[8-10]。近20年,NHX和CHX的研究报道相对较多,有关KEA亚族的研究最为稀少,主要体现在模式作物拟南芥中,Maser等在2011年最早揭示拟南芥中有6个At-KEA转运体基因[11],但所有AtKEA基因的功能至今依然没有完全被解析。最近研究结果表明:拟南芥AtKEA转运体定位于维管组织、保卫细胞和花萼等不同组织部位[12],拟南芥AtKEA1-3转运体在光合作用、pH调控及叶绿体渗透调节等方面起关键作用,并在转录水平受外界渗透胁迫、盐胁迫和ABA胁迫的调控[13-16]。
果树中KEA家族基因的功能依然未知,仅见于梨KEA家族基因的克隆及生物信息学分析[17]。草莓[Fragaria resca]是一种全球重要的水果,随着基因组序列的公布,迅速成为最具研究潜力的园艺作物之一[18]。本研究从草莓中克隆并鉴定了5个KEA家族基因,并通过实时荧光定量PCR分析组织特异性表达特征,为研究果树钾素营养与离子动态平衡提供理论依据。
1 材料与方法
1.1 试验材料及取样
供试材料为江苏省农业科学院草莓资源圃中的草莓Yellow Wonder 5AF8,于2018年3月采样。所取样品依次为盛花期草莓植株的根、叶片、花瓣、花药和草莓发育不同时期的果实(参照Fait等[19]描述,即:小绿果、白果转色果、成熟果)。
1.2 草莓KEA基因克隆
以6个拟南芥KEA家族基因(TAIR数据库,http://www.arabidopsis.org/browse/'genefamily/index.jsp)编码的氨基酸序列为参考,在Phytozome strawberry genome database(http://www.phytozome.net)中检索草莓基因组中可能的KEA家族基因。检索结果在Pfam(http://pfam.xfam.org/search)在线服务器预测功能结构域。根据Phytozome获得的草莓KEA基因CDS序列(coding sequence),分別设计引物,利用Prime STARTM HS DNA聚合酶(TaKaRa,大连)进行PCR扩增,测序验证后,用于特异性表达引物设计。
1.3 草莓KEA家族基因生物信息学分析
在草莓基因组数据库中获得KEA家族各基因的CDS编码区序列及基因组DNA序列,然后通过Gene structure display(http://gsds.cbi.pku.edu.cn/index.php)在线服务器进行基因结构分析,利用在线软件TMpredict(http://ch.embnet.org/sofware/TMPRED_form.html)分析草莓KEA家族蛋白的跨膜结构域,使用在线服务器MEME(v4.8.1)(http://meme-suite.org/tools/meme)预测草莓KEA家族蛋白的保守结构域,使用在线工具ProtParam(http://expasy.org/tools/protparam.html)评估KEA蛋白成员的理论等电点、分子量、稳定性等理化性质,利用在线软件SignalP4.0(http://www.cbs.dtu.dk/services/SignalP-4.0/)预测KEA家族蛋白的信号肽情况,利用PSORT在线服务器(http://psort.hgc.jp/form.html)预测草莓KEA家族蛋白的亚细胞定位,利用Phyre2在线服务器(http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)分析草莓KEA家族蛋白的三级结构,利用ClustalX 2.0软件对5个草莓KEA转运体与梨(12个)、苹果(7个)、桃(5个)、葡萄(4个)、橙(5个)、杨树(4个)等已知物种的同源KEA转运体进行氨基酸序列比对分析[16],用分子进化遗传分析软件MEGA7.0中的邻接法(Neighbor-joining)构建系统进化树。利用Kang等建立的草莓不同发育阶段的表达谱数据库Strawber-ry Genomic Resources(http://bioinformatics.towson.edu/strawberry/)[18]获得草莓KEA家族基因在不同组织的表达谱信息。为分析草莓KEA家族基因的启动子区域,在Phytozome草莓基因组数据库检索目的基因CDS区域起始密码子ATG的上游1.5kb左右片段的启动子区域,并通过PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/ht-ml/)在线网站分析草莓KEA启动子序列中是否含有的cis-顺式作用元件。
1.4 实时荧光定量PCR分析
分别采集草莓5AF8不同部位的组织材料,液氮冷冻后-80C冰箱保存,通过MiniBESTPlantRNA Extraction Kit(TaKaRa,大連)提取样品的总RNA,并利用PrimeScriptTM RT reagent Kit 反转录试剂盒(TaKaRa,大连)合成第一链cDNA作为模板,用于实时荧光定量PCR。利用NCBI/Primer-BLAST在线服务器,设计草莓KEA基因的特异性表达引物(表1),以草莓Ubiquitin(GenBank No.MH114011)为目的基因,通过ABI 7500实时荧光定量PCR仪检测KEA基因在草莓植株不同组织的表达特征。荧光染料使用SY BR Green(TaKa-Ra,大连),反应体系参照说明书,反应程序为:95C预变性30s;95°C变性5s,609C退火34s(40个循环);最后72 C延伸10s。每个样品进行3次重复,不同样品在实时荧光定量PCR仪获得相应的Ct值,经内参基因Actin 均一化处理后,采用2-△OC’法计算基因的相对表达量[20]。
2 结果与分析
2.1 草莓KEA家族基因的筛选与克隆
以6个拟南芥KEA家族基因的氨基酸序列为参考,在Phytozome strawberry genome database(http://www.phytozome.net)草莓基因组数据库中检索到5个KEA家族基因,检索结果在Pfam在线服务器预测到K/H交换结构域(K/H exchanger domain)(PF00999)和TrkA-N domain(PF02254)功能结构域,均属于典型的KEA家族蛋白。检索获得各基因的碱基序列后,以CDS序列起始密码子ATG和终止密码子TAG所在位置20 bp左右的序列作为上下游引物,以5AF8草莓幼叶RNA反转录获得的cDNA为模板,PCR扩增各个候选基因的CDS序列,分别连接到pGEM-T载体,转化大肠杆菌感受态菌株DH5a,筛选阳性转化子送北京擎科生物技术有限公司测序。经测序验证后,获得草莓5AF8的KEA家族各基因的CDS序列及相应翻译得到的氨基酸序列,获得的草莓KEA家族基因分别命名为FveKEAI~FveKEA5。
2.2 7种不同科属植物KEA家族成员的系统发育树
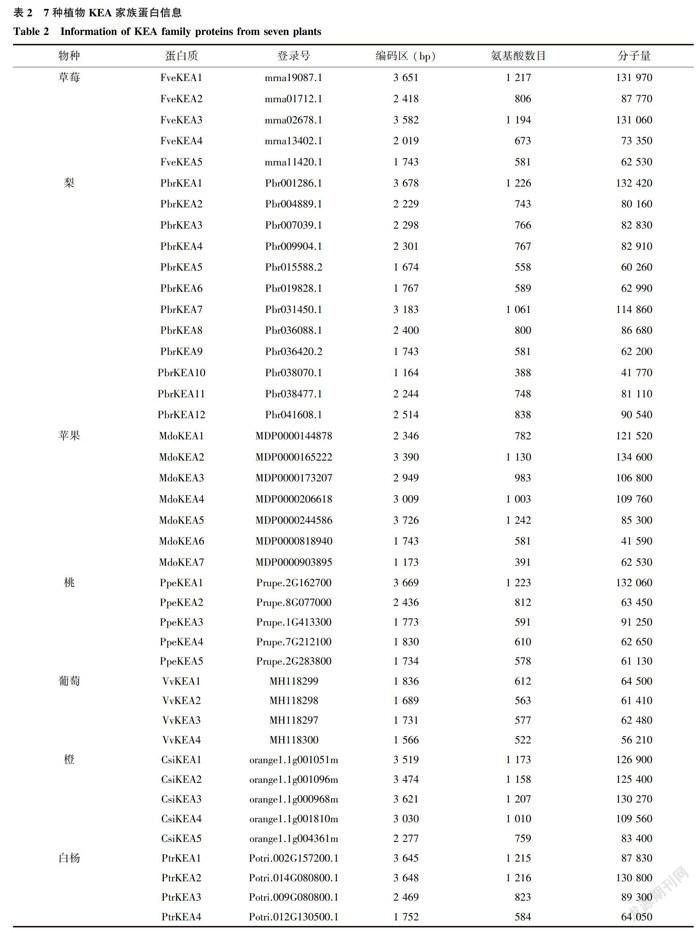
将草莓(蔷薇科)、桃(蔷薇科)、梨(蔷薇科)、苹果(蔷薇科)、葡萄(葡萄科)、橙(芸香科)、白杨(杨柳科)等7种不同科属物种的KEA家族基因(表2),通过ClustalX 2.0进行氨基酸水平的多重序列比对。结果表明,供试物种的KEA家族基因之间具有较高的同源性,同源关系较近的两者之间的序列一致性均高于66.05%;7种植物42个KEA家族成员在氨基酸水平依然具有25.00%的一致性,在核苷酸水平具有25.60%的一致性;5个草莓KEA家族成员在氨基酸水平具有41.88%的一致性(图1),在核苷酸水平具有40.97%的一致性。利用MEGA 7.0建立系统进化树,结果表明,7种植物KEA家族成员可分为2个亚族,Group I和Group II,其中,草莓FveKEAI和FveKEA2属于Group I,而FveKEA3、FreKEA4和FveKEA5属于Group II(图1和表3)。此外,7种植物KEA家族基因在遗传进化关系上有差异,草莓和蔷薇科植物(苹果和桃)、葡萄科葡萄、杨柳科白杨在遗传距离上是较近的,其中,草莓FveKEA2和FreKEA4分别与葡萄VoKEA2和苹果MdoKEA6紧密聚在一起,草莓FreKEAI、FveKEA3和FveKEA5分别与葡萄VvKEAI、白杨PtrKEA4桃Ppe-KEA4等相应成员在遗传距离上较近(图1)。身为芸香科植物,橙KEA成员则聚集在一起,与白杨PtrKEAI和PtrKEA2在遗传距离上较近,且均属于Group I亚族(图1)。
2.3 草莓KEA基因及编码蛋白质特征分析
草莓KEA家族基因主要定位于1号(FveKEA5)、2号(FveKEA2和FrveKEA3)和7号(FveKEAI和FveKEA4)染色体上,含有至少27个长度不一的内含子,其中FreKEA3基因拥有最多(34个)的内含子数目(表3);FreKEAI基因CDS编码区最长,其次是FveKEA3,FveKEA5最短,其编码氨基酸数目和分子量与CDS长度成正比(表2);保守基序分析结果表明草莓FveKEA1含有4个Motif基序(Motif4 ~Motif7),FveKEA2蛋白含有4个Motif基序(Motif2、Motif4、Motif6和Motif7),而FveKEA3、FveKEA4和FveKEA5均含有7个Motif基序,即Motif1~Motif7(图2和表3)。蛋白质三级结构预测分析结果表明草莓FveKEA1、FveKEA2和FveKEA5拥有相似的三级结构,暗示这3个蛋白质可能拥有相近的功能,而FveKEA3和FveKEA4则分别拥有独特而差异明显的三级结构(图2)。
此外,FveKEA4的等电点(PI)>7.00,其他草莓KEA家族蛋白的等电点均小于7.00,表明FveKEA4含有的碱性氨基酸较多,而其他4个成员的酸性氨基酸较多;草莓KEA家族蛋白均含有12~14个跨膜区,且只有FveKEA5具有信号肽,位于第22~23氨基酸区域;此外,FveKEA3蛋白的不稳定指数>40,为不稳定蛋白,而其他4个成员均小于40,为稳定蛋白(表3)。
2.4 草莓KEA基因启动子顺式作用元件分析
cis-顺式作用元件预测结果表明,草莓KEA家族基因启动子区域鉴定到至少16种顺式作用元件,包括营养和发育、激素响应、胁迫响应、昼夜规律等不同生命过程的调控元件(表4)。其中,3种(光感应、胚乳表达和脱落酸ABA响应)转录元件在全部5个FreKEA基因的启动子中均能预测到,茉莉酮酸甲酯(除FveKEA2基因)和赤霉素(除FveKEA5基因)响应作用元件在4个基因的启动子区域能检测到,水杨酸响应、热胁迫、厌氧感应、干旱诱导、低温感应和生长素响应相关的顺式作用元件均在不同的3个FrveKEA基因的启动子区域出现,防御与胁迫、昼夜规律和真菌激发子响应相关的顺式作用元件均能在不同的2个FveKEA基因的启动子区域出现,此外,玉米蛋白代谢(FveKEA2)和乙烯响应(FveKEA3)相关的顺式作用元件分别在一个FreKEA基因的启动子区域鉴定到(表4)。
2.5 草莓KEA蛋白亚细胞定位预测及KEA基因表达谱分析
亚细胞定位预测结果表明草莓FveKEA蛋白主要定位于细胞质膜,其次是内质网膜(FveKEA2除外)和液泡膜(FveKEA2和FveKEA5 除外),FveKEA2在叶绿体和线粒体等细胞器的膜上也有检测到,FveKEA3也定位于核膜上(表5)。
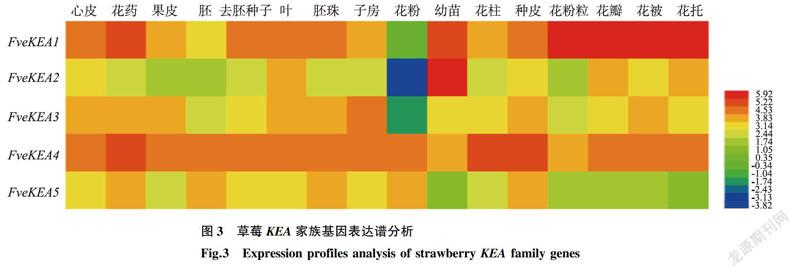
草莓表达谱数据库Strawberry genomic resources检索结果表明,草莓FveKEA基因在心皮、花药、果皮、胚、去胚种子、胚珠、子房、花粉、幼苗、花柱、种皮、花粉粒、花瓣、花被和花托等多种组织中均能检测到(图3);FveKEAI和FveKEA4的表达量相对较高,其中,FveKEAI主要在花粉粒、花瓣、花被和花托中表达,其次是花药和幼苗,FveKEA2主要在幼苗中表达,在花粉中表达量极低,FveKEA3主要在子房中表达,FreKEA4主要在花柱、种皮和花药中表达,FveKEA5表达量较低,在种皮、花粉和胚中均少量表达(图3)。
2.6 草莓KEA家族基因组织特异性表达分析
荧光定量PCR分析结果表明:FveKEAI~FveKEA5在草莓5AF8不同组织中的表达量有差异,FveKEAI在不同组织中的整体表达水平最高(特别是花瓣中),其次是FveKEA4,其他3个基因在草莓不同组织中的表达水平较为接近,均显著低于FveKEAI和FveKEA4,与表达谱分析结果基本一致(图4);在不同组织中,FveKEAI在花瓣和未成熟果实(包括绿果期、白果期和转色期)中的表达量最高,其次是花药,花柱中最低;FveKEA2在叶片的表达量最高,其次是根部,在花柱和花药中的表达量最低;FveKEA3在不同组织中的表达量没有显著差异;FveKEA4在花柱和花药等花器官中的表达水平最高,显著高于其他组织;FveKEA5在花柱、花药和未成熟果实(绿果期、白果期及转色期)中的表达水平较高,显著高于其他组织(图4)。
3 讨论
植物钾素营养研究中,KEA转运蛋白是一类维持体内K+/H+动态平衡并参与渗透调节和pH稳定的逆向转运体。有关K+吸收、转运、卸载和分配的研究较为详尽[21],而对同时转运K+和H+的KEA转运体的研究较少。然而,相关报道主要集中在模式作物擬南芥,果树作物KEA转运体的具体功能依然未知。
基因组测序技术的迅速发展,为果树作物的科学研究提供了基因资源。本研究从蔷薇科植物中克隆并鉴定了5个FveKEA转运体基因,与蔷薇科桃和芸香科橙中KEA基因成员数目一致,与葡萄科葡萄和杨柳科白杨接近,而远低于同属蔷薇科果树的梨和苹果,表明,同一家族基因成员的数目在同一科属的不同作物之间差异较大,而在相同科属的不同作物之间可能相同或相近,暗示基因功能的多样性或差异性。此外,不同物种KEA家族成员在遗传进化关系上存在差异,草莓和同属蔷薇科植物(苹果和桃)在遗传距离上较近,而芸香科植物橙KEA成员则集中聚集在-起,与蔷薇科和葡萄科果树作物KEA进化关系较远。在5个草莓KEA转运体中,FveKEA1和FveKEA2同属于Group I,且具有相似的Motif和高级蛋白质结构,暗示进化关系上相近的(同一亚族)且具有类似蛋白质Motif基序的2个转运体之间可能具有相似的功能,而FveKEA3、FveKEA4和FveKEA5同属于GroupII,且具有7个相同的Motif,但在高级蛋白质结构上差异很大,暗示遗传关系相近的成员可能在长期进化过程中发生了不同功能的演变。
Kunz等报道拟南芥AtKEA1~AtKEA3主要定位于细胞质膜_上[13-14,16],本研究中亚细胞定位预测结果表明草莓FveKEA1~FveKEA5主要分布在细胞质膜上,与Kunz等报道相一致。Han等[12]报道指出拟南芥AtKEAI和AtKEA3主要在地上部表达,而其他4个成员基因在植物全身均有表达;Chen等[2]报道GmKEA家族基因在大豆不同组织中均有表达,且差异显著。本研究荧光定量PCR结果表明草莓KEA家族基因在试验草莓根部、叶片、花器官和不同发育期果实等多种组织中均有表达,且与转录表达谱分析结果相一致。Zhou等[18]报道梨KEA家族基因在花粉形成不同时期的表达量极低,但没有研究其在其他组织中的表达特征,与之相应的是,草莓KEA家族基因在盛开期花粉中的表达量相对较低,与之不同的是,草莓KEA家族基因在花药中均有表达,FveKEAI和FveKEA4较为显著。特别是,FveKEAI在草莓不同检测组织中的整体表达水平最高,在花瓣和未成熟果实中尤为突出,推测FveKEAI可能是在花开放和草莓幼果发育过程中发挥重要作用的K+/H+逆向转运体。果实成熟是一个复杂的生物学过程,伴随各种代谢产物的积累和转化,而在成熟期草莓果实中,除FrveKEA4外,其他4个基因的表达水平显著下降,推测这些基因编码的KEA逆向转运体的功能在果实成熟时期发挥的较少,所需的K+较少,有可能将胞内的K+外排或者向其他组织(如韧皮部或叶片)转移,这与同为钾离子转运体的KT/HAK/KU家族转运体类似[23]。
此外,在草莓FveKEAI~FveKEA5启动子区域鉴定到多种顺式作用元件,且均含有光感应、胚乳特异表达和ABA响应的作用元件,说明多种顺式作用元件易与草莓KEA启动区的关键元件相结合进而调控KEA家族基因的表达水平。特别地,拟南芥[17]和大豆21中KEA家族基因在转录水平易受ABA处理的调控,本研究中草莓KEA基因启动子区域均含有ABA响应的作用元件,暗示该家族基因有类似的渗透响应和调节的作用,这为进一步研究草莓KEA转运体的功能及其调控机理提供了理论支持。
参考文献:
[1]VERY A A,SENTENAC H.Molecular mechanisms and regulation of K+ transport in higher plants[J].Annual Review of Plant Biology,2003,54:575-603.
[2]GRABOV A.Plant KT/KUP/HAK potassium transporters:Single family-multiple functions[J].Annals of Botany,2007,99:1035-1041.
[3]DEMIRAL M A,KOSEOGLU A T.Effect of potassium on yield,fruit quality,and chemical composition of green house grown aalia melon[J].Journal of Plant Nutrition,2005,28:93-100.
[4]YURTSEVEN E,KESMEZ G D,UNLUKARA A.The effects of
water salinity and potassium levels on yield,fruit quality and water consumption of a native central anatolian tomato species(Lycopersicon esculantum)[J].Agriculural Water Management,2005,78:128-135.
[5]HARTZ T K,JOHNSTONE P R,FRANCIS D M,et al.Processing tomato yield and fruit quality improved with potassium fertigation[J].Hort Science,2005,40:1862-1867.
[6]宋志忠,郭紹雷,马瑞娟,等.KT/HAK/KUP家族基因在桃开花期的表达及对钾肥施放的响应分析J].中国农业科学,2015,48(6):1177-1185.
[7]宋志忠,许建兰,张斌斌,等.叶面喷施钾肥对霞脆桃果实品质及KUP基因表达的影响[J].江苏农业学报,2018,34(5):1107-1112.
[8]CHANROJS,LU Y,PADMANABAN s,et al.Plant-specific cation/H+ exchanger 17 and its homologs are endomembrane K+ transporters with roles in protein sorting[J].Jourmal of BiologyChemistry,2011,286(39):33931-33941.
[9]CHANROJ S,WANG G,VENEMA K,et al.Conserved and diversified gene families of monovalent cation/H+ antiporters from algaeto flowering plants[J].Frontiers in Plant Science,2012,3:25.
[10]BASSIL E,BLUMWALD E.The ins and outs of intracellular ion homeostasis:NHX-type cation/H+transporters[J].Current Opinion in Plant Biology,2014,22:1-6.
[11]MASER P,THOMINE S,SCHROEDER J I,et al.Phylogenetice relationships within cation transporter families of Arabidopsis[J].Plant Physiology,2001,126:1646 1667.
[12]HAN L,LIJL,WANG L,et al.Identification and localized expression of putative K+/H+ antiporter genes in Arabidopsis[J]Acta Physiologiae Plantarum,2015,37(5):1-14.
[13]ARANDA-SICILIA M N,CAGNAC 0,CHANROJS,et al. Arabidopsis KEA2,a homolog of bacterial KefC,encodesa K+/H+ anti-porter with a chloroplast transit peptide[J].BBA-Biomembranes,2012,1818(9):2362-2371.
[14]ZHENGS,PANT,FAN L G,et al.A novel AtKEA gene family,
homolog of bacterial K+/H+ antiporters,plays potential roles in K+ homeostasis and osmotic adjustment in Arabidopsis[J].PLoS ONE,2013,8(11):e81463.
[15]ARMBRUSTER U,CARRILLO LR,VENEMA K,et al.lon antiport accelerates photosynthetic acclimation in fluctuating light environments[J].Nature Communications,2014,5:5439.
[16]KUNZ H H,GIERTH M,HERDEAN A,et al. Plastidial transporters KEA1,-2,and-3 are essential for chloroplast osmoregula-tion,integrity,and pH regulation in Arabidopsis[J].Proceedingsof the National Academy of Sciences of the United States of Ameri-ca,2014,111(20):7480-7485.
[17]ZHOU H,QI K,LIU X,et al.Genome-wide identification and comparative analysis of the cation proton antiporters family in pearand four other Rosaceae species[J].Molecular Genetics and Genomics,2016,291:1727-1742.
[18]KANG C,DARWISH 0,GERETZ,et al.Genome-scale transcriptomic insights into early-stage fruit development in woodlandstrawberry Fragaria vesca[J].Plant Cell,2013,25:1960-1978.
[19]FAIT A,HANHINEVA K,BELEGGIA R,et al.Reconfiguration of the achene and receptacle metabolic networks during strawberry fruit development[J].Plant Physiology,2008,148(2):730-750.
[20]LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-A AC method[J].Methods,2001,25(4):402-408.
[21]WANG Y,WU W H.Genetic approaches for improvement of the crop potassium acquisition and utilization efficiency[J].CurrentOpinion in Plant Biology,2015,25:46-52.
[22]CHEN H T,CHEN X,WU B Y,et al.Whole-genome identification and expression analysis of K+efflux antiporter(KEA)andNa+/H+antiporter(NHX )families under abiotic stress in soybean[J].Journal of Intergrative Agriculture,2015,14(6):1171-1183.
[23]SONG ZZ,GUOS L,ZHANGC H,et al.KT/HAK/KUP potassium transporter genes differentially expressed during fruit devcelopment,ripening,and postharvest shelf-ife of‘ Xiahui6’peaches[J].Acta Physiologiae Plantarum,2015,37:131.

