CA-SSR多态与扶正抗癌方对吉非替尼治疗晚期非小细胞肺癌疗效的影响*
黄茜, 徐国峰, 陈务华, 张晓轩, 潘宗奇, 周大磊
1广州中医药大学研究生学院(广东广州 510405); 广东省中医院 2中医经典临床应用研究基地, 4扶阳流派工作室, 5肿瘤科(广东广州 510120); 3广东省第二中医院肿瘤科(广东广州 510095); 6中山大学肿瘤防治中心、华南肿瘤学国家重点实验室分子诊断科(广东广州 510160)
目前,肺癌在全世界的发病率持续升高,在我国许多中大城市乃至世界发达国家,已跃居各种恶性肿瘤的首位,其中,非小细胞肺癌(non-small cell lung cancer,NSCLC)占据肺癌总数的80%以上[1]。吉非替尼为治疗晚期NSCLC的首个分子靶向药物,主要针对化疗后复发或无效的晚期NSCLC患者,然而作为一种高度选择性的表皮生长因子受体抑制剂[2](epidermal growth factor receptor inhibitor,EGFR-TKI),吉非替尼的临床疗效存在显著的个体差异,EGFR突变未知人群和非特定人群(亚裔、女性、非吸烟者)很难从中获益,并且大多数患者在初次接受EGFR-TKIs治疗后的10~16个月内会出现疾病进展[3]。如何延缓靶向治疗耐药,是当前癌症研究的亟待解决的关键问题。扶正抗癌方[4]是广东省中医院肿瘤科吴万垠教授通过总结国内著名中医肿瘤专家的经验,制定的健脾理气抑瘤方,在以往的临床实践中,被发现该方剂能提高吉非替尼的临床疗效,但其作用机制尚未明确。国内有研究报道[5]EGFR基因第1内含子CA-SSR多态性与吉非替尼治疗晚期NSCLC的疗效相关。本研究采用PCR扩增和序列测定方法,探讨CA-SSR基因多态性与扶正抗癌方对吉非替尼治疗晚期NSCLC临床疗效间的关系,及其与扶正抗癌方的相互作用,为扶正抗癌方联合吉非替尼治疗晚期NSCLC提供分子生物学依据。
1 资料与方法
1.1 一般资料 2016年10月21日至2017年12月30日,严格按照如下纳入标准:(1)年龄18~80岁,符合中国抗癌协会编著的《新编常见恶性肿瘤诊治规范》[6]NSCLC的诊断标准;(2)临床分期为ⅢB期或Ⅳ期:按2010年AJCC/UICC修订的肺癌国际分期标准;(3)行为状态PS评分0~3分;(4)局部病灶和(或)远处转移病灶可测量或可评估;(5)骨髓、肝、肾、心、肺机能正常者。排除标准:(1)有症状脑转移未得到控制者;(2)有活动性的重复癌患者;(3)同期合并放、化疗或中医药治疗者;(4)合并活动性结核或其他严重的感染性疾病者。排除中途失访而脱落的人群,按年龄、性别、吸烟状态、PS评分、病理类型等因素进行评分匹配(PSM),共纳入接受吉非替尼联合扶正抗癌方治疗和吉非替尼治疗的78例晚期NSCLC患者。其中,39例观察组患者来自广东省中医院肿瘤科门诊或住院部,39例对照组患者来自中山大学肿瘤防治中心门诊或住院部。两组患者的基线资料比较见表1,基线均衡可比。
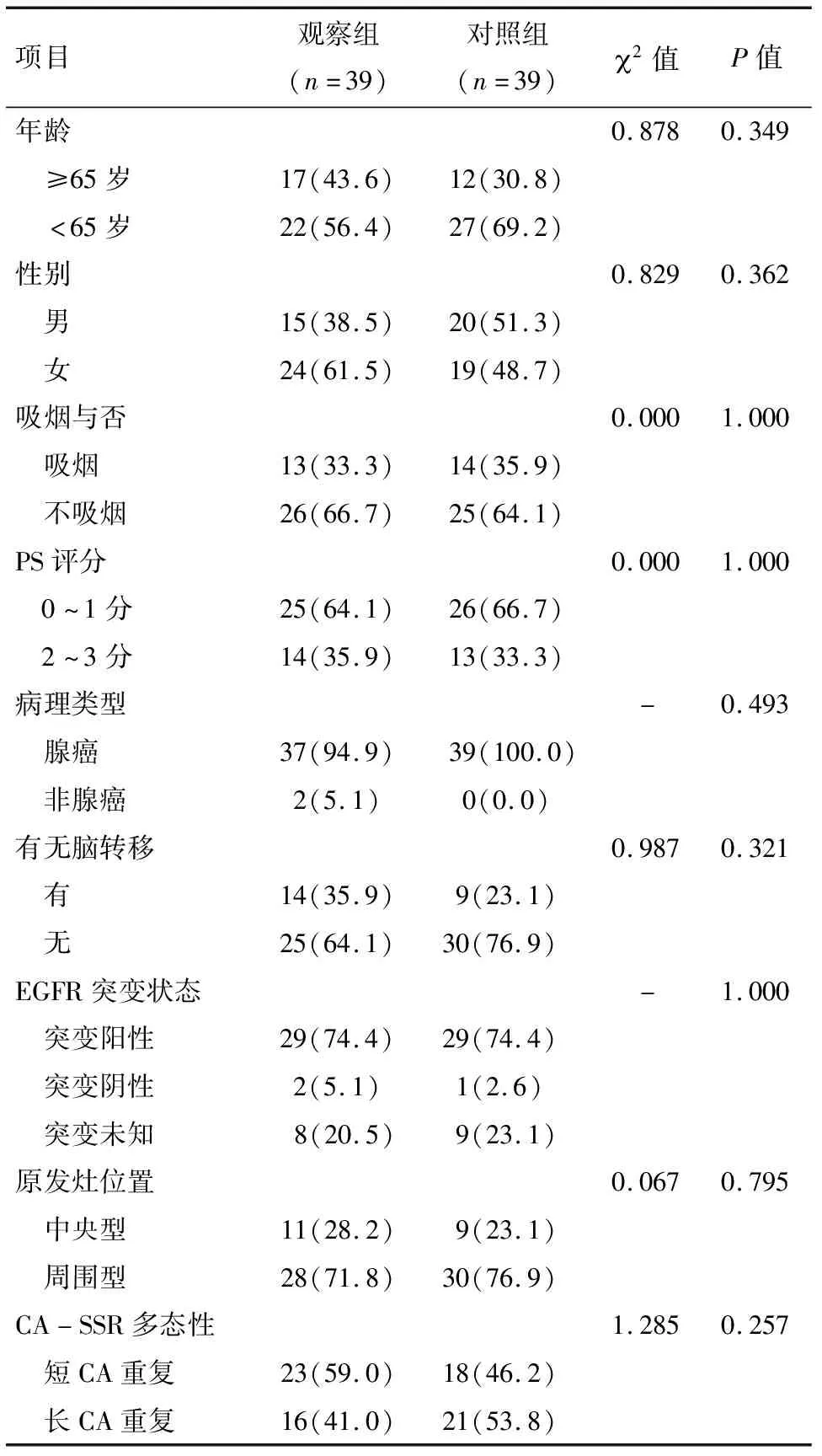
表1 78例晚期NSCLC患者的基线资料比较例(%)
1.2 治疗方法 观察组接受扶正抗癌方(药物组成:太子参30 g,白术15 g,黄芪30 g,白花蛇舌草30 g,龙葵30 g,石见穿30 g,山慈菇30 g,炒薏仁30 g,八月札30 g,蛇泡簕30 g,莪术30 g,甘草10 g)250 mL口服,2次/d,联合吉非替尼250 mg口服,1次/d治疗。对照组接受吉非替尼250 mg口服,1次/d治疗,直至疾病进展或发生不可耐受毒副反应后停药。
1.3 基因分型 在治疗前抽取患者2 mL外周静脉全血,置入乙二胺四乙酸钠(EDTA)抗凝管,离心后置于-70℃超低温冰箱贮存备用。采用酚-氯仿法提取DNA,以DNA为模板进行对EGFR基因第1内含子片段进行PCR扩增,EGFR扩增引物序列分别为:5′-GGGCTCACAGCAAACTTCTC-3′和5′-AAGCCAGACTCGCTCA TGTT-3′,产物大小为298 bp。25 μL PCR反应体系中含0.1 μL模板DNA,引物浓度为0.4 μmol/L。PCR扩增条件为:94℃预变性5 min后,于94℃ 30 s、58℃ 30 s、72℃ 30 s共进行30个循环,最后72℃延伸10 min,得到PCR扩增产物。利用ABI PRISM 310型基因分析仪进行基因序列测定,通过测定PCR扩增片段中连续的CA序列的重复数目,从而明确患者EGFR基因第1内含子区CA-SSR多态的不同基因型。以(CA)16为界[7],将CA-SSR分为短CA重复序列(至少有1条等位基因CA重复数≤16)和长CA重复序列(2条等位基因CA重复数均>16)。
1.4 随访和观察指标 从确诊NSCLC并接受吉非替尼治疗时开始随访,治疗前4周内、治疗后第1个月及以后每3个月进行1次胸部CT检查观察肺部病灶变化,通过CT或MRI检查观察其他部位肿瘤转移病灶变化,参照实体瘤疗效评价标准(RECIST)[8]进行近期疗效评价。末次随访时间为2018年2月,观察终点为疾病进展或死亡。首要观察终点为无进展生存期(progression-free survival,PFS),即患者从首次用药到观察至疾病进展或因任何原因死亡的时间间隔;次要观察终点为中位生存时间(median survival time,MTS),从首次用药到因任何原因死亡的时间间隔,在数据截止日尚生存的患者,将以其最后一次随访时间作为截尾数值进行分析。根据肿瘤疗效评价指标判断为疾病完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)、疾病进展(progression of disease,PD),整体患者的客观缓解率(objective response rate,ORR)=CR+PR,疾病控制率(disease control rate,DCR)=CR+PR+SD。
1.5 统计学方法 应用SPSS 23.0统计软件,采用描述统计分析方法,比较两组患者基线情况及临床特征,如出现影响结局的基线资料不等,进行分层分析;对计量资料采用组间t检验;对计数资料采用四格表确切概率法或2检验;对两组患者的中位生存时间的比较,采用Kaplan-Meier分析法,并绘制生存曲线;对于组间生存差异的单因素分析采用时序检验(Log-rank test);采用Cox多因素风险比例模型评估潜在影响因素对生存时间的影响,并计算HR(风险比)及95%置信区间,检验水平α=0.05。
2 结果
2.1 CA-SSR基因多态结果与患者临床病理特征间的关系 从78例患者中检测到CA重复序列数从14~21不等,共有8种不同的等位基因型。其中等位基因(CA)16最常见,占41%;(CA)20次之,占30.7%。在所有基因型中,以(CA)15/16最常见,占41%;(CA)19/20次之,占28.2%。以(CA)16为分界点,将携带至少1条等位基因CA重复数≤16的序列分为短CA重复序列,共41例(占52.6%)患者;携带2条等位基因CA重复数均>16的序列分为长CA重复序列,共37例(47.4%)患者。CA-SSR基因长短多态性与患者的年龄、性别、吸烟情况、PS评分、有无脑转移、临床分期、EGFR突变状态、原发灶位置、治疗分组等因素无显著关系,差异无统计学意义(P>0.05)。见表2。

表2 CA-SSR基因多态结果与患者临床病理特征间的关系 例(%)
2.2 治疗分组及基因多态与患者近期疗效的关系 整体研究人群疾病CR 0例,PR 20例(25.6%),SD 53例(68%),PD 5例(6.4%),整体患者的ORR=CR+PR为25.6%,DCR为93.6%。其中,两组ORR差异无统计学意义(2=2.421,P>0.05);两组DCR差异无统计学意义(2=1.923,P>0.05)。CA-SSR多态在ORR上差异无统计学意义(2=1.668,P>0.05);携带短CA重复序列对比长CA重复序列的患者在DCR上差异有统计学意义(2=3.882,P<0.05),短CA重复序列患者在DCR上优于长CA重复序列患者。见表3。

表3 治疗分组及基因多态与患者近期疗效的关系
2.3 NSCLC患者临床特征与患者生存期的关系 观察组的PFS是11.6个月,对照组的PFS是9.1个月,二者差异有统计学意义(P<0.05),Kaplan-Meier生存曲线见图1。短CA-SSR组的PFS为11.6个月,长CA-SSR组的PFS为9.0个月,两组间差异有统计学意义(P<0.05),Kaplan-Meier生存曲线见图2。EGFR基因突变阳性、EGFR基因突变阴性、EGFR基因突变未知患者的PFS分别为10、7.7、10.7个月,EGFR基因突变状态在PFS上差异有统计学意义(P<0.05),Kaplan-Meier生存曲线见图3。单因素分析显示,年龄、性别、吸烟与否、治疗前PS评分、有无脑转移、临床分期、原发灶位置等因素与PFS无明显关系,而与CA-SSR基因多态、治疗分组、EGFR基因突变情况有关,见表4。由于本研究随访时间有限,至观察时间截点,所有治疗人群中仅有12例(15.4%)患者出现死亡,66例(84.6%)患者至观察时间截点仍存活,整体人群的删失数据较多,无法计算患者的MST,故而无法对MST进行分析比较。
2.4 Cox多因素回归分析 为控制可能的混杂因素对PFS的影响,将可能影响研究人群PFS的治疗分组、CA-SSR多态性、EGFR突变状态等3种因素,以及临床可能存在意义的年龄、性别、吸烟状况、有无脑转移、临床分期、治疗前PS评分、原发灶位置等7种因素纳入Cox比例风险回归模型进行多因素分析。结果显示,扶正抗癌方联合吉非替尼治疗的观察组的PFS明显长于吉非替尼单药治疗的对照组,差异有统计学意义(HR=0.422,95%CI:0.21~0.85,P<0.05)。短CA重复序列患者的PFS比长CA重复序列患者长,CA-SSR基因多态性对晚期NSCLC患者PFS的影响具有统计学意义(HR=1.97,95%CI:1.03~3.76,P<0.05)。见表5

表4 NSCLC患者临床特征与中位无进展生存期的关系
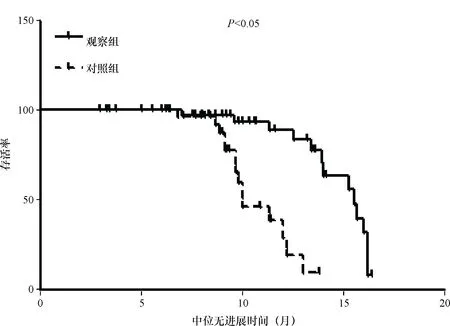
图1 两组患者PFS的Kaplan-Meier生存曲线
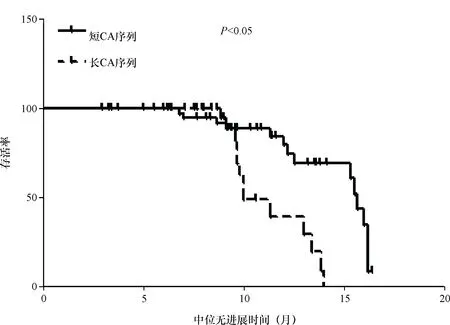
图2 CA-SSR基因多态与PFS的Kaplan-Meier生存曲线

图3 EGFR突变情况与PFS的Kaplan-Meier生存曲线

表5 Cox回归分析人口学特征和临床病理因素对PFS的影响
2.5 CA-SSR基因多态性与治疗分组对PFS的交互影响 观察组伴短CA重复序列患者的PFS为12.4个月,观察组伴长CA重复序列患者的PFS为9.84个月;对照组伴短CA重复序列患者的PFS为9.7个月,对照组伴长CA重复序列患者的PFS为7.61个月,但经析因设计资料的方差分析结果显示:两组的PFS差异有统计学意义(F=15.23,P<0.05),CA-SSR基因多态对PFS的影响有统计学意义(F=13.67,P<0.001),治疗分组和CA-SSR基因多态的交互作用对PFS的影响差异无统计学意义(F=0.14,P>0.05)。见表6。
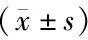
表6 CA-SSR基因多态性与治疗分组对PFS的影响 月
3 讨论
近年来,随着分子生物学、分子遗传学特别是基因组学的发展,医学家们逐渐认识到不同个体对同一药物的疗效差异大多源于基因的差异[9]。EGFR-TKI靶标基因EGFR第1内含子区域存在不同长度的CA重复序列(CA-SSR),CA-SSR长度多态性能够影响EGFR的mRNA及蛋白表达水平,进而影响EGFR受体信号的表达及基因转录的效率[10]。已有多项研究试图探讨CA-SSR基因多态性与EGFR-TKI疗效敏感性的相关性。马飞等[11]研究发现 CA-SSR多态性与吉非替尼的近期疗效密切相关。周崧雯等[12]研究结果也显示,在接受EGFR-TKI治疗后,短CA-SSR患者比长CA-SSR患者的PFS明显延长,MST无明显延长。但Jung等[13]研究并没有发现不同CA-SSR多态性的患者对吉非替尼有更好的客观缓解率,与PFS及OS均无关联性。结果存在争议的原因[14]可能在于CA-SSR多态性存在种族差异。
与传统化疗药物相比[15],靶向治疗的针对性更强,靶向药物对肿瘤细胞的杀伤性更大,对正常细胞的毒副作用也远远低于传统化疗药物。但是大部分患者在服用EGFR-TKI初诊的10~12个月内将不可避免地出现耐药现象[16]。许多研究发现EGFR-TKI联合中医药治疗晚期NSCLC有较好的临床疗效,不仅能够减毒[17],还能增敏增效[18-19]。扶正抗癌方是广东省中医院肿瘤科在健脾理气经验方的基础上,根据扶正祛邪的原则,加入解毒抑瘤之品而成,现已应用于临床十余年,临床联合吉非替尼治疗NSCLC疗效优于吉非替尼单药治疗[20],但其作用机制尚不明确。本研究试图从CA-SSR多态性入手,结合扶正抗癌方对吉非替尼治疗晚期NSCLC的临床疗效观察,以寻求二者之间的关系,从而为中医药联合EGFR-TKI提供分子生物学依据,促进中医药精准医学的发展。
本研究发现扶正抗癌方联合吉非替尼相较于吉非替尼单药治疗晚期NSCLC具有延长PFS的作用,而CA-SSR多态性也可影响晚期NSCLC患者的DCR和PFS,但并未发现CA-SSR多态性对扶正抗癌方联合吉非替尼治疗晚期NSCLC具有疗效预测意义。考虑到本研究属于前瞻性的观察试验研究,存在样本量过小、非随机对照试验等局限性,而且由于随访时间限制,导致整体人群的MST值缺失,无法对中位生存期进行分析比较,可能使研究结果存在偏倚。为明确扶正抗癌方对吉非替尼是否有增效作用、CA-SSR多态性对扶正抗癌方联合吉非替尼治疗后患者的远期疗效是否有影响,仍需要后续扩大样本量、延长观察时间加以验证。

